Hier volgt een beschrijving van het opzetten en uitvoeren van een colorimetrische bepaling om de concentratie van een stof in oplossing te bepalen.
Algemene aanpak
We kunnen geen materiaal onder een microscoop leggen en het aantal moleculen per volume-eenheid tellen, zoals we het aantal cellen per volume-eenheid kunnen tellen. We moeten iets vinden dat we kunnen meten en dat evenredig is met de concentratie van de stof in kwestie. De meest gebruikte meting in analyses is de absorptie van licht. De wet van Beer zegt ons dat als een opgeloste stof licht van een bepaalde golflengte absorbeert, de absorptie recht evenredig is met de concentratie van de stof in oplossing. Een apparaat, een spectrofotometer genaamd, wordt gebruikt om de extinctie te meten en weer te geven en/of te registreren in kwantificeerbare eenheden. Vaak absorbeert de stof zelf het licht niet zodanig dat een praktische bepaling mogelijk is. Het kan nodig zijn een of meer reagentia te gebruiken om gekleurde verbindingen te produceren in verhouding tot de concentratie van onbekende.
Het meten van de absorptie van licht door een monster zegt ons heel weinig, tenzij we een standaard hebben om mee te vergelijken. Bijvoorbeeld, als monster X een extinctie vertoont van 0,5, wat is dan de werkelijke concentratie van X? Als we een monster met een bekende concentratie hebben, en dat monster geeft ook een extinctie van 0,5, dan zijn we er redelijk zeker van dat de stof diezelfde concentratie heeft. Stel dat je een aantal monsters hebt, en dat de concentraties daarvan variëren. Het zou nuttig zijn om een aantal standaards te hebben die het volledige bereik van waarschijnlijke concentraties van onze onbekende overspannen. Dat is waar een standaardkromme om de hoek komt kijken. We bereiden een reeks standaards met een bekende concentratie van X, variërend van een lage tot een hoge concentratie. We voeren de test uit en zetten voor elke standaard de extinctie uit tegen de concentratie. Met behulp van deze standaardcurve kunnen we de concentratie van een onbekende aflezen aan de hand van zijn extinctie.
Controls
Wanneer we een assay uitvoeren, moeten we ervoor zorgen dat alleen de stof die we testen verantwoordelijk is voor de extinctie van licht in het golflengtegebied van belang. Alle omstandigheden waaronder standaarden en onbekenden worden bereid, moeten identiek zijn. Als oplosmiddelen in de buffers van het monster de extinctie beïnvloeden, hebben we een probleem. We zullen geen nauwkeurige resultaten verkrijgen als we de volumes waarin we standaarden en onbekenden bereiden en analyseren, variëren. Het tijdstip waarop we de extinctie aflezen, de temperatuur waarbij we de materialen bewaren en alle andere fysische factoren moeten gelijk blijven. Omdat het niet altijd praktisch is om identieke buffers te gebruiken voor alle onbekenden en standaarden, hoeven we er alleen maar voor te zorgen dat geen van de componenten van een van de buffers een significant effect heeft op de extinctie.
Wanneer we voor alle standaarden en onbekenden hetzelfde volume gebruiken, vereenvoudigen we de analyse aanzienlijk. De standaardcurve kan de extinctie uitzetten tegen de hoeveelheid stof in plaats van de concentratie. Het kan minder verwarrend zijn om met hoeveelheden te werken tijdens het uitvoeren van een assay, vooral als er verdunningen nodig zijn. Zolang men het oorspronkelijke volume van het monster kent dat in een assay is gebruikt, is het bepalen van de concentratie eenvoudig.
Complicatie
Alle assays hebben grenzen. Hoeveelheden stof onder een bepaald minimum zullen niet detecteerbaar zijn. Boven een bepaalde maximumhoeveelheid of -concentratie raakt een assay verzadigd, d.w.z. dat verhogingen van de hoeveelheid of concentratie geen effect meer hebben op de extinctie. Over het algemeen proberen we te werken binnen het lineaire bereik van een bepaling, d.w.z. waar de extinctie recht evenredig is met de concentratie. Idealiter stellen we standaarden op die het volledige bruikbare bereik van een assay omvatten. Dat wil zeggen, we optimaliseren het bereik van de assay.
Vaak is een monster zo geconcentreerd, dat wanneer men het voorgeschreven volume monster analyseert, het resultaat niet op de schaal ligt – het assay-reagens is verzadigd. De oplossing is dan het monster te verdunnen. Als bijvoorbeeld het volume van elke standaard of elk monster 1 ml is, en 1 ml van je onbekende een resultaat geeft dat buiten de schaal valt, kun je 0,1 ml monster toevoegen aan een reageerbuis samen met 0,9 ml buffer. Als u een concentratie afleest van de standaardcurve, vermenigvuldigt u het resultaat met 10 om de werkelijke concentratie in het monster te krijgen. Als u een hoeveelheid uit de standaardcurve afleest, deelt u die hoeveelheid gewoon door 0,1 ml om uw concentratie te krijgen.
Wanneer monsters zo geconcentreerd zijn dat u niet nauwkeurig genoeg een kleine hoeveelheid kunt pipetteren, moet u mogelijk seriële verdunningen uitvoeren.
Voorbeeld: een standaardkromme voorbereiden
We zullen een hypothetische assay opzetten om stof X te meten. Wanneer X wordt gemengd met assayreagens wordt een complex gevormd dat licht absorbeert bij golflengte 400 nm. Voor onze spectrofotometer moeten we 2 ml volume in elke cuvet doen. Een cuvette is een doorzichtig vat dat in een lichtweg wordt geplaatst om de extinctie te meten. Om de juiste verhouding tussen reagens en monster te krijgen, maken we van ons monstervolume 0,5 ml en voegen we aan elk buisje 1,5 ml kleurreagens toe. Op deze manier opgezet kan de assay hoeveelheden X detecteren van zo weinig als 10 microgram (µg) tot zo veel als 2 milligram (mg).
Reference
Om de spectrofotometer te ijken hebben we een referentiebuis nodig die in alle opzichten identiek is aan de standaarden en monsters, behalve dat hij geen stof X bevat. Met de lichtweg geblokkeerd zal de spectrofotometer worden ingesteld om oneindige extinctie af te lezen (helemaal geen transmissie van licht). Met de referentiebuis in de lichtweg stellen we de spectrofotometer in op nul extinctie. Op die manier zal een monster met X een extinctie binnen dat bereik geven. De referentiebuis wordt gebruikt om ons het maximale dynamische bereik te geven.
Voor dit hypothetische voorbeeld zal de referentie 0,5 ml monsterbuffer en 1,5 ml kleurreagens bevatten.
Standaarden
Dit voorbeeld beschrijft een hypothetische assay die alleen ter illustratie dient.
We willen de beste nauwkeurigheid die we kunnen krijgen, en ons bereik beslaat twee orden van grootte, dus een manier om de standaard curve op te zetten is met een logaritmische progressie van standaarden. We hebben standaarden nodig van 0.01 mg tot 2 mg. Laten we hoeveelheden van 0,01, 0,02, 0,05, 0,1, 0,2, 0,5, 1, en 2 mg proberen. Het laatste gat is nogal groot, dus laten we er een standaard van, zeg, 1,5 mg ingooien. Om standaarden te maken is het handig om te beginnen met een geconcentreerde stamoplossing van de stof. De grootste hoeveelheid die we nodig hebben is 2 mg, in een volume van 0,5 ml. Laten we, om ons wat “speelruimte” te geven, een voorraadoplossing maken van 5 mg/ml stof X. In de volgende tabel staan de berekeningen.
Tabel 1. Voorbeeld van het plannen van een standaardcurve. De eiwitconcentratie in de stockoplossing was 5 mg/ml. Dit voorbeeld dient slechts ter illustratie.
| hoeveelheid stof X (mg) | volume voorraadoplossing (µl) | volume buffer (µl) |
|
0 (referentie) |
0 | 500 |
| 0.01 | 2 | 498* |
| 0.02 | 4 | 496* |
| 0.05 | 490 | |
| 0.1 | 20 | 480 |
| 0.2 | 40 | 460 |
| 0.5 | 100 | 400 |
| 1 | 200 | 300 |
| 1.5 | 300 | 200 |
| 2 | 400 | 100 |
*Het is gebruikelijk pipettoren te gebruiken die ons volumes geven die op niet meer dan 2 significante cijfers nauwkeurig zijn.
Het volume van de buffer is niet zo kritisch als het volume van de voorraadoplossing. Fouten bij het pipetteren van de buffer hebben invloed op het totale volume en dus op de concentratie van het kleurreagens. Fouten van minder dan 1% zullen geen significant effect hebben op de resultaten. In feite, als het volume van de kleur reagens veel groter is dan het volume van het monster (niet in dit geval) zouden we niet eens nodig om volumes gelijk te maken door het toevoegen van buffer.
Sommige laboratoria zijn niet uitgerust met pipettoren die nauwkeurig onder de 5 µl gaan. Het kan nodig zijn om een seriële verdunning uit te voeren om, laten we zeggen, 2 of 4 µl voorraadoplossing in een reageerbuis te krijgen.
Bemonstervoorbereiding
Het helpt om een redelijke schatting te hebben van de concentraties van het monster die men kan verwachten. Zelfs met een dergelijke schatting is het goed om monsters te bereiden met een reeks verdunningen, voor het geval een monster zo geconcentreerd is dat de extinctiemetingen buiten het bereik vallen.
Voor de assay in het voorbeeld, als we 500 µl monster in een assay-buisje gebruiken (het maximale volume), zou de concentratie minder dan 4 mg/ml moeten zijn om een leesbare extinctie te geven. Aan de andere kant zouden we zoveel willen hebben als het monster, laten we zeggen, tien keer minder geconcentreerd was. Omdat we niets weten over de concentratie van een bepaald monster, zouden we één buisje vullen met 500 µl om dat bereik te bestrijken. Aangezien de test een breed concentratiebereik bestrijkt, kunnen we 50 µl in een tweede reageerbuis gebruiken. Het monster kan nu zo geconcentreerd zijn als 40 mg/ml en we zullen nog steeds 4 mg of minder in de reageerbuis hebben, wat een leesbaar resultaat oplevert. Om alle bases te dekken, kunnen we een derde buis met slechts 5 µl monster analyseren.
Run the assay
Wanneer alle standaards en onbekenden klaar zijn, hebben we:
- 1 referentiebuis
- een aantal standaarden die het volledige bereik van de assay bestrijken
- twee of drie assaybuizen per monster die een reeks verdunningen vertegenwoordigen
Het is tijd om de procedure voor kleurontwikkeling uit te voeren, die zo eenvoudig kan zijn als het toevoegen van een kleurreagens en het laten zitten van de monsters gedurende een paar minuten. Indien praktisch uitvoerbaar, moet de behandeling van elke standaard en elk monster zo worden getimed, dat de extinctie voor elke buis met hetzelfde tijdsinterval wordt afgelezen. Het instrument moet worden gekalibreerd en vervolgens moeten voor elk buisje de extincties in volgorde worden afgelezen. Een standaardcurve wordt verkregen door de extinctie uit te zetten tegen de hoeveelheid van stof X. Als het verband duidelijk lineair is, is een standaardcurve niet eens nodig. De hoeveelheden kunnen met behulp van interpolatie worden bepaald. De eerste keer dat een assay wordt gebruikt, moet een curve worden geconstrueerd om de nauwkeurigheid en lineariteit te controleren.
Voorbeeld van een standaardcurve
Hier ziet de plot eruit in een laboratoriumnotitieboekje (de student heeft duidelijk een uitstekend handschrift). De relatie is niet perfect lineair, maar vertoont een typisch uitdovingspatroon.
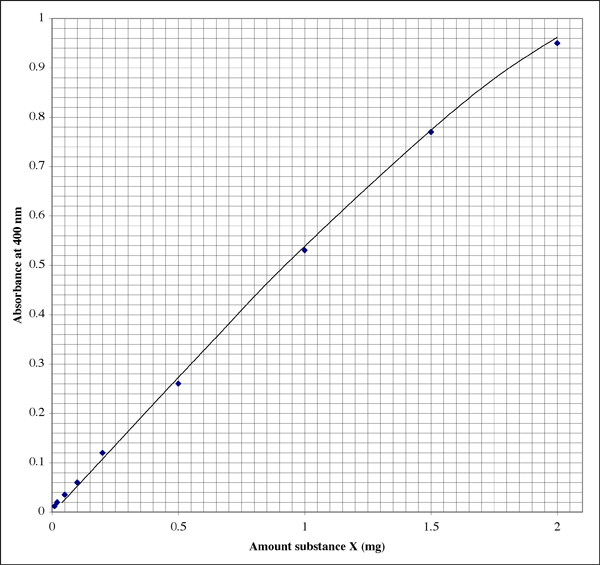
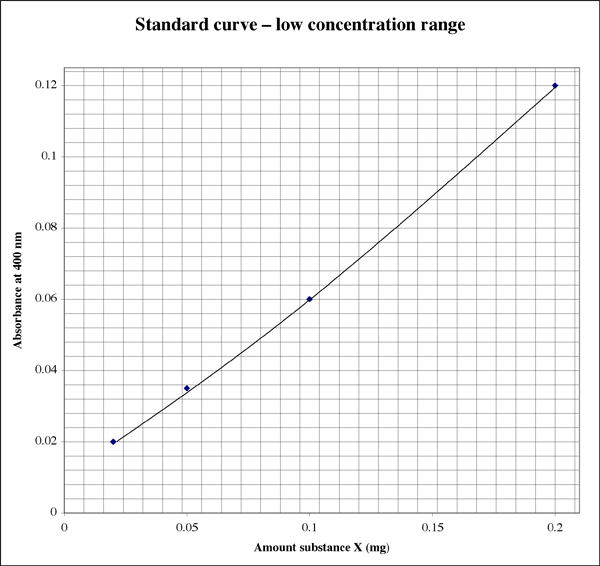
Omdat het bereik zo groot is, zou een student voor monsters met zeer lage extincties een tweede plot met een hogere resolutie kunnen gebruiken.
Bepaal de concentratie van een monster
Een concentratie is een hoeveelheid van iets per volume-eenheid. We rapporteren eiwitconcentraties meestal in milligrammen per milliliter (mg/ml), hoewel het soms handig is om microgrammen/microliter (µg/µl) of misschien zelfs µg/ml (voor zeer kleine concentraties) te gebruiken. Voor een onbekende delen we de hoeveelheid stof (uit de standaardcurve) door het volume van het monster dat in de bepaling wordt gebruikt. Dit volume is niet het volume van de assay, noch het volume van het verdunde monster. Deel door het volume van het onverdunde monster dat u in de reageerbuis voor de bepaling hebt gedaan.
Let ons veronderstellen dat u drie reageerbuizen voor monster #1 bereidde, die respectievelijk 500 µl, 50 µl, en 5 µl monster bevatten. Stel dat ze absorptiewaarden gaven van respectievelijk 0,86, 0,12, en 0,01. De laatste extinctie is natuurlijk niet op de schaal. Het intercept zou nul moeten zijn, maar we kunnen er niet op rekenen dat zeer lage extincties ons voldoende nauwkeurige metingen geven.
Een extinctie van 0,86 komt overeen met 1,7 mg stof X. Het volume was 500 µl (0,5 ml), dus krijgen we een concentratie van 3,4 mg/ml. Klinkt goed. Als we de andere afleesbare buis bekijken, geeft een extinctie van 0,12 aan dat de buis 0,20 mg stof X bevatte. Het volume was 50 µl (0,050 ml). De concentratie zou 0,20 mg/0,050 ml = 4,0 mg/ml moeten zijn. Welk resultaat gebruiken we, of nemen we een gemiddelde?
Ik heb ontdekt dat het gebruik van de absorptiemeting die het dichtst bij het midden van het gevoelige bereik ligt, de meest nauwkeurige resultaten geeft. In het voorbeeld hierboven is het midden een extinctie van 0,5, wat overeenkomt met 0,1 mg stof. De extinctieschaal is logaritmisch, zodat zelfs van een digitaal display de aflezingen betrouwbaarder zijn aan de lage kant van de schaal. Bij zeer lage extincties zullen een of meer onbekende factoren, zoals een defect in de monsterbuis of de cuvet, echter een sterker effect hebben op de extinctiewaarde dan bij hogere extincties. Aan de bovenkant van het bereik nadert het kleurreagens de verzadiging, zodat u niet alleen minder resolutie hebt tussen absorptiewaarden, maar het reagens ook minder gevoelig is voor verschillen in eiwitconcentratie.