Opisano tutaj, jak ustawić i przeprowadzić test kolorymetryczny w celu określenia stężenia substancji, która jest w roztworze.
Podejście ogólne
Nie możemy umieścić materiału pod mikroskopem i policzyć liczbę cząsteczek na jednostkę objętości w sposób, w jaki możemy policzyć liczbę komórek na jednostkę objętości. Musimy znaleźć coś, co możemy zmierzyć, co jest proporcjonalne do stężenia interesującej nas substancji. Miarą najczęściej stosowaną w oznaczeniach jest absorbancja światła. Prawo Beera mówi nam, że jeśli substancja rozpuszczona absorbuje światło o określonej długości fali, absorbancja jest wprost proporcjonalna do stężenia substancji w roztworze. Urządzenie zwane spektrofotometrem jest używane do pomiaru i wyświetlania i/lub zapisywania absorbancji w jednostkach wymiernych. Często substancja sama w sobie nie absorbuje światła w stopniu pozwalającym na przeprowadzenie praktycznego oznaczenia. Możemy być zmuszeni do zastosowania jednego lub więcej odczynników w celu wytworzenia barwnych związków proporcjonalnie do stężenia nieznanego.
Pomiar absorbancji światła przez próbkę mówi nam bardzo niewiele, chyba że mamy standard do porównania. Na przykład, jeśli próbka X wykazuje absorbancję 0,5, jakie jest rzeczywiste stężenie X? Jeśli mamy próbkę o znanym stężeniu i ta próbka również wykazuje absorbancję 0,5, to jesteśmy w miarę pewni, że substancja ma takie samo stężenie. Załóżmy, że mamy kilka próbek, a ich stężenia są różne. Przydatne byłoby posiadanie pewnej liczby wzorców, które obejmowałyby pełny zakres prawdopodobnych stężeń naszej niewiadomej. W tym miejscu pojawia się krzywa wzorcowa. Przygotowujemy serię wzorców o znanym stężeniu X, w zakresie od niskiego do wysokiego stężenia. Przeprowadzamy analizę i wykreślamy absorbancję w zależności od stężenia dla każdego standardu. Używając tej krzywej standardowej możemy odczytać stężenie dla nieznanego, biorąc pod uwagę jego odczyt absorbancji.
Kontrola
Podczas przeprowadzania analizy musimy się upewnić, że tylko substancja, którą badamy jest odpowiedzialna za absorpcję światła w interesującym nas zakresie długości fali. Wszystkie warunki, w których przygotowywane są wzorce i niewiadome powinny być identyczne. Jeżeli rozpuszczalniki w buforach do próbek wpływają na absorbancję, to mamy problem. Nie uzyskamy dokładnych wyników, jeśli będziemy zmieniać objętości, w których przygotowujemy i oznaczamy wzorce i próby niewiadome. Czas odczytu absorbancji, temperatura, w której przechowujemy materiały i wszystkie inne czynniki fizyczne powinny być takie same. Ponieważ nie zawsze jest praktyczne użycie identycznych buforów dla wszystkich niewiadomych i wzorców, musimy tylko zapewnić, że żaden ze składników któregokolwiek z buforów nie ma znaczącego wpływu na absorbancję.
Gdy używamy tej samej objętości dla wszystkich wzorców i niewiadomych, znacznie upraszczamy analizę. Krzywa standardowa może wykreślać absorbancję w zależności od ilości substancji, a nie stężenia. Praca z ilościami podczas wykonywania oznaczenia może być mniej myląca, szczególnie jeśli wymagane są rozcieńczenia. Tak długo, jak znasz oryginalną objętość próbki, która została użyta do analizy, określenie stężenia jest łatwe.
Komplikacja
Wszystkie analizy mają limity. Ilości substancji poniżej pewnego minimum będą niewykrywalne. Powyżej pewnej maksymalnej ilości lub stężenia test staje się nasycony, co oznacza, że wzrost ilości lub stężenia nie wpływa na absorbancję. Ogólnie rzecz biorąc, staramy się pracować w zakresie liniowym analizy, to znaczy tam, gdzie absorbancja jest wprost proporcjonalna do stężenia. Idealnie byłoby, gdybyśmy ustawili standardy, które obejmują cały użyteczny zakres analizy. To znaczy, że optymalizujemy zakres analizy.
Często próbka jest tak skoncentrowana, że po oznaczeniu zalecanej objętości próbki wynik jest poza skalą – odczynnik testowy jest nasycony. Rozwiązaniem jest wtedy rozcieńczenie próbki. Na przykład, jeśli objętość każdego wzorca lub próbki wynosi 1 ml, a 1 ml próbki nieznanej daje wynik poza skalą, można dodać 0,1 ml próbki do probówki wraz z 0,9 ml buforu. Jeśli odczytałeś stężenie z krzywej wzorcowej, pomnóż wynik przez 10, aby uzyskać rzeczywiste stężenie w próbce. Jeśli odczytasz ilość z krzywej wzorcowej, wtedy po prostu podziel tę ilość przez 0.1 ml, aby uzyskać stężenie.
Gdy próbki są tak skoncentrowane, że nie można dokładnie pipetować wystarczająco małej ilości, może być konieczne przeprowadzenie seryjnych rozcieńczeń.
Przykład: przygotowanie krzywej wzorcowej
Założymy hipotetyczny test do pomiaru substancji X. Kiedy X jest zmieszany z odczynnikiem testowym, tworzy się kompleks, który absorbuje światło o długości fali 400 nm. Nasz spektrofotometr wymaga, abyśmy do każdej kuwety włożyli 2 ml objętości. Kuweta to przezroczyste naczynie, które umieszcza się na drodze światła w celu pomiaru absorbancji. Aby uzyskać właściwą proporcję odczynnika testowego do próbki, zwiększamy objętość próbki do 0,5 ml i dodajemy 1,5 ml odczynnika barwnego do każdej probówki. Ustawiony w ten sposób test może wykryć ilości X tak małe jak 10 mikrogramów (µg) do tak dużych jak 2 miligramy (mg).
Referencja
Do kalibracji spektrofotometru potrzebujemy probówki referencyjnej, która jest identyczna pod każdym względem do wzorców i próbek, z wyjątkiem tego, że nie zawiera żadnej substancji X. Z zablokowaną ścieżką światła spektrofotometr będzie ustawiony na odczyt nieskończonej absorbancji (brak przepuszczalności światła w ogóle). Z rurką referencyjną w ścieżce światła ustawimy spektrofotometr na odczyt zerowej absorbancji. W ten sposób próbka zawierająca X będzie dawała absorbancję w tym zakresie. Probówka referencyjna jest używana w celu uzyskania maksymalnego zakresu dynamicznego.
W tym hipotetycznym przykładzie probówka referencyjna będzie zawierała 0,5 ml buforu do próbek i 1,5 ml odczynnika barwnego.
Standardy
Przykład ten opisuje hipotetyczne badanie wyłącznie w celach ilustracyjnych.
Chcemy uzyskać najlepszą dokładność, jaką możemy uzyskać, a nasz zakres obejmuje dwa rzędy wielkości, więc jednym ze sposobów ustawienia krzywej wzorcowej jest logarytmiczny postęp wzorców. Potrzebujemy wzorców od 0,01 mg do 2 mg. Spróbujmy ilości 0.01, 0.02, 0.05, 0.1, 0.2, 0.5, 1, i 2 mg. Ostatnia luka jest dość szeroka, więc wrzućmy jeden wzorzec o wartości, powiedzmy, 1,5 mg. Aby przygotować wzorce wygodnie jest zacząć od stężonego roztworu podstawowego danej substancji. Największa ilość jaką potrzebujemy to 2 mg, w objętości 0,5 ml. Aby dać nam trochę swobody, przygotujmy roztwór podstawowy substancji X o stężeniu 5 mg/ml. Poniższa tabela przedstawia obliczenia.
Tabela 1. Przykład jak zaplanować krzywą wzorcową. Stężenie białka w roztworze wyjściowym wynosiło 5 mg/ml. Przykład ten służy wyłącznie do celów ilustracyjnych.
| ilość substancji X (mg) | objętość roztworu podstawowego (µl) | objętość buforu (µl) |
|
0 (odniesienie) |
0 | 500 |
| 0.01 | 2 | 498* |
| 0.02 | 4 | 496* |
| 0.05 | 490 | |
| 0.1 | 20 | 480 |
| 0.2 | 40 | 460 |
| 0.5 | 100 | 400 |
| 1 | 200 | 300 |
| 1.5 | 300 | 200 |
| 2 | 400 | 100 |
*Powszechnie stosuje się pipety, które podają objętości z dokładnością do nie więcej niż 2 cyfr znaczących.
Objętość buforu nie jest tak krytyczna jak objętość roztworu podstawowego. Błędy w pipetowaniu buforu wpływają na całkowitą objętość, a tym samym na stężenie odczynnika barwnego. Błędy mniejsze niż 1% nie będą miały znaczącego wpływu na wyniki. W rzeczywistości, jeśli objętość odczynnika kolorowego znacznie przekracza objętość próbki (nie w tym przypadku), nie będziemy musieli nawet wyrównywać objętości przez dodanie buforu.
Niektóre laboratoria nie są wyposażone w pipety, które schodzą z dokładnością poniżej 5 µl. Może być konieczne przeprowadzenie seryjnego rozcieńczenia, aby uzyskać, powiedzmy, 2 lub 4 µl roztworu podstawowego w probówce do analizy.
Przygotowanie próbki
Pomocne jest posiadanie rozsądnego oszacowania zakresów stężeń próbki, których można się spodziewać. Nawet przy takim oszacowaniu dobrze jest przygotować próbki z szeregiem rozcieńczeń, na wypadek gdyby próbka była tak stężona, że odczyty absorbancji są poza zakresem.
Dla analizy w przykładzie, jeśli użyjemy 500 µl próbki w probówce do analizy (maksymalna objętość), jej stężenie musiałoby być mniejsze niż 4 mg/ml, aby dać czytelną absorbancję. Z drugiej strony, tyle samo chcielibyśmy uzyskać, gdyby próbka była, powiedzmy, dziesięciokrotnie mniej stężona. Nie wiedząc nic o stężeniu danej próbki, do jednej probówki wlewamy 500 µl, aby pokryć ten zakres. Ponieważ analiza obejmuje szeroki zakres stężeń, możemy użyć 50 µl w drugiej probówce. Teraz próbka może mieć stężenie 40 mg/ml, a w probówce z analizą nadal będzie znajdować się 4 mg lub mniej, co da czytelny wynik. Aby pokryć wszystkie podstawy, możemy przeprowadzić analizę w trzeciej probówce, używając tylko 5 µl próbki.
Run the assay
Gdy wszystkie wzorce i niewiadome są gotowe, będziemy mieli:
- 1 probówkę referencyjną
- jakąś liczbę wzorców, które obejmują pełny zakres analizy
- dwie lub trzy probówki na próbkę reprezentujące serię rozcieńczeń
Czas przeprowadzić procedurę wywoływania barwy, która może być tak prosta jak dodanie odczynnika barwnego i pozostawienie próbek na kilka minut. Gdy jest to praktyczne, obróbka każdego wzorca i próbki powinna być tak rozłożona w czasie, aby absorbancja była odczytywana w tym samym odstępie czasu dla każdej probówki. Urządzenie powinno być skalibrowane, a następnie absorbancje powinny być pobierane dla każdej probówki w kolejności. Krzywą wzorcową otrzymuje się przez wykreślenie absorbancji w stosunku do ilości substancji X. Jeżeli zależność jest wyraźnie liniowa, krzywa wzorcowa nie jest nawet konieczna. Ilości można określić za pomocą interpolacji. Krzywą należy skonstruować przy pierwszym użyciu testu, aby sprawdzić jego dokładność i liniowość.
Przykład krzywej standardowej
Oto jak może wyglądać wykres w zeszycie laboratoryjnym (student ma oczywiście doskonałe pismo odręczne). Zależność nie jest idealnie liniowa, raczej pokazuje typowy wzór wymierania.
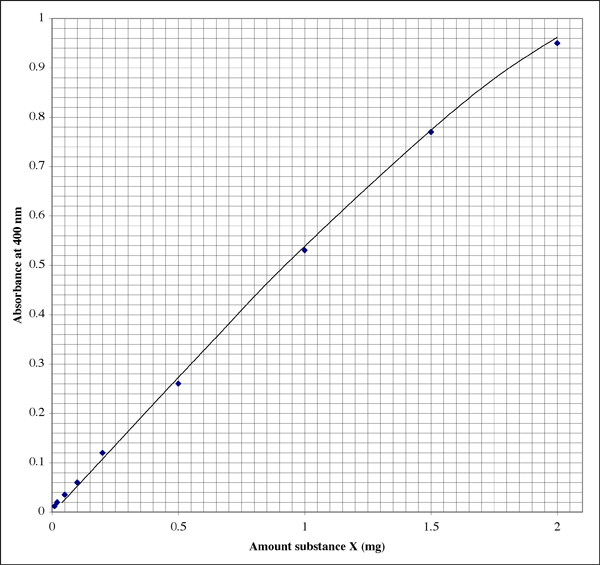
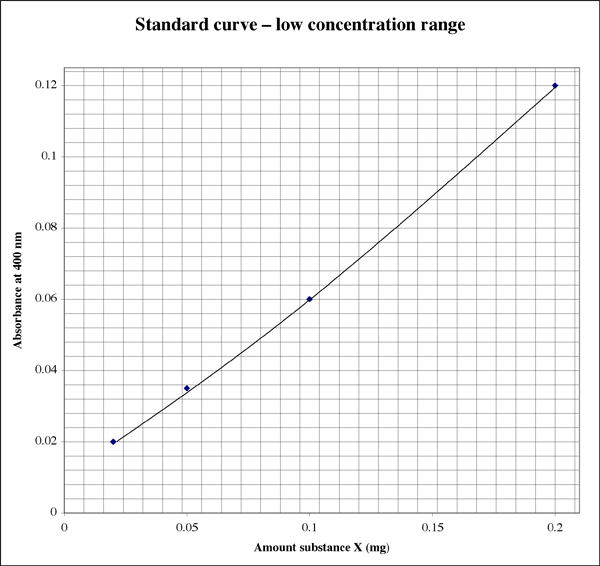
Ponieważ zakres jest tak szeroki, dla próbek dających bardzo niskie odczyty absorbancji student może chcieć mieć drugi wykres o wyższej rozdzielczości.
Określanie stężenia próbki
Stężenie to ilość czegoś w jednostce objętości. Zazwyczaj podajemy stężenia białek w miligramach na mililitr (mg/ml), chociaż czasami wygodnie jest używać mikrogramów na mikrolitr (µg/µl) lub nawet µg/ml (dla bardzo małych stężeń). W przypadku nieznanego dzielimy ilość substancji (z krzywej wzorcowej) przez objętość próbki użytej w oznaczeniu. Należy zauważyć, że ta objętość nie jest objętością oznaczenia, ani objętością rozcieńczonej próbki. Podziel przez objętość nierozcieńczonej próbki, którą umieściłeś w probówce do analizy.
Załóżmy, że przygotowałeś trzy probówki do oznaczania próbki #1, zawierające odpowiednio 500 µl, 50 µl i 5 µl próbki. Załóżmy, że dały one odczyty absorbancji odpowiednio 0,86, 0,12 i 0,01. Ostatnia absorbancja jest oczywiście poza skalą. Intercept powinien wynosić zero, ale nie możemy liczyć na to, że bardzo niskie absorbancje dadzą nam wystarczająco dokładne odczyty. Absorbancja 0,86 odpowiada 1,7 mg substancji X. Objętość wynosiła 500 µl (0,5 ml), więc otrzymujemy stężenie 3,4 mg/ml. Brzmi dobrze. Sprawdzając drugą czytelną probówkę, absorbancja 0,12 wskazuje, że zawierała ona 0,20 mg substancji X. Objętość wynosiła 50 µl (0,050 ml). Stężenie powinno wynosić 0,20 mg/0,050 ml = 4,0 mg/ml. Którego wyniku użyjemy, czy weźmiemy średnią?
Zauważyłem, że użycie jednego odczytu absorbancji, który wypada najbliżej środka czułego zakresu, daje najdokładniejsze wyniki. W powyższym przykładzie środek to asorbancja 0,5, co odpowiada 0,1 mg substancji. Skala absorbancji jest logarytmiczna, więc nawet na wyświetlaczu cyfrowym odczyty są bardziej wiarygodne w dolnej części skali. Jednakże przy bardzo niskich absorbancjach jeden lub więcej nieznanych czynników, takich jak uszkodzenie rurki do pobierania próbek lub kuwety, będzie miało większy wpływ na wartość absorbancji niż przy wyższych absorbancjach. W górnej części tego zakresu odczynnik barwny zbliża się do nasycenia, więc nie tylko rozdzielczość odczytów absorbancji jest mniejsza, ale odczynnik jest mniej wrażliwy na różnice w stężeniu białka.