Her er en beskrivelse af, hvordan man opstiller og udfører en kolorimetrisk analyse for at bestemme koncentrationen af et stof i opløsning.
Generel fremgangsmåde
Vi kan ikke lægge materiale under et mikroskop og tælle antallet af molekyler pr. volumenenhed på samme måde, som vi kan tælle antallet af celler pr. volumenenhed. Vi må finde noget, som vi kan måle, og som er proportionalt med koncentrationen af det stof, vi er interesseret i. Den måling, der oftest anvendes i assays, er lysabsorption. Beers lov fortæller os, at hvis et opløst stof absorberer lys af en bestemt bølgelængde, er absorbansen direkte proportional med koncentrationen af stoffet i opløsningen. Der anvendes et apparat kaldet et spektrofotometer til at måle og vise og/eller registrere absorbansen i kvantificerbare enheder. Ofte absorberer stoffet i sig selv ikke lys, så det er muligt at foretage en praktisk bestemmelse. Det kan være nødvendigt at anvende et eller flere reagenser for at frembringe farvede forbindelser i forhold til koncentrationen af den ukendte substans.
Måling af lysabsorptionen af en prøve siger os meget lidt, medmindre vi har en standard til sammenligning. Hvis prøve X f.eks. viser en absorbans på 0,5, hvad er så den faktiske koncentration af X? Hvis vi har en prøve med en kendt koncentration, og denne prøve også giver en absorbans på 0,5, så er vi rimeligt sikre på, at stoffet har samme koncentration. Lad os antage, at du har en række prøver, og at deres koncentrationer varierer. Det ville være nyttigt at have et antal standarder, der dækker hele spektret af sandsynlige koncentrationer af vores ukendte. Det er her, en standardkurve kommer ind i billedet. Vi forbereder en række standarder med en kendt koncentration af X, der spænder fra lav til høj koncentration. Vi udfører analysen og plotter absorbansen mod koncentrationen for hver standard. Ved hjælp af denne standardkurve kan vi aflæse koncentrationen for en ukendt ud fra dens absorbansaflæsning.
Kontrol
Når vi udfører et assay, skal vi sikre, at kun det stof, vi analyserer, er ansvarlig for absorbansen af lys i det bølgelængdeområde, der er af interesse. Alle betingelser, under hvilke standarder og ukendte stoffer fremstilles, bør holdes identiske. Hvis opløsningsstoffer i prøvebufferne påvirker absorbansen, har vi et problem. Vi opnår ikke nøjagtige resultater, hvis vi varierer de mængder, hvori vi forbereder og analyserer standarder og ukendte stoffer. Tidspunktet for aflæsning af absorbansen, den temperatur, ved hvilken vi opbevarer materialerne, og alle andre fysiske faktorer bør være de samme. Da det ikke altid er praktisk muligt at anvende identiske buffere til alle ukendte stoffer og standarder, skal vi blot sikre, at ingen af bestanddelene i nogen af bufferne har en væsentlig indvirkning på absorbansen.
Når vi bruger det samme volumen til alle standarder og ukendte stoffer, forenkler vi analysen betragteligt. Standardkurven kan plotte absorbansen i forhold til stofmængden i stedet for koncentrationen. Det kan være mindre forvirrende at arbejde med mængder, mens man udfører en analyse, især hvis der er behov for fortyndinger. Så længe man kender den oprindelige mængde af den prøve, der blev anvendt i en analyse, er det let at bestemme koncentrationen.
Komplikation
Alle assays har grænser. Mængder af stof under et vist minimum vil være ikke kunne påvises. Over en vis maksimal mængde eller koncentration bliver et assay mættet, dvs. at stigninger i mængde eller koncentration ikke påvirker absorbansen. Vi forsøger generelt at arbejde inden for det lineære område af et assay, dvs. hvor absorbansen er direkte proportional med koncentrationen. Ideelt set bør vi opstille standarder, der omfatter hele det nyttige område for et assay. Det vil sige, at vi optimerer assayets område.
Ofte er en prøve så koncentreret, at når man analyserer den foreskrevne mængde prøve, er resultatet ikke på skalaen – analysereagenset er mættet. Løsningen er i så fald at fortynde prøven. Hvis f.eks. volumenet af hver standard eller prøve er 1 ml, og 1 ml af din ukendte giver et resultat, der er uden for skalaen, kan du f.eks. tilsætte 0,1 ml prøve til et reagensglas sammen med 0,9 ml buffer. Hvis du aflæser en koncentration fra standardkurven, skal du gange resultatet med 10 for at få den faktiske koncentration i prøven. Hvis du aflæser en mængde fra standardkurven, skal du blot dividere denne mængde med 0,1 ml for at få din koncentration.
Når prøverne er så koncentrerede, at du ikke kan pipettere en tilstrækkelig lille mængde nøjagtigt, kan du blive nødt til at foretage serielle fortyndinger.
Eksempel: Fremstilling af en standardkurve
Vi opstiller et hypotetisk assay til måling af stof X. Når X blandes med assayreagens dannes der et kompleks, som absorberer lys ved bølgelængde 400 nm. Vores spektrofotometer kræver, at vi hælder 2 ml volumen i hver kuvette. En kuvette er en gennemsigtig beholder, der skal placeres i en lysvej til måling af absorbansen. For at få det rette forhold mellem analysereagens og prøve, gør vi vores prøvevolumen til 0,5 ml og tilsætter 1,5 ml farvereagens til hvert reagensglas. Ved at opstille på denne måde kan assayet påvise mængder af X på så lidt som 10 mikrogram (µg) til så meget som 2 milligram (mg).
Reference
For at kalibrere spektrofotometeret har vi brug for et referencerør, der på alle måder er identisk med standarderne og prøverne, bortset fra at det ikke indeholder noget stof X. Når lysvejen er blokeret, vil spektrofotometeret blive indstillet til at aflæse uendelig absorbans (ingen transmission af lys overhovedet). Med referencerøret i lysvejen indstilles spektrofotometeret til at aflæse nul absorbans. På denne måde vil en prøve, der indeholder X, give en absorbans inden for dette område. Referencerøret bruges til at give os det maksimale dynamiske område.
For dette hypotetiske eksempel vil referencen indeholde 0,5 ml prøvebuffer og 1,5 ml farvereagens.
Standarder
Dette eksempel beskriver en hypotetisk analyse udelukkende til illustrationsformål.
Vi ønsker den bedste nøjagtighed, vi kan få, og vores interval spænder over to størrelsesordener, så en måde at opstille standardkurven på er med en logaritmisk progression af standarder. Vi har brug for standarder fra 0,01 mg til 2 mg. Lad os prøve mængder på 0,01, 0,02, 0,05, 0,1, 0,2, 0,5, 1 og 2 mg. Det sidste hul er ret stort, så lad os tilføje en standard på f.eks. 1,5 mg. Til fremstilling af standarder er det praktisk at starte med en koncentreret stamopløsning af stoffet. Den største mængde, vi har brug for, er 2 mg, i et volumen på 0,5 ml. Lad os for at give os lidt “spillerum” lave en stamopløsning på 5 mg/ml af stof X. I følgende tabel er beregningerne vist.
Tabel 1. Eksempel på, hvordan man planlægger en standardkurve. Koncentrationen af protein i stamopløsningen var 5 mg/ml. Dette eksempel tjener kun til illustration.
| mængde af stof X (mg) | volumen af stamopløsning (µl) | volumen af buffer (µl) |
|
0 (reference) |
0 | 500 |
| 0.01 | 2 | 498* |
| 0.02 | 4 | 496* |
| 0.05 | 490 | |
| 0.1 | 20 | 480 |
| 0.2 | 40 | 460 |
| 0.5 | 100 | 400 |
| 1 | 200 | 300 |
| 1.5 | 300 | 200 |
| 2 | 400 | 100 |
*Det er almindeligt at bruge pipettere, der giver os volumener, der ikke er nøjagtige med mere end 2 betydende cifre.
Volumenet af buffer er ikke så kritisk som volumenet af stamopløsning. Fejl i pipetteringen af bufferen påvirker det samlede volumen og dermed farvereagens koncentration. Fejl på under 1 % vil ikke have nogen væsentlig indvirkning på resultaterne. Faktisk vil vi, hvis mængden af farvereagens langt overstiger mængden af prøve (ikke i dette tilfælde), ikke engang have behov for at udligne mængderne ved at tilsætte buffer.
Nogle laboratorier er ikke udstyret med pipettere, der går under 5 µl med nøjagtighed. Det kan være nødvendigt at foretage en seriel fortynding for at få f.eks. 2 eller 4 µl stamopløsning i et reagensglas.
Prøveforberedelse
Det hjælper at have et rimeligt skøn over de koncentrationsintervaller af prøven, som man kan forvente. Selv med et sådant skøn er det godt at forberede prøver med en række fortyndinger, i tilfælde af at en prøve er så koncentreret, at dens absorbansaflæsninger er uden for intervallet.
For assayet i eksemplet, hvis vi bruger 500 µl prøve i et assayrør (det maksimale volumen), skal dens koncentration være mindre end 4 mg/ml for at give en læsbar absorbans. På den anden side ville vi ønske så meget, hvis prøven var, lad os sige, ti gange mindre koncentreret. Da vi ikke ved noget om koncentrationen af en bestemt prøve, ville vi fylde et rør med 500 µl for at dække dette område. Da analysen dækker et bredt koncentrationsområde, kan vi bruge 50 µl i et andet reagensglas. Nu kan prøven være så koncentreret som 40 mg/ml, og der vil stadig være 4 mg eller mindre i reagensglasset, hvilket giver et læsbart resultat. For at dække alle baser kan vi analysere et tredje reagensglas med kun 5 µl prøve.
Kør assayet
Når alle standard- og ukendte stoffer er klar, har vi:
- 1 referencerør
- et vist antal standarder, der dækker hele analyseområdet
- to eller tre analyserør pr. prøve, der repræsenterer en række fortyndinger
Det er tid til at udføre proceduren for farveudvikling, som kan være så enkel som at tilsætte et farvereagens og lade prøverne sidde i et par minutter. Når det er praktisk muligt, bør behandlingen af hver standard og prøve tidsbestemmes, således at absorbansen aflæses efter det samme tidsinterval for hvert rør. Instrumentet skal kalibreres, hvorefter absorbanserne måles for hvert enkelt rør i rækkefølge. En standardkurve fås ved at plotte absorbansen mod mængden af stof X. Hvis forholdet er klart lineært, er det slet ikke nødvendigt med en standardkurve. Mængderne kan bestemmes ved hjælp af interpolation. Der bør konstrueres en kurve første gang, et assay anvendes, for at kontrollere nøjagtighed og linearitet.
Eksempel på en standardkurve
Her er, hvordan plottet kan se ud i en laboratoriehæfte (eleven har tydeligvis en fremragende håndskrift). Forholdet er ikke perfekt lineært, men viser snarere et typisk udslukningsmønster.
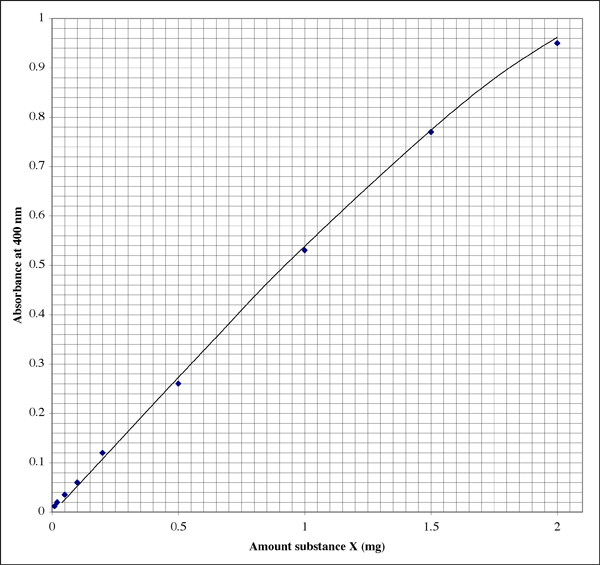
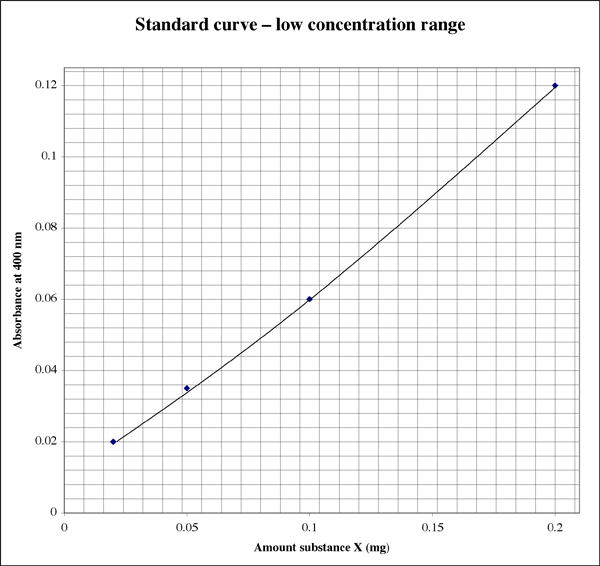
Da intervallet er så bredt, vil en elev for prøver, der giver meget lave absorbansaflæsninger, måske ønske et andet plot med højere opløsning.
Bestem koncentrationen af en prøve
En koncentration er en mængde af noget pr. volumenenhed. Vi rapporterer typisk proteinkoncentrationer i milligram pr. milliliter(mg/ml), selv om det nogle gange er praktisk at bruge mikrogram/mikroliter (µg/µl) eller måske endda µg/ml (for meget små koncentrationer). For en ukendt stofmængde dividerer vi mængden af stof (fra standardkurven) med mængden af den prøve, der er anvendt i analysen. Bemærk, at dette volumen ikke er analysemængden, og at det heller ikke er den fortyndede prøvevolumen. Divideres med mængden af den ufortyndede prøve, som du har anbragt i assayrøret.
Lad os antage, at du har forberedt tre assayrør til prøve nr. 1, som indeholder henholdsvis 500 µl, 50 µl og 5 µl prøve. Antag, at de gav absorbansaflæsninger på henholdsvis 0,86, 0,12 og 0,01. Den sidste absorbans er naturligvis ikke på skalaen. Interceptet bør være nul, men vi kan ikke regne med, at meget lave absorbanser giver os tilstrækkeligt nøjagtige aflæsninger.\
En absorbans på 0,86 svarer til 1,7 mg stof X. Volumenet var 500 µl (0,5 ml), så vi får en koncentration på 3,4 mg/ml. Det lyder godt. Ved kontrol af det andet læsbare rør viser en absorbans på 0,12, at røret indeholdt 0,20 mg stof X. Volumenet var 50 µl (0,050 ml). Koncentrationen skulle være 0,20 mg/0,050 ml = 4,0 mg/ml. Hvilket resultat skal vi bruge, eller skal vi tage et gennemsnit?
Jeg har fundet ud af, at det giver de mest nøjagtige resultater at bruge den ene absorbansaflæsning, der ligger tættest på midten af det følsomme område. I eksemplet ovenfor er midten en asorbans på 0,5, hvilket svarer til 0,1 mg stof. Absorbansskalaen er logaritmisk, så selv fra et digitalt display er aflæsningerne mere pålidelige i den lave ende af skalaen. Ved meget lave absorbanser vil en eller flere ukendte faktorer, som f.eks. en defekt i prøverøret eller kuvetten, imidlertid have en mere dybtgående virkning på absorbansværdien end ved højere absorbanser. I den øvre ende af området nærmer farvereagenset sig mætning, således at man ikke blot har mindre opløsning mellem absorbansaflæsningerne, men at reagenset også er mindre følsomt over for forskelle i proteinkoncentrationen.