Hier wird beschrieben, wie man einen kolorimetrischen Test einrichtet und durchführt, um die Konzentration einer Substanz in Lösung zu bestimmen.
Allgemeiner Ansatz
Wir können kein Material unter ein Mikroskop legen und die Anzahl der Moleküle pro Volumeneinheit zählen, so wie wir die Anzahl der Zellen pro Volumeneinheit zählen können. Wir müssen etwas finden, das wir messen können und das proportional zur Konzentration der interessierenden Substanz ist. Das am häufigsten verwendete Maß ist die Absorption von Licht. Das Beersche Gesetz besagt, dass die Absorption eines gelösten Stoffes, der Licht einer bestimmten Wellenlänge absorbiert, direkt proportional zur Konzentration des Stoffes in der Lösung ist. Zur Messung und Anzeige bzw. Aufzeichnung der Absorption in quantifizierbaren Einheiten wird ein so genanntes Spektrophotometer verwendet. Häufig absorbiert die Substanz selbst kein Licht, so dass ein praktischer Test nicht möglich ist. Möglicherweise müssen wir ein oder mehrere Reagenzien verwenden, um farbige Verbindungen im Verhältnis zur Konzentration der unbekannten Substanz zu erzeugen.
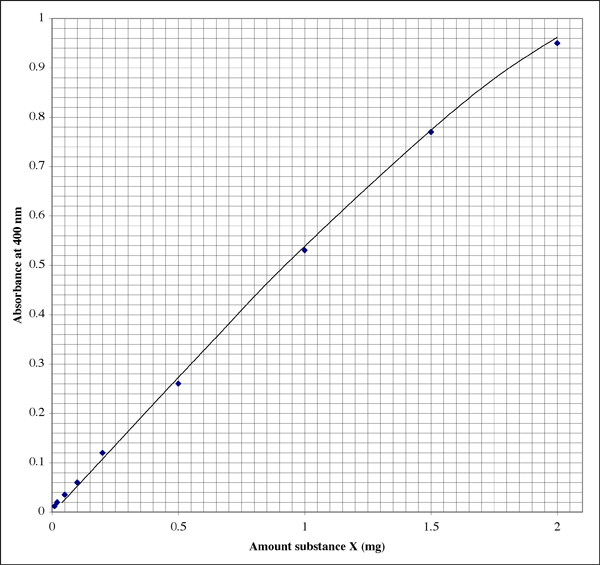
Die Messung der Lichtabsorption einer Probe sagt sehr wenig aus, es sei denn, wir haben einen Standard zum Vergleich. Wenn zum Beispiel die Probe X eine Absorption von 0,5 aufweist, wie hoch ist dann die tatsächliche Konzentration von X? Wenn wir eine Probe mit bekannter Konzentration haben und diese Probe ebenfalls eine Absorption von 0,5 zeigt, dann sind wir ziemlich sicher, dass die Substanz dieselbe Konzentration hat. Nehmen wir an, Sie haben eine Reihe von Proben, deren Konzentrationen unterschiedlich sind. Es wäre nützlich, eine Reihe von Standards zu haben, die den gesamten Bereich der wahrscheinlichen Konzentrationen unserer unbekannten Substanz abdecken. An dieser Stelle kommt eine Standardkurve ins Spiel. Wir bereiten eine Reihe von Standards mit bekannter Konzentration von X vor, die von niedriger bis hoher Konzentration reichen. Wir führen den Test durch und tragen für jeden Standard die Absorption gegen die Konzentration auf. Anhand dieser Standardkurve können wir die Konzentration einer unbekannten Substanz anhand ihres Absorptionswertes ablesen.
Kontrollen
Wenn wir einen Test durchführen, müssen wir sicherstellen, dass nur die Substanz, die wir testen, für die Absorption von Licht im interessierenden Wellenlängenbereich verantwortlich ist. Alle Bedingungen, unter denen Standards und unbekannte Proben hergestellt werden, sollten identisch sein. Wenn gelöste Stoffe in den Probenpuffern die Absorption beeinflussen, dann haben wir ein Problem. Wir werden keine genauen Ergebnisse erhalten, wenn wir die Volumina variieren, in denen wir Standards und Unbekannte vorbereiten und testen. Der Zeitpunkt der Absorptionsmessung, die Temperatur, bei der die Materialien aufbewahrt werden, und alle anderen physikalischen Faktoren sollten gleich bleiben. Da es nicht immer praktisch ist, identische Puffer für alle Unbekannten und Standards zu verwenden, müssen wir nur sicherstellen, dass keine der Komponenten eines der Puffer einen signifikanten Einfluss auf die Absorption hat.
Wenn wir für alle Standards und Unbekannten das gleiche Volumen verwenden, vereinfachen wir die Analyse erheblich. Die Standardkurve kann die Absorption gegen die Substanzmenge anstelle der Konzentration auftragen. Es kann weniger verwirrend sein, während eines Tests mit Mengen zu arbeiten, insbesondere wenn Verdünnungen erforderlich sind. Solange man das ursprüngliche Volumen der Probe kennt, die in einem Assay verwendet wurde, ist die Bestimmung der Konzentration einfach.
Komplikation
Alle Assays haben Grenzwerte. Substanzmengen, die unter einem bestimmten Minimum liegen, sind nicht nachweisbar. Ab einer bestimmten Höchstmenge oder -konzentration ist ein Assay gesättigt, d. h. eine Erhöhung der Menge oder Konzentration hat keinen Einfluss auf die Absorption. Im Allgemeinen versuchen wir, innerhalb des linearen Bereichs eines Assays zu arbeiten, d. h. dort, wo die Absorption direkt proportional zur Konzentration ist. Idealerweise würden wir Standards erstellen, die den gesamten nützlichen Bereich eines Assays abdecken. Das heißt, wir optimieren den Bereich des Assays.
Oft ist eine Probe so konzentriert, dass bei der Bestimmung des vorgeschriebenen Probenvolumens das Ergebnis außerhalb der Skala liegt – das Bestimmungsreagenz ist gesättigt. Die Lösung besteht dann darin, die Probe zu verdünnen. Wenn zum Beispiel das Volumen jedes Standards oder jeder Probe 1 ml beträgt und 1 ml der unbekannten Probe ein Ergebnis liefert, das außerhalb der Skala liegt, können Sie 0,1 ml Probe zusammen mit 0,9 ml Puffer in ein Reagenzglas geben. Wenn Sie eine Konzentration aus der Standardkurve ablesen, dann multiplizieren Sie das Ergebnis mit 10, um die tatsächliche Konzentration in der Probe zu erhalten. Wenn Sie eine Menge aus der Standardkurve ablesen, dividieren Sie diese Menge einfach durch 0,1 ml, um Ihre Konzentration zu erhalten.
Wenn die Proben so konzentriert sind, dass Sie keine ausreichend kleine Menge genau pipettieren können, müssen Sie möglicherweise Serienverdünnungen durchführen.
Beispiel: Erstellung einer Standardkurve
Wir stellen einen hypothetischen Test auf, um die Substanz X zu messen. Wenn X mit dem Testreagenz gemischt wird, bildet sich ein Komplex, der Licht bei einer Wellenlänge von 400 nm absorbiert. Unser Spektralphotometer erfordert, dass wir 2 ml Volumen in jede Küvette geben. Eine Küvette ist ein durchsichtiges Gefäß, das in den Lichtweg gestellt wird, um die Absorption zu messen. Um das richtige Verhältnis von Testreagenz und Probe zu erhalten, geben wir 0,5 ml Probe und 1,5 ml Farbreagenz in jedes Röhrchen. Auf diese Weise kann der Test Mengen von X von 10 Mikrogramm (µg) bis zu 2 Milligramm (mg) nachweisen.
Referenz
Zur Kalibrierung des Spektralphotometers benötigen wir ein Referenzröhrchen, das in jeder Hinsicht mit den Standards und Proben identisch ist, außer dass es keine Substanz X enthält. Wenn der Lichtweg blockiert ist, wird das Spektralphotometer so eingestellt, dass es eine unendliche Absorption anzeigt (keinerlei Lichtdurchlässigkeit). Mit dem Referenzröhrchen im Lichtweg wird das Spektralphotometer so eingestellt, dass es null Absorption anzeigt. Auf diese Weise wird eine Probe, die X enthält, eine Absorption innerhalb dieses Bereichs aufweisen. Das Referenzröhrchen wird verwendet, um den maximalen dynamischen Bereich zu erhalten.
Für dieses hypothetische Beispiel enthält das Referenzröhrchen 0,5 ml Probenpuffer und 1,5 ml Farbreagenz.
Standards
Dieses Beispiel beschreibt einen hypothetischen Assay, der nur der Veranschaulichung dient.
Wir wollen die bestmögliche Genauigkeit erreichen, und unser Bereich erstreckt sich über zwei Größenordnungen, daher ist eine Möglichkeit, die Standardkurve mit einer logarithmischen Abfolge von Standards zu erstellen. Wir brauchen Standards von 0,01 mg bis 2 mg. Versuchen wir es mit Mengen von 0,01, 0,02, 0,05, 0,1, 0,2, 0,5, 1 und 2 mg. Die letzte Lücke ist ziemlich groß, also nehmen wir einen Standard von, sagen wir, 1,5 mg. Zur Herstellung von Standards ist es sinnvoll, mit einer konzentrierten Stammlösung der Substanz zu beginnen. Die größte Menge, die wir benötigen, ist 2 mg in einem Volumen von 0,5 ml. Um ein wenig Spielraum zu haben, stellen wir eine Stammlösung von 5 mg/ml der Substanz X her.
Tabelle 1. Beispiel für die Erstellung einer Standardkurve. Die Konzentration des Proteins in der Stammlösung beträgt 5 mg/ml. Dieses Beispiel dient nur zur Veranschaulichung.
| Menge der Substanz X (mg) | Volumen der Stammlösung (µl) | Volumen des Puffers (µl) |
|
0 (Referenz) |
0 | 500 |
| 0.01 | 2 | 498* |
| 0.02 | 4 | 496* |
| 0.05 | 490 | |
| 0.1 | 20 | 480 |
| 0.2 | 40 | 460 |
| 0.5 | 100 | 400 |
| 1 | 200 | 300 |
| 1.5 | 300 | 200 |
| 2 | 400 | 100 |
*Es ist üblich, Pipetten zu verwenden, die uns Volumina liefern, die auf nicht mehr als 2 signifikante Zahlen genau sind.
Das Volumen des Puffers ist nicht so kritisch wie das Volumen der Stammlösung. Fehler beim Pipettieren des Puffers wirken sich auf das Gesamtvolumen und damit auf die Konzentration des Farbreagenzes aus. Fehler von weniger als 1 % haben keinen signifikanten Einfluss auf die Ergebnisse. Wenn das Volumen des Farbreagenzes das Volumen der Probe bei weitem übersteigt (was in diesem Fall nicht der Fall ist), brauchen wir die Volumina nicht einmal durch Zugabe von Puffer auszugleichen.
Einige Labors sind nicht mit Pipetten ausgestattet, die mit Genauigkeit unter 5 µl gehen. Es kann notwendig sein, eine serielle Verdünnung durchzuführen, um z.B. 2 oder 4 µl Stammlösung in ein Teströhrchen zu bekommen.
Probenvorbereitung
Es ist hilfreich, eine vernünftige Schätzung der zu erwartenden Konzentrationsbereiche der Probe zu haben. Selbst mit einer solchen Schätzung ist es gut, Proben mit einer Reihe von Verdünnungen vorzubereiten, für den Fall, dass eine Probe so konzentriert ist, dass ihre Absorptionsmesswerte außerhalb des Bereichs liegen.
Wenn wir für den Test im Beispiel 500 µl Probe in einem Teströhrchen verwenden (das maximale Volumen), müsste die Konzentration weniger als 4 mg/ml betragen, um eine ablesbare Extinktion zu erhalten. Andererseits würden wir so viel brauchen, wenn die Probe beispielsweise zehnmal weniger konzentriert wäre. Da wir nichts über die Konzentration einer bestimmten Probe wissen, würden wir ein Röhrchen mit 500 µl füllen, um diesen Bereich abzudecken. Da der Assay einen großen Konzentrationsbereich abdeckt, können wir 50 µl in einem zweiten Assay-Röhrchen verwenden. Jetzt kann die Probe bis zu 40 mg/ml konzentriert sein, und wir werden immer noch 4 mg oder weniger im Teströhrchen haben, was ein ablesbares Ergebnis ergibt. Um alle Grundlagen abzudecken, können wir ein drittes Röhrchen mit nur 5 µl Probe testen.
Den Test durchführen
Wenn alle Standardlösungen und unbekannten Proben fertig sind, haben wir:
- ein Referenzröhrchen
- eine gewisse Anzahl von Standards, die den gesamten Bereich des Assays abdecken
- zwei oder drei Assayröhrchen pro Probe, die eine Reihe von Verdünnungen darstellen
Es ist Zeit, das Verfahren für die Farbentwicklung durchzuführen, das so einfach sein kann wie die Zugabe eines Farbreagens und das Stehenlassen der Proben für ein paar Minuten. Wenn möglich, sollte die Behandlung jedes Standards und jeder Probe zeitlich so abgestimmt werden, dass die Absorption für jedes Röhrchen nach demselben Zeitintervall abgelesen wird. Das Gerät sollte kalibriert werden, dann sollten die Extinktionen für jedes Röhrchen der Reihe nach gemessen werden. Eine Standardkurve erhält man durch Auftragen der Absorption gegen die Menge der Substanz X. Wenn die Beziehung eindeutig linear ist, ist eine Standardkurve gar nicht erforderlich. Die Mengen können durch Interpolation bestimmt werden. Bei der ersten Verwendung eines Tests sollte eine Kurve erstellt werden, um die Genauigkeit und Linearität zu überprüfen.
Beispiel einer Standardkurve
So könnte die Kurve in einem Labornotizbuch aussehen (der Schüler hat offensichtlich eine ausgezeichnete Handschrift). Die Beziehung ist nicht vollkommen linear, sondern zeigt ein typisches Auslöschungsmuster.
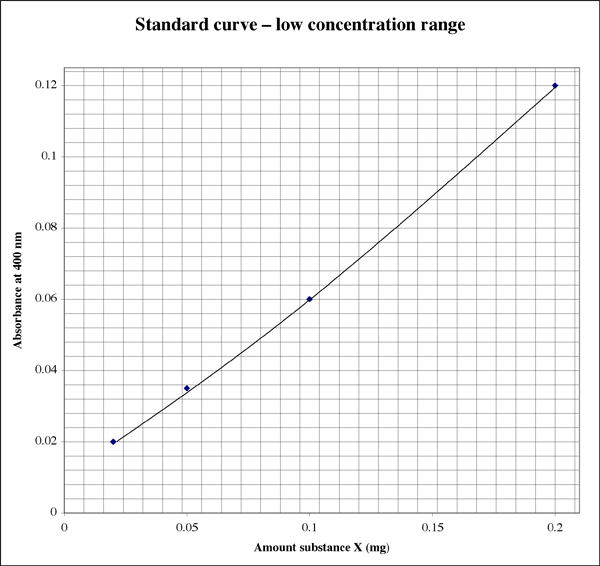
Da der Bereich so groß ist, könnte ein Schüler bei Proben mit sehr niedrigen Absorptionswerten eine zweite, höher aufgelöste Darstellung wünschen.
Bestimme die Konzentration einer Probe
Eine Konzentration ist eine Menge von etwas pro Volumeneinheit. Üblicherweise werden Proteinkonzentrationen in Milligramm pro Milliliter (mg/ml) angegeben, obwohl es manchmal praktisch ist, Mikrogramm/Mikroliter (µg/µl) oder vielleicht sogar µg/ml (für sehr kleine Konzentrationen) zu verwenden. Für eine unbekannte Substanz wird die Substanzmenge (aus der Standardkurve) durch das Volumen der im Assay verwendeten Probe geteilt. Beachten Sie, dass es sich bei diesem Volumen weder um das Assayvolumen noch um das Volumen der verdünnten Probe handelt. Teilen Sie es durch das Volumen der unverdünnten Probe, die Sie in das Teströhrchen gegeben haben.
Angenommen, Sie haben drei Teströhrchen für Probe Nr. 1 vorbereitet, die jeweils 500 µl, 50 µl und 5 µl Probe enthalten. Nehmen wir an, dass sie Absorptionswerte von 0,86, 0,12 bzw. 0,01 ergeben. Die letzte Extinktion liegt natürlich außerhalb der Skala. Der Achsenabschnitt sollte Null sein, aber wir können uns nicht darauf verlassen, dass sehr niedrige Absorptionswerte ausreichend genaue Messwerte liefern.\
Ein Absorptionswert von 0,86 entspricht 1,7 mg Substanz X. Das Volumen betrug 500 µl (0,5 ml), also erhalten wir eine Konzentration von 3,4 mg/ml. Das klingt gut. Bei der Überprüfung des anderen ablesbaren Röhrchens zeigt die Absorption von 0,12 an, dass das Röhrchen 0,20 mg Substanz X enthielt. Das Volumen betrug 50 µl (0,050 ml). Die Konzentration sollte 0,20 mg/0,050 ml = 4,0 mg/ml betragen. Welches Ergebnis verwenden wir, oder nehmen wir einen Durchschnittswert?
Ich habe festgestellt, dass die Verwendung des einen Absorptionsmesswerts, der am nächsten an der Mitte des empfindlichen Bereichs liegt, die genauesten Ergebnisse liefert. Im obigen Beispiel liegt die Mitte bei einer Absorption von 0,5, was 0,1 mg der Substanz entspricht. Die Absorptionsskala ist logarithmisch, so dass auch bei einer digitalen Anzeige die Messwerte am unteren Ende der Skala zuverlässiger sind. Bei sehr niedrigen Absorptionswerten haben jedoch ein oder mehrere unbekannte Faktoren, wie z. B. ein Defekt im Probenröhrchen oder in der Küvette, einen stärkeren Einfluss auf den Absorptionswert als bei höheren Absorptionswerten. Am oberen Ende des Bereichs nähert sich das Farbreagenz der Sättigung, so dass nicht nur die Auflösung zwischen den Absorptionsmesswerten geringer ist, sondern das Reagenz auch weniger empfindlich auf Unterschiede in der Proteinkonzentration reagiert.