Tässä on kuvaus siitä, miten asetetaan ja suoritetaan kolorimetrinen määritys liuoksessa olevan aineen konsentraation määrittämiseksi.
Yleinen lähestymistapa
Me emme voi laittaa materiaalia mikroskoopin alle ja laskea molekyylien lukumäärää tilavuusyksikköä kohti samalla tavalla kuin voimme laskea solujen lukumäärää tilavuusyksikköä kohti. Meidän on löydettävä jotain, jota voimme mitata ja joka on verrannollinen kiinnostavan aineen pitoisuuteen. Määrityksissä yleisimmin käytetty mittaustapa on valon absorbanssi. Beerin laki kertoo, että jos liuennut aine absorboi valoa tietyllä aallonpituudella, absorbanssi on suoraan verrannollinen aineen pitoisuuteen liuoksessa. Spektrofotometriksi kutsuttua laitetta käytetään absorbanssin mittaamiseen ja näyttämiseen ja/tai tallentamiseen määrällisinä yksikköinä. Usein aine itsessään ei absorboi valoa niin, että se voitaisiin määrittää käytännössä. Saatamme joutua käyttämään yhtä tai useampaa reagenssia värillisten yhdisteiden tuottamiseksi suhteessa tuntemattoman aineen pitoisuuteen.
Valon absorption mittaaminen näytteestä kertoo hyvin vähän, ellei meillä ole vertailustandardia. Jos esimerkiksi näyte X osoittaa absorbanssia 0,5, mikä on X:n todellinen pitoisuus? Jos meillä on näyte, jonka konsentraatio tunnetaan, ja tämä näyte antaa myös absorbanssin 0,5, olemme kohtuullisen varmoja, että aineen konsentraatio on sama. Oletetaan, että sinulla on useita näytteitä, joiden pitoisuudet vaihtelevat. Olisi hyödyllistä, että meillä olisi useita standardeja, jotka kattavat tuntemattoman näytteemme koko todennäköisen pitoisuusalueen. Tässä kohtaa standardikäyrä tulee kuvaan mukaan. Valmistetaan sarja standardeja, joiden pitoisuudet ovat tunnettuja ja jotka vaihtelevat alhaisesta korkeaan pitoisuuteen. Suoritamme määrityksen ja kuvaamme kunkin standardin absorbanssin ja konsentraation suhteen. Käyttämällä tätä standardikäyrää voimme lukea tuntemattoman konsentraation sen absorbanssilukeman perusteella.
Kontrollit
Kun suoritamme määrityksen, meidän on varmistettava, että vain määrittelemämme aine vastaa valon absorboitumisesta kiinnostavalla aallonpituusalueella. Kaikki olosuhteet, joissa standardit ja tuntemattomat valmistetaan, on pidettävä samanlaisina. Jos näytepuskureissa olevat liuokset vaikuttavat absorbanssiin, meillä on ongelma. Emme saa tarkkoja tuloksia, jos vaihtelemme tilavuuksia, joissa valmistamme ja määrittelemme standardit ja tuntemattomat. Absorbanssin lukemisen ajoitus, lämpötila, jossa säilytämme materiaaleja, ja kaikki muut fysikaaliset tekijät on pidettävä samoina. Koska ei ole aina käytännöllistä käyttää samanlaisia puskureita kaikille tuntemattomille aineille ja standardeille, meidän on vain varmistettava, ettei minkään puskurin mikään komponentti vaikuta merkittävästi absorbanssiin.
Kun käytämme samaa tilavuutta kaikille standardeille ja tuntemattomille, yksinkertaistamme analyysia huomattavasti. Standardikäyrässä voidaan konsentraation sijasta esittää absorbanssi aineen määrän suhteen. Määritystä tehtäessä voi olla vähemmän hämmentävää työskennellä määrien kanssa, varsinkin jos tarvitaan laimennoksia. Kunhan tiedät määrityksessä käytetyn näytteen alkuperäisen tilavuuden, konsentraation määrittäminen on helppoa.
Komplikaatio
Kaikilla määrityksillä on rajat. Jonkin vähimmäismäärän alittavat ainemäärät ovat havaitsematta. Jonkin enimmäismäärän tai -konsentraation ylittyessä määritys kyllästyy, eli määrän tai konsentraation lisäys ei vaikuta absorbanssiin. Pyrimme yleensä työskentelemään määrityksen lineaarisella alueella, jossa absorbanssi on suoraan verrannollinen pitoisuuteen. Ihannetapauksessa asetamme standardit, jotka kattavat koko määrityksen käyttökelpoisen alueen. Toisin sanoen optimoimme määritysalueen.
Usein näyte on niin konsentroitunut, että kun määrität määrätyn näytemäärän, tulos on asteikon ulkopuolella – määritysreagenssi on kyllästynyt. Ratkaisu on silloin laimentaa näyte. Jos esimerkiksi kunkin standardin tai näytteen tilavuus on 1 ml ja 1 ml tuntematonta antaa tuloksen, joka on asteikon ulkopuolella, voit lisätä koeputkeen 0,1 ml näytettä ja 0,9 ml puskuria. Jos luet konsentraation standardikäyrästä, kerro tulos 10:llä saadaksesi näytteen todellisen konsentraation. Jos luet määrän standardikäyrästä, jaa tämä määrä yksinkertaisesti 0,1 ml:lla saadaksesi konsentraatiosi.
Jos näytteet ovat niin konsentroituneita, ettet voi pipetoida riittävän pientä määrää tarkasti, joudut ehkä tekemään sarjalaimennuksia.
Esimerkki: vakiokäyrän laatiminen
Valmistetaan hypoteettinen määritys aineen X mittaamiseksi. Kun X sekoitetaan määritysreagenssiin, muodostuu kompleksi, joka absorboi valoa aallonpituudella 400 nm. Spektrofotometrimme edellyttää, että laitamme 2 ml tilavuutta kuhunkin kyvettiin. Kyvetti on läpinäkyvä astia, joka asetetaan valopolkuun absorbanssin mittaamista varten. Jotta saamme oikean suhteen määritysreagenssin ja näytteen välille, teemme näytetilavuudeksi 0,5 ml ja lisäämme 1,5 ml värireagenssia jokaiseen putkeen. Näin aseteltuna määritys voi havaita X:n määrän niinkin pienestä kuin 10 mikrogrammasta (µg) jopa 2 milligrammaan (mg).
Vertailu
Spektrofotometrin kalibroimiseksi tarvitsemme vertailuputken, joka on kaikilta osin identtinen standardien ja näytteiden kanssa, paitsi että se ei sisällä ainetta X. Kun valopolku on tukossa, spektrofotometri asetetaan lukemaan ääretöntä absorbanssia (valon läpäisyä ei tapahdu lainkaan). Kun vertailuputki on valopolussa, spektrofotometri asetetaan lukemaan nolla absorbanssia. Näin X:ää sisältävä näyte antaa absorbanssin kyseisellä alueella. Referenssiputkea käytetään antamaan meille suurin mahdollinen dynaaminen alue.
Tässä hypoteettisessa esimerkissä referenssi sisältää 0,5 ml näytepuskuria ja 1,5 ml värireagenssia.
Standardit
Tämä esimerkki kuvaa hypoteettista määritystä vain havainnollistamistarkoituksessa.
Haluamme parhaan mahdollisen tarkkuuden, ja alueemme ulottuu kahteen suuruusluokkaan, joten yksi tapa laatia standardikäyrä on standardien logaritminen eteneminen. Tarvitsemme standardeja 0,01 mg:sta 2 mg:aan. Kokeillaan määriä 0,01, 0,02, 0,05, 0,1, 0,2, 0,5, 1 ja 2 mg. Viimeinen aukko on melko suuri, joten otetaan mukaan yksi standardi, joka on vaikkapa 1,5 mg. Standardien valmistaminen on kätevää aloittaa aineen väkevästä kantaliuoksesta. Suurin tarvitsemamme määrä on 2 mg, jonka tilavuus on 0,5 ml. Jotta meillä olisi hieman liikkumavaraa, valmistetaan kantaliuos, jossa on 5 mg/ml ainetta X. Seuraavassa taulukossa esitetään laskelmat.
Taulukko 1. Esimerkki standardikäyrän suunnittelusta. Varastoliuoksen proteiinipitoisuus oli 5 mg/ml. Tämä esimerkki on vain havainnollistamistarkoituksessa.
| Aineen X määrä (mg) | Kantaliuoksen tilavuus (µl) | Puskurin tilavuus (µl) |
|
0 (referenssi) |
0 | 500 |
| 0.01 | 2 | 498* |
| 0.02 | 4 | 496* |
| 0.05 | 490 | |
| 0.1 | 20 | 480 |
| 0.2 | 40 | 460 |
| 0.5 | 100 | 400 |
| 1 | 200 | 300 |
| 1.5 | 300 | 200 |
| 2 | 400 | 100 |
*Yleisesti käytetään pipettejä, jotka antavat tilavuudet, jotka ovat tarkkoja enintään kahden merkitsevän numeron tarkkuudella.
Puskurin tilavuus ei ole yhtä kriittinen kuin kantaliuoksen tilavuus. Puskurin pipetointivirheet vaikuttavat kokonaistilavuuteen ja siten värireagenssin konsentraatioon. Alle 1 %:n virheillä ei ole merkittävää vaikutusta tuloksiin. Itse asiassa, jos värireagenssin tilavuus ylittää huomattavasti näytteen tilavuuden (ei tässä tapauksessa), tilavuuksia ei tarvitse edes tasata lisäämällä puskuria.
Joissakin laboratorioissa ei ole pipettejä, jotka menevät alle 5 µl:n tarkkuudella. Saattaa olla tarpeen tehdä sarjalaimennus, jotta saadaan vaikkapa 2 tai 4 µl kantaliuosta määritysputkeen.
Näytteen valmistelu
On hyödyllistä saada kohtuullinen arvio odotettavissa olevien näytteiden pitoisuusalueista. Tällaisestakin arviosta huolimatta on hyvä valmistaa näytteitä, joissa on erilaisia laimennoksia, siltä varalta, että näyte on niin konsentroitunut, että sen absorbanssilukemat ovat vaihteluvälin ulkopuolella.
Esimerkin määrityksessä, jos käytämme 500 µl näytettä määritysputkessa (maksimitilavuus), sen konsentraation pitäisi olla alle 4 mg/ml, jotta absorbanssi olisi luettavissa. Toisaalta haluaisimme yhtä paljon, jos näyte olisi vaikkapa kymmenen kertaa vähemmän konsentroitunut. Koska emme tiedä mitään tietyn näytteen konsentraatiosta, täytämme yhden putken 500 µl:lla kattaaksemme tämän alueen. Koska määritys kattaa laajan konsentraatioalueen, voimme käyttää 50 µl toisessa määritysputkessa. Nyt näyte voi olla jopa 40 mg/ml:n konsentraatioinen, ja määritysputkessa on edelleen 4 mg tai vähemmän, jolloin tulos on luettavissa. Kattaaksemme kaikki perusteet voimme tehdä määrityksen kolmannessa putkessa, jossa on vain 5 µl näytettä.
Toteuta määritys
Kun kaikki standardit ja tuntemattomat ovat valmiina, meillä on:
- 1 vertailuputki
- jokin määrä standardeja, jotka kattavat koko määritysalueen
- kaksi tai kolme määritysputkea näytettä kohti, jotka edustavat laimennossarjaa
On aika suorittaa värinkehitysmenetelmä, joka voi olla niinkin yksinkertaista kuin värireagenssin lisääminen ja näytteiden asettaminen muutamaksi minuutiksi. Jos se on käytännöllistä, kunkin standardin ja näytteen käsittely on ajoitettava siten, että absorbanssi luetaan samassa ajassa kunkin putken osalta. Laite on kalibroitava, minkä jälkeen absorbanssit on otettava jokaisesta putkesta järjestyksessä. Standardikäyrä saadaan piirtämällä absorbanssi aineen X määrän suhteen. Jos suhde on selvästi lineaarinen, standardikäyrää ei edes tarvita. Määrät voidaan määrittää interpoloinnin avulla. Käyrä tulisi laatia, kun määritystä käytetään ensimmäistä kertaa, jotta tarkkuus ja lineaarisuus voidaan tarkistaa.
Esimerkki standardikäyrästä
Tältä kaavio voisi näyttää laboratoriossa olevassa vihkossa (opiskelijalla on ilmeisesti erinomainen käsiala). Suhde ei ole täysin lineaarinen, vaan siinä näkyy pikemminkin tyypillinen sammumismalli.
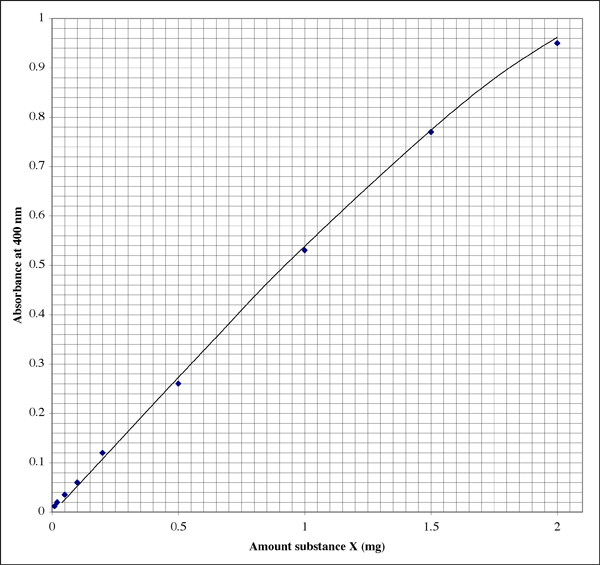
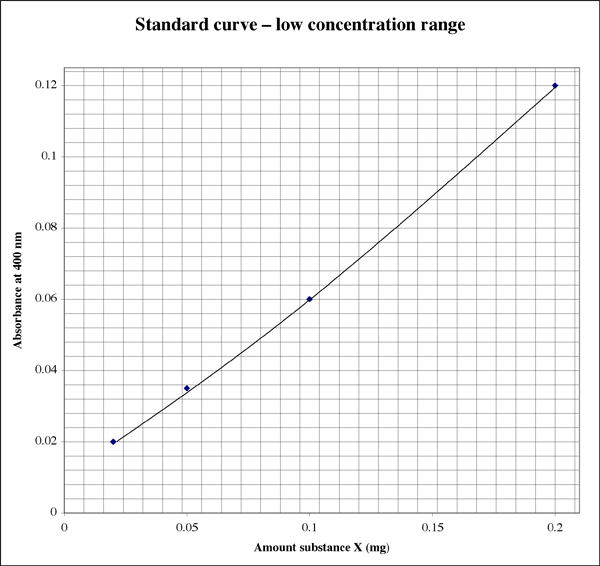
Koska alue on niin laaja, hyvin alhaisia absorbanssilukemia antaville näytteille opiskelija saattaa haluta toisen korkeamman resoluution kuvaajan.
Näytteen konsentraation määrittäminen
Konsentraatio on jonkin asian määrä tilavuusyksikköä kohti. Ilmoitamme yleensä proteiinipitoisuudet milligrammoina millilitraa kohti (mg/ml), vaikka joskus on kätevää käyttää mikrogrammoja/mikrolitra (µg/µl) tai ehkä jopa µg/ml (hyvin pienille pitoisuuksille). Tuntemattoman aineen osalta jaetaan aineen määrä (standardikäyrästä) määrityksessä käytetyn näytteen tilavuudella. Huomaa, että tämä tilavuus ei ole määritystilavuus eikä laimennetun näytteen tilavuus. Jaa määritysputkeen laitetun laimentamattoman näytteen tilavuudella.
Oletetaan, että valmistit näytteelle #1 kolme määritysputkea, jotka sisälsivät 500 µl, 50 µl ja 5 µl näytettä. Oletetaan, että ne antoivat absorbanssilukemat 0,86, 0,12 ja 0,01. Viimeinen absorbanssi on tietysti asteikon ulkopuolella. Poikkileikkauksen pitäisi olla nolla, mutta emme voi luottaa siihen, että hyvin pienet absorbanssit antavat riittävän tarkat lukemat.\
Absorbanssi 0,86 vastaa 1,7 mg ainetta X. Tilavuus oli 500 µl (0,5 ml), joten konsentraatioksi saadaan 3,4 mg/ml. Kuulostaa hyvältä. Kun tarkastetaan toinen luettava putki, absorbanssi 0,12 osoittaa, että putki sisälsi 0,20 mg ainetta X. Tilavuus oli 50 µl (0,050 ml). Pitoisuuden pitäisi olla 0,20 mg/0,050 ml = 4,0 mg/ml. Kumpaa tulosta käytämme vai otammeko keskiarvon?
Olen havainnut, että käyttämällä yhtä absorbanssilukemaa, joka on lähimpänä herkkyysalueen keskikohtaa, saadaan tarkimmat tulokset. Yllä olevassa esimerkissä keskellä on asorbanssi 0,5, joka vastaa 0,1 mg ainetta. Absorbanssiasteikko on logaritminen, joten digitaalisenkin näytön lukemat ovat luotettavampia asteikon alapäässä. Hyvin alhaisilla absorbansseilla yhdellä tai useammalla tuntemattomalla tekijällä, kuten näyteputken tai kyvetin vialla, on kuitenkin suurempi vaikutus absorbanssiarvoon kuin korkeammilla absorbansseilla. Asteikon yläpäässä värireagenssi lähestyy kyllästymistä, joten absorbanssimittausten erottelukyky heikkenee ja reagenssi on vähemmän herkkä proteiinipitoisuuseroille.