Ecco una descrizione di come si imposta ed esegue un test colorimetrico per determinare la concentrazione di una sostanza che è in soluzione.
Approccio generale
Non possiamo mettere il materiale sotto un microscopio e contare il numero di molecole per unità di volume come possiamo contare il numero di cellule per unità di volume. Dobbiamo trovare qualcosa che possiamo misurare che sia proporzionale alla concentrazione della sostanza di interesse. La misura più comunemente usata nei saggi è l’assorbanza della luce. La legge di Beer ci dice che se un soluto assorbe la luce di una particolare lunghezza d’onda, l’assorbanza è direttamente proporzionale alla concentrazione della sostanza in soluzione. Un dispositivo chiamato spettrofotometro viene utilizzato per misurare e visualizzare e/o registrare l’assorbanza in unità quantificabili. Spesso la sostanza da sola non assorbe la luce in modo da permettere un saggio pratico. Potremmo dover impiegare uno o più reagenti per produrre composti colorati in proporzione alla concentrazione dell’incognita.
Misurare l’assorbanza della luce da parte di un campione ci dice molto poco se non abbiamo uno standard di confronto. Per esempio, se il campione X mostra un’assorbanza di 0,5, qual è la concentrazione reale di X? Se abbiamo un campione di concentrazione nota, e anche questo campione dà un’assorbanza di 0,5, allora siamo ragionevolmente sicuri che la sostanza ha quella stessa concentrazione. Supponiamo di avere un certo numero di campioni e che le loro concentrazioni varino. Sarebbe utile avere una serie di standard che abbracciano l’intera gamma di probabili concentrazioni della nostra incognita. È qui che entra in gioco una curva standard. Prepariamo una serie di standard di concentrazione nota di X, che vanno dalla bassa all’alta concentrazione. Eseguiamo il test e tracciamo l’assorbanza rispetto alla concentrazione per ogni standard. Usando questa curva standard possiamo leggere la concentrazione di un’incognita data la sua lettura di assorbanza.
Controlli
Quando eseguiamo un’analisi dobbiamo assicurarci che solo la sostanza che stiamo analizzando sia responsabile dell’assorbanza della luce nella gamma di lunghezza d’onda di interesse. Tutte le condizioni in cui vengono preparati gli standard e le incognite dovrebbero essere mantenute identiche. Se i soluti nei tamponi del campione influenzano l’assorbanza, allora abbiamo un problema. Non otterremo risultati accurati se varieremo i volumi in cui prepariamo e dosiamo gli standard e le incognite. I tempi di lettura dell’assorbanza, la temperatura a cui teniamo i materiali e tutti gli altri fattori fisici dovrebbero essere mantenuti gli stessi. Poiché non è sempre pratico usare tamponi identici per tutte le incognite e gli standard, dobbiamo solo assicurarci che nessuno dei componenti di uno qualsiasi dei tamponi abbia un effetto significativo sull’assorbanza.
Quando usiamo lo stesso volume per tutti gli standard e le incognite, semplifichiamo notevolmente l’analisi. La curva standard può tracciare l’assorbanza rispetto alla quantità di sostanza invece che alla concentrazione. Può essere meno confuso lavorare con le quantità mentre si fa un’analisi, specialmente se sono richieste diluizioni. Finché si conosce il volume originale del campione che è stato usato in un’analisi, la determinazione della concentrazione è facile.
Complicazione
Tutti i saggi hanno dei limiti. Quantità di sostanza al di sotto di un minimo non saranno rilevabili. Oltre una certa quantità o concentrazione massima un saggio diventa saturo, cioè, gli aumenti di quantità o concentrazione non influenzano l’assorbanza. Generalmente cerchiamo di lavorare all’interno dell’intervallo lineare di un test, cioè dove l’assorbanza è direttamente proporzionale alla concentrazione. Idealmente, dovremmo impostare standard che comprendono l’intero intervallo utile di un’analisi. Cioè, ottimizziamo l’intervallo del test.
Spesso un campione è così concentrato che quando si analizza il volume prescritto di campione il risultato è fuori scala – il reagente del test è saturo. La soluzione allora è quella di diluire il campione. Per esempio, se il volume di ogni standard o campione è di 1 ml, e 1 ml della vostra incognita dà un risultato fuori scala, potete aggiungere 0,1 ml di campione in una provetta insieme a 0,9 ml di tampone. Se leggi una concentrazione dalla curva standard, moltiplica il risultato per 10 per ottenere la concentrazione effettiva nel campione. Se si legge una quantità dalla curva standard poi semplicemente dividere quella quantità per 0,1 ml per ottenere la vostra concentrazione.
Quando i campioni sono così concentrati che non è possibile pipettare una quantità abbastanza piccola con precisione, si può avere a condurre diluizioni seriali.
Esempio: preparare una curva standard
Impostiamo un ipotetico test per misurare la sostanza X. Quando X è mescolato con il reagente del test si forma un complesso che assorbe la luce alla lunghezza d’onda 400 nm. Il nostro spettrofotometro richiede di mettere 2 ml di volume in ogni cuvetta. Una cuvetta è un recipiente trasparente da porre in un percorso di luce per la misurazione dell’assorbanza. Per ottenere la giusta proporzione tra reagente e campione, facciamo il nostro volume di campione 0,5 ml e aggiungiamo 1,5 ml di reagente colorato in ogni provetta. Impostata in questo modo, l’analisi può rilevare quantità di X da un minimo di 10 microgrammi (µg) a un massimo di 2 milligrammi (mg).
Riferimento
Per calibrare lo spettrofotometro abbiamo bisogno di una provetta di riferimento che sia identica in tutto e per tutto agli standard e ai campioni, tranne che non contiene alcuna sostanza X. Con il percorso della luce bloccato lo spettrofotometro sarà impostato per leggere un’assorbanza infinita (nessuna trasmissione della luce). Con il tubo di riferimento nel percorso della luce, imposteremo lo spettrofotometro per leggere assorbanza zero. In questo modo, un campione contenente X darà un’assorbanza entro quella gamma. La provetta di riferimento è usata per darci la massima gamma dinamica.
Per questo esempio ipotetico il riferimento conterrà 0,5 ml di tampone campione e 1,5 ml di reagente colore.
Standard
Questo esempio descrive un saggio ipotetico a solo scopo illustrativo.
Vogliamo la migliore accuratezza che possiamo ottenere, e la nostra gamma si estende su due ordini di grandezza, quindi un modo per impostare la curva standard è con una progressione logaritmica di standard. Abbiamo bisogno di standard da 0,01 mg a 2 mg. Proviamo quantità di 0,01, 0,02, 0,05, 0,1, 0,2, 0,5, 1 e 2 mg. L’ultimo intervallo è piuttosto ampio, quindi buttiamo uno standard di, diciamo, 1,5 mg. Per preparare gli standard è conveniente iniziare con una soluzione concentrata della sostanza. La quantità maggiore di cui abbiamo bisogno è di 2 mg, in un volume di 0,5 ml. Solo per darci un po’ di “margine di manovra” facciamo una soluzione stock di 5 mg/ml della sostanza X. La tabella seguente presenta i calcoli.
Tabella 1. Esempio di come pianificare una curva standard. La concentrazione di proteine nella soluzione stock era di 5 mg/ml. Questo esempio è solo a scopo illustrativo.
| quantità della sostanza X (mg) | volume della soluzione madre (µl) | volume del tampone (µl) |
|
0 (riferimento) |
0 | 500 |
| 0.01 | 2 | 498* |
| 0.02 | 4 | 496* |
| 0.05 | 490 | |
| 0.1 | 20 | 480 |
| 0.2 | 40 | 460 |
| 0.5 | 100 | 400 |
| 1 | 200 | 300 |
| 1.5 | 300 | 200 |
| 2 | 400 | 100 |
*È comune usare pipettatori che ci danno volumi che sono accurati a non più di 2 cifre significative.
Il volume del tampone non è così critico come il volume della soluzione madre. Errori nel pipettaggio del tampone influenzano il volume totale e, quindi, la concentrazione del reagente di colore. Errori inferiori all’1% non avranno un effetto significativo sui risultati. Infatti, se il volume del reagente colorato supera di gran lunga il volume del campione (non in questo caso) non avremmo nemmeno bisogno di equalizzare i volumi aggiungendo del buffer.
Alcuni laboratori non sono dotati di pipettatori che vanno sotto i 5 µl con precisione. Potrebbe essere necessario condurre una diluizione seriale per ottenere, ad esempio, 2 o 4 µl di soluzione stock in una provetta di analisi.
Preparazione del campione
È utile avere una stima ragionevole delle gamme di concentrazioni di campione che ci si può aspettare. Anche con tale stima è bene preparare campioni con una gamma di diluizioni, nel caso in cui un campione sia così concentrato che le sue letture di assorbanza siano fuori portata.
Per il test dell’esempio, se usiamo 500 µl di campione in una provetta (il volume massimo), la sua concentrazione dovrebbe essere inferiore a 4 mg/ml per dare un’assorbanza leggibile. D’altra parte, ne vorremmo altrettanta se il campione fosse, diciamo, dieci volte meno concentrato. Non sapendo nulla della concentrazione di un particolare campione, caricheremmo una provetta con 500 µl per coprire quell’intervallo. Poiché il test si estende su un’ampia gamma di concentrazioni, possiamo usare 50 µl in una seconda provetta. Ora il campione può essere concentrato fino a 40 mg/ml e avremo ancora 4 mg o meno nella provetta del test, dando un risultato leggibile. Per coprire tutte le basi, possiamo analizzare una terza provetta con soli 5 µl di campione.
Esegui il test
Quando tutti gli standard e le incognite sono pronti avremo:
- 1 provetta di riferimento
- un certo numero di standard che coprono l’intera gamma del test
- due o tre provette per campione che rappresentano una serie di diluizioni
È il momento di condurre la procedura per lo sviluppo del colore, che può essere semplice come aggiungere un reagente di colore e lasciare i campioni per alcuni minuti. Quando è pratico, il trattamento di ogni standard e campione dovrebbe essere temporizzato in modo che l’assorbanza venga letta seguendo lo stesso intervallo di tempo per ogni provetta. Lo strumento dovrebbe essere calibrato, poi le assorbanze dovrebbero essere prese per ogni provetta in ordine. Una curva standard si ottiene tracciando l’assorbanza contro la quantità di sostanza X. Se la relazione è chiaramente lineare, una curva standard non è nemmeno necessaria. Le quantità possono essere determinate usando l’interpolazione. Una curva dovrebbe essere costruita la prima volta che si usa un test, per controllare l’accuratezza e la linearità.
Esempio di una curva standard
Ecco come potrebbe apparire il grafico in un quaderno di laboratorio (lo studente ha ovviamente una calligrafia eccellente). La relazione non è perfettamente lineare, piuttosto mostra un tipico modello di estinzione.
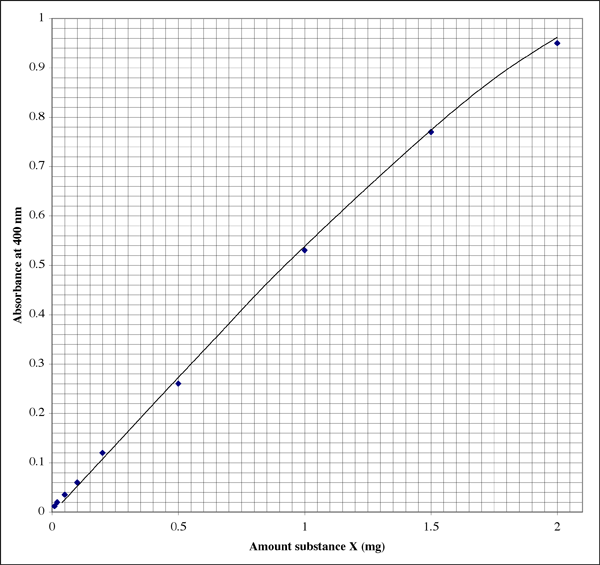
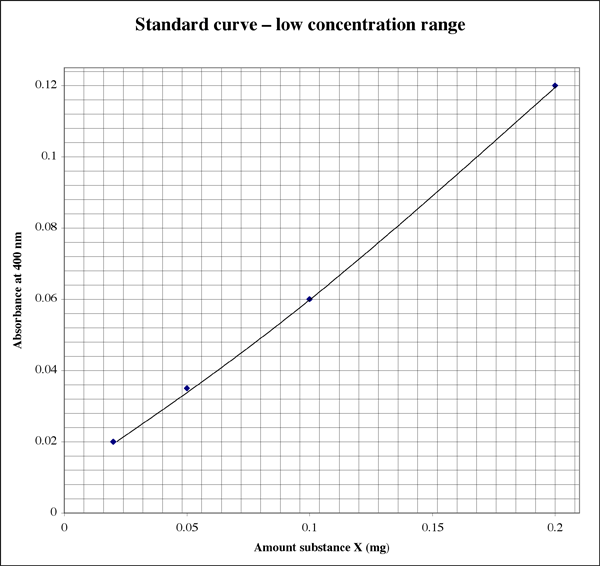
Siccome l’intervallo è così ampio, per i campioni che danno letture di assorbanza molto basse uno studente potrebbe volere un secondo grafico a più alta risoluzione.
Determinare la concentrazione di un campione
Una concentrazione è una quantità di qualcosa per unità di volume. Di solito riportiamo le concentrazioni di proteine in milligrammi per millilitro (mg/ml), anche se a volte è conveniente usare microgrammi/microlitro (µg/µl) o forse anche µg/ml (per concentrazioni molto piccole). Per un’incognita, dividiamo la quantità di sostanza (dalla curva standard) per il volume del campione usato nel test. Si noti che questo volume non è il volume del test, né il volume del campione diluito. Dividi per il volume del campione non diluito che hai messo nella provetta del test.
Supponiamo che tu abbia preparato tre provette per il campione #1, contenenti rispettivamente 500 µl, 50 µl e 5 µl di campione. Supponiamo che abbiano dato letture di assorbanza di 0,86, 0,12 e 0,01, rispettivamente. L’ultima assorbanza è fuori scala, ovviamente. L’intercetta dovrebbe essere zero, ma non possiamo contare su assorbimenti molto bassi che ci diano letture sufficientemente accurate.\
Un’assorbanza di 0,86 corrisponde a 1,7 mg di sostanza X. Il volume era di 500 µl (0,5 ml), quindi abbiamo una concentrazione di 3,4 mg/ml. Sembra buono. Controllando l’altra provetta leggibile, l’assorbanza di 0,12 indica che la provetta conteneva 0,20 mg di sostanza X. Il volume era di 50 µl (0,050 ml). La concentrazione dovrebbe essere 0,20 mg/0,050 ml = 4,0 mg/ml. Quale risultato usiamo o facciamo una media?
Ho trovato che usare la lettura dell’assorbanza che cade più vicina al centro dell’intervallo sensibile dà i risultati più accurati. Nell’esempio qui sopra il centro è un’assorbanza di 0,5, corrispondente a 0,1 mg di sostanza. La scala dell’assorbanza è logaritmica, quindi anche da un display digitale le letture sono più affidabili all’estremità bassa della scala. Tuttavia, alle assorbanze molto basse uno o più fattori sconosciuti, come un difetto nella provetta o nella cuvetta del campione, avrà un effetto più profondo sul valore dell’assorbanza rispetto alle assorbanze più alte. All’estremità superiore della gamma, il reagente di colore si avvicina alla saturazione, per cui non solo si ha meno risoluzione tra le letture di assorbanza, ma il reagente è meno sensibile alle differenze di concentrazione delle proteine.