Iată o descriere a modului în care se stabilește și se execută un test colorimetric pentru a determina concentrația unei substanțe care se află în soluție.
Abordare generală
Nu putem pune materialul sub un microscop și număra numărul de molecule pe unitatea de volum așa cum putem număra numărul de celule pe unitatea de volum. Trebuie să găsim ceva ce putem măsura și care este proporțional cu concentrația substanței de interes. Măsura cea mai frecvent utilizată în analize este absorbția luminii. Legea lui Beer ne spune că, dacă un solut absoarbe lumina cu o anumită lungime de undă, absorbția este direct proporțională cu concentrația substanței din soluție. Un dispozitiv numit spectrofotometru este utilizat pentru a măsura și afișa și/sau înregistra absorbanța în unități cuantificabile. Adesea, substanța în sine nu absoarbe lumina, astfel încât să permită o analiză practică. Este posibil să fim nevoiți să utilizăm unul sau mai mulți reactivi pentru a produce compuși colorați proporțional cu concentrația necunoscutei.
Măsurarea absorbanței luminii de către o probă ne spune foarte puțin dacă nu avem un etalon pentru comparație. De exemplu, dacă proba X prezintă o absorbanță de 0,5, care este concentrația reală a lui X? Dacă avem un eșantion cu o concentrație cunoscută, iar acel eșantion prezintă, de asemenea, o absorbanță de 0,5, atunci suntem rezonabil de siguri că substanța are aceeași concentrație. Să presupunem că aveți mai multe probe, iar concentrațiile acestora variază. Ar fi util să aveți un număr de etaloane care să acopere întreaga gamă de concentrații probabile ale necunoscutei noastre. Aici intervine o curbă standard. Pregătim o serie de etaloane de concentrație cunoscută a lui X, variind de la o concentrație mică la una mare. Executăm testul și reprezentăm absorbția în funcție de concentrație pentru fiecare standard. Folosind această curbă standard putem citi concentrația pentru o necunoscută, având în vedere citirea absorbanței acesteia.
Controale
Când efectuăm o analiză trebuie să ne asigurăm că numai substanța pe care o analizăm este responsabilă de absorbția luminii în domeniul lungimilor de undă de interes. Toate condițiile în care se prepară standardele și necunoscutele trebuie să fie păstrate identice. În cazul în care solvenții din tampoanele de probă afectează absorbția, atunci avem o problemă. Nu vom obține rezultate precise dacă vom varia volumele în care pregătim și analizăm standardele și necunoscutele. Momentul citirii absorbanței, temperatura la care păstrăm materialele și toți ceilalți factori fizici ar trebui să fie menținuți identici. Deoarece nu este întotdeauna practic să folosim tampoane identice pentru toate necunoscutele și standardele, trebuie doar să ne asigurăm că niciunul dintre componentele oricărui tampon nu are un efect semnificativ asupra absorbției.
Când folosim același volum pentru toți standardele și necunoscutele, simplificăm considerabil analiza. Curba standard poate reprezenta grafic absorbanța în funcție de cantitatea de substanță în loc de concentrație. Poate fi mai puțin confuz să lucrăm cu cantități în timp ce facem o analiză, mai ales dacă sunt necesare diluții. Atâta timp cât cunoașteți volumul original al probei care a fost utilizat într-o analiză, determinarea concentrației este ușoară.
Complicație
Toate analizele au limite. Cantitățile de substanță sub un anumit minim vor fi nedetectabile. Dincolo de o anumită cantitate sau concentrație maximă, un test devine saturat, adică creșterile de cantitate sau de concentrație nu afectează absorbția. În general, încercăm să lucrăm în intervalul liniar al unui test, adică în cazul în care absorbția este direct proporțională cu concentrația. În mod ideal, ar trebui să stabilim standarde care să cuprindă întregul interval util al unui test. Altfel spus, optimizăm domeniul de acțiune al analizei.
De multe ori o probă este atât de concentrată încât, atunci când analizați volumul prescris de probă, rezultatul este în afara scalei – reactivul de analiză este saturat. Soluția atunci este de a dilua proba. De exemplu, dacă volumul fiecărui etalon sau eșantion este de 1 ml, iar 1 ml din necunoscutul dvs. dă un rezultat care este în afara scalei, puteți adăuga 0,1 ml de eșantion într-o eprubetă împreună cu 0,9 ml de tampon. Dacă citiți o concentrație din curba standard, atunci înmulțiți rezultatul cu 10 pentru a obține concentrația reală din probă. Dacă citiți o cantitate din curba standard, atunci împărțiți pur și simplu acea cantitate la 0,1 ml pentru a obține concentrația dumneavoastră.
Când probele sunt atât de concentrate încât nu puteți pipeta o cantitate suficient de mică cu precizie, este posibil să trebuiască să efectuați diluții în serie.
Exemplu: Pregătirea unei curbe standard
Vom stabili un test ipotetic pentru a măsura substanța X. Când X este amestecat cu reactivul de testare se formează un complex care absoarbe lumina la lungimea de undă de 400 nm. Spectrofotometrul nostru ne cere să punem 2 ml de volum în fiecare cuvă. O cuvă este un recipient transparent care se plasează în calea luminii pentru măsurarea absorbanței. Pentru a obține o proporție corectă de reactiv de analiză în raport cu proba, facem ca volumul nostru de probă să fie de 0,5 ml și adăugăm 1,5 ml de reactiv de culoare în fiecare eprubetă. Setat în acest mod, testul poate detecta cantități de X de la 10 micrograme (µg) până la 2 miligrame (mg).
Referință
Pentru a calibra spectrofotometrul avem nevoie de un tub de referință care este identic din toate punctele de vedere cu standardele și probele, cu excepția faptului că nu conține nicio substanță X. Cu calea de lumină blocată, spectrofotometrul va fi setat să citească o absorbanță infinită (nicio transmisie a luminii). Cu tubul de referință în calea luminii, se va seta spectrofotometrul pentru a citi absorbția zero. În acest fel, o probă care conține X va da o absorbanță în acest interval. Tubul de referință este utilizat pentru a ne oferi intervalul dinamic maxim.
Pentru acest exemplu ipotetic, referința va conține 0,5 ml de tampon de probă și 1,5 ml de reactiv de culoare.
Standarde
Acest exemplu descrie un test ipotetic doar în scop ilustrativ.
Vrem cea mai bună acuratețe pe care o putem obține, iar intervalul nostru se întinde pe două ordine de mărime, așa că o modalitate de a configura curba standard este cu o progresie logaritmică a standardelor. Avem nevoie de standarde de la 0,01 mg la 2 mg. Să încercăm cantități de 0,01, 0,02, 0,05, 0,1, 0,2, 0,5, 1 și 2 mg. Ultimul decalaj este destul de mare, așa că haideți să aruncăm un standard de, să zicem, 1,5 mg. Pentru a pregăti standardele este convenabil să se înceapă cu o soluție stoc concentrată a substanței. Cea mai mare cantitate de care avem nevoie este de 2 mg, într-un volum de 0,5 ml. Doar pentru a ne oferi o mică „marjă de manevră”, să pregătim o soluție stoc de 5 mg/ml de substanță X. Tabelul următor prezintă calculele.
Tabelul 1. Exemplu de planificare a unei curbe standard. Concentrația de proteină din soluția stoc a fost de 5 mg/ml. Acest exemplu este doar în scop ilustrativ.
| cantitatea de substanță X (mg) | volumul de soluție stoc (µl) | volumul de soluție tampon (µl) |
|
0 (referință) |
0 | 500 |
| 0.01 | 2 | 498* |
| 0.02 | 4 | 496* |
| 0.05 | 490 | |
| 0.1 | 20 | 480 |
| 0.2 | 40 | 460 |
| 0.5 | 100 | 400 |
| 1 | 200 | 300 |
| 1.5 | 300 | 200 |
| 2 | 400 | 100 |
*Se obișnuiește să folosim pipete care ne dau volume cu o precizie de cel mult 2 cifre semnificative.
Volumul tamponului nu este la fel de critic ca și volumul soluției stoc. Erorile în pipetarea tamponului afectează volumul total și, astfel, concentrația reactivului de culoare. Erorile de mai puțin de 1% nu vor avea un efect semnificativ asupra rezultatelor. De fapt, dacă volumul reactivului de culoare depășește cu mult volumul probei (nu în acest caz), nici măcar nu va fi nevoie să egalizăm volumele prin adăugarea de tampon.
Câteva laboratoare nu sunt echipate cu pipete care să meargă sub 5 µl cu precizie. Poate fi necesar să se efectueze o diluție în serie pentru a obține, să zicem, 2 sau 4 µl de soluție stoc într-un tub de analiză.
Prepararea probei
Este util să aveți o estimare rezonabilă a intervalelor de concentrații ale probei la care vă puteți aștepta. Chiar și cu o astfel de estimare, este bine să se pregătească eșantioane cu o gamă de diluții, în cazul în care un eșantion este atât de concentrat încât valorile citite ale absorbanței sale sunt în afara intervalului.
Pentru testul din exemplu, dacă folosim 500 µl de probă într-un tub de analiză (volumul maxim), concentrația sa ar trebui să fie mai mică de 4 mg/ml pentru a da o absorbanță lizibilă. Pe de altă parte, am dori această cantitate dacă proba ar fi, să zicem, de zece ori mai puțin concentrată. Neștiind nimic despre concentrația unui anumit eșantion, am încărca un tub cu 500 µl pentru a acoperi acest interval. Deoarece testul acoperă o gamă largă de concentrații, putem folosi 50 µl într-un al doilea tub de analiză. Acum, proba poate avea o concentrație de până la 40 mg/ml și tot vom avea 4 mg sau mai puțin în tubul de analiză, oferind un rezultat lizibil. Pentru a acoperi toate bazele, putem analiza un al treilea tub cu doar 5 µl de probă.
Executați testul
Când toate etaloanele și necunoscutele sunt gata, vom avea:
- un tub de referință
- un număr oarecare de etaloane care acoperă toată gama de analiză
- două sau trei tuburi de analiză pentru fiecare probă reprezentând o serie de diluții
Este timpul să se efectueze procedura de dezvoltare a culorii, care poate fi la fel de simplă ca adăugarea unui reactiv de culoare și lăsarea probelor să stea câteva minute. Atunci când este practic, tratarea fiecărui etalon și eșantion ar trebui să fie cronometrată astfel încât absorbția să fie citită urmând același interval de timp pentru fiecare tub. Se calibrează instrumentul, apoi se iau absorbanțele pentru fiecare tub în ordine. O curbă standard se obține prin reprezentarea grafică a absorbanței în funcție de cantitatea de substanță X. În cazul în care relația este clar liniară, nici măcar nu este necesară o curbă standard. Cantitățile pot fi determinate prin interpolare. O curbă ar trebui să fie construită prima dată când se folosește un test, pentru a verifica precizia și liniaritatea.
Exemplu de curbă standard
Iată cum ar putea arăta graficul într-un caiet de laborator (studentul are, evident, un scris de mână excelent). Relația nu este perfect liniară, ci mai degrabă prezintă un model tipic de extincție.
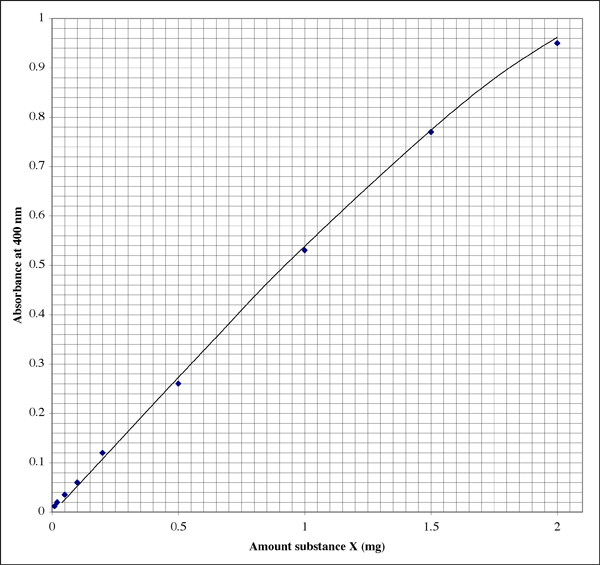
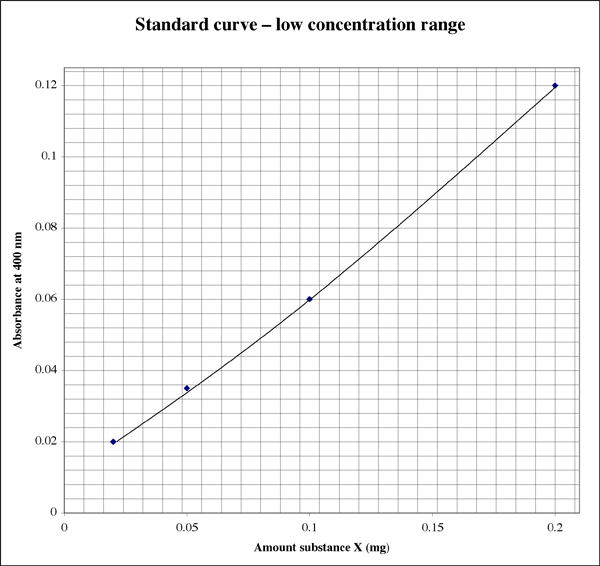
Din moment ce intervalul este atât de larg, pentru probele care dau citiri de absorbție foarte mici, un student ar putea dori un al doilea grafic de rezoluție mai mare.
Determinați concentrația unei probe
O concentrație este o cantitate de ceva pe unitatea de volum. De obicei, raportăm concentrațiile de proteine în miligrame pe mililitru(mg/ml), deși uneori este convenabil să folosim micrograme/microlitru (µg/µl) sau poate chiar µg/ml (pentru concentrații foarte mici). Pentru o necunoscută, împărțim cantitatea de substanță (din curba standard) la volumul de probă utilizat în analiză. Rețineți că acest volum nu este volumul de analiză și nici volumul probei diluate. Împărțiți la volumul de probă nediluată pe care l-ați introdus în tubul de analiză.
Să presupunem că ați pregătit trei tuburi de analiză pentru proba nr. 1, conținând 500 µl, 50 µl și, respectiv, 5 µl de probă. Să presupunem că acestea au dat citiri ale absorbanței de 0,86, 0,12 și, respectiv, 0,01. Ultima absorbție este, bineînțeles, în afara scalei. Intersecția ar trebui să fie zero, dar nu ne putem baza pe faptul că absorbanțele foarte mici ne oferă citiri suficient de precise.\
O absorbanță de 0,86 corespunde cu 1,7 mg de substanță X. Volumul a fost de 500 µl (0,5 ml), deci obținem o concentrație de 3,4 mg/ml. Sună bine. Verificând celălalt tub lizibil, absorbția de 0,12 indică faptul că tubul conținea 0,20 mg de substanță X. Volumul a fost de 50 µl (0,050 ml). Concentrația ar trebui să fie 0,20 mg/0,050 ml = 4,0 mg/ml. Care rezultat îl folosim sau luăm o medie?
Am constatat că utilizarea unei citiri a absorbanței care se încadrează cel mai aproape de mijlocul intervalului sensibil oferă cele mai precise rezultate. În exemplul de mai sus, centrul este o asorbanță de 0,5, care corespunde la 0,1 mg de substanță. Scara de absorbție este logaritmică, astfel încât, chiar și de pe un afișaj digital, citirile sunt mai fiabile la capătul inferior al scalei. Cu toate acestea, la absorbanțe foarte mici, unul sau mai mulți factori necunoscuți, cum ar fi un defect în tubul de probă sau în cuvă, vor avea un efect mai profund asupra valorii absorbanței decât la absorbanțe mai mari. La capătul superior al intervalului, reactivul de culoare se apropie de saturație, astfel încât nu numai că aveți o rezoluție mai mică între citirile de absorbție, dar reactivul este mai puțin sensibil la diferențele de concentrație a proteinelor.