Aqui está uma descrição de como se configura e executa um ensaio colorimétrico para determinar a concentração de uma substância que está em solução.
Aproximação geral
Não podemos colocar o material sob um microscópio e contar o número de moléculas por unidade de volume da forma que podemos contar o número de células por unidade de volume. Devemos encontrar algo que possamos medir que seja proporcional à concentração da substância de interesse. A medida mais comumente usada em ensaios é a absorvância da luz. A Lei da Cerveja nos diz que se um soluto absorve luz de um determinado comprimento de onda, a absorvância é diretamente proporcional à concentração da substância em solução. Um dispositivo chamado espectrofotômetro é usado para medir e exibir e/ou registrar a absorvância em unidades quantificáveis. Muitas vezes a substância por si só não absorve a luz, de modo a permitir um ensaio prático. Podemos ter que empregar um ou mais reagentes para produzir compostos coloridos em proporção à concentração do desconhecido.
A medição da absorção da luz por uma amostra diz-nos muito pouco, a menos que tenhamos um padrão para comparação. Por exemplo, se a amostra X mostra absorvância de 0,5, qual é a concentração real de X? Se tivermos uma amostra de concentração conhecida, e essa amostra também nos dá uma absorvância de 0,5, então estamos razoavelmente seguros de que a substância tem essa mesma concentração. Suponha que você tem um número de amostras, e suas concentrações variam. Seria útil ter uma série de padrões que abranjam toda a gama de concentrações prováveis do nosso desconhecido. É aí que entra uma curva padrão. Nós preparamos uma série de padrões de concentração conhecida de X, variando de baixa a alta concentração. Fazemos o ensaio e traçamos a absorção versus concentração para cada padrão. Usando esta curva padrão podemos ler a concentração para um desconhecido dada a sua leitura de absorvância.
Controlos
Quando executamos um ensaio devemos assegurar que apenas a substância que estamos a ensaiar é responsável pela absorvância da luz na faixa de comprimento de onda de interesse. Todas as condições sob as quais as normas e incógnitas são preparadas devem ser mantidas idênticas. Se os solutos nos amortecedores da amostra afectam a absorção, então temos um problema. Não obteremos resultados precisos se variarmos os volumes em que preparamos e ensaiamos padrões e incógnitas. O tempo de absorção de leitura, a temperatura em que mantemos os materiais e todos os outros fatores físicos devem ser mantidos iguais. Como nem sempre é prático utilizar tampões idênticos para todas as incógnitas e padrões, só precisamos garantir que nenhum dos componentes de qualquer um dos tampões tenha um efeito significativo na absorção.
Quando usamos o mesmo volume para todos os padrões e incógnitas, simplificamos consideravelmente a análise. A curva padrão pode traçar a absorvância versus quantidade de substância em vez da concentração. Pode ser menos confuso trabalhar com quantidades ao fazer um ensaio, especialmente se diluições forem necessárias. Desde que se saiba o volume original da amostra que foi usada em um ensaio, a determinação da concentração é fácil.
Complicação
Todos os ensaios têm limites. Quantidades de substância abaixo de algum mínimo serão indetectáveis. Para além de alguma quantidade ou concentração máxima um ensaio torna-se saturado, ou seja, aumentos na quantidade ou concentração não afectam a absorção. Geralmente tentamos trabalhar dentro da faixa linear de um ensaio, ou seja, onde a absorvância é diretamente proporcional à concentração. Idealmente, nós estabeleceríamos padrões que englobem toda a gama útil de um ensaio. Ou seja, otimizamos o alcance do ensaio.
Amaciar uma amostra é tão concentrada que quando se analisa o volume de amostra prescrito o resultado é fora da escala – o reagente do ensaio é saturado. A solução então é diluir a amostra. Por exemplo, se o volume de cada padrão ou amostra for de 1 ml e 1 ml do seu desconhecido der um resultado fora da escala, pode adicionar 0,1 ml de amostra a um tubo de ensaio juntamente com 0,9 ml de tampão. Se você ler uma concentração da curva padrão, então multiplique o resultado por 10 para obter a concentração real na amostra. Se você ler uma quantidade da curva padrão, basta dividir essa quantidade por 0,1 ml para obter sua concentração.
Quando as amostras estão tão concentradas que você não pode pipetar uma quantidade pequena o suficiente com precisão, você pode ter que conduzir diluições em série.
Exemplo: preparando uma curva padrão
Configuraremos um ensaio hipotético para medir a substância X. Quando X é misturado com o reagente do ensaio forma-se um complexo que absorve a luz no comprimento de onda 400 nm. Nosso espectrofotômetro requer que coloquemos 2 ml de volume em cada cubeta. Uma cubeta é um recipiente transparente a ser colocado num percurso de luz para a medição da absorvância. Para obter a proporção certa de reagente de ensaio para a amostra, fazemos o nosso volume de amostra 0,5 ml e adicionamos 1,5 ml de reagente de cor a cada tubo. Configurado desta forma o ensaio pode detectar quantidades de X de apenas 10 microgramas (µg) a até 2 miligramas (mg).
Referência
Para calibrar o espectrofotómetro precisamos de um tubo de referência que seja idêntico em todos os aspectos às normas e amostras, excepto que não contém qualquer substância X. Com o percurso de luz bloqueado o espectrofotómetro será ajustado para ler a absorvância infinita (sem qualquer transmitância de luz). Com o tubo de referência na trajectória da luz, ajustaremos o espectrofotómetro para ler a absorvância zero. Dessa forma, uma amostra contendo X dará a absorvância dentro desse intervalo. O tubo de referência é utilizado para nos dar o intervalo dinâmico máximo.
Para este exemplo hipotético a referência conterá 0,5 ml de tampão de amostra e 1,5 ml de reagente de cor.
Padrão
Este exemplo descreve um ensaio hipotético apenas para fins ilustrativos.
Queremos a melhor precisão que pudermos obter, e o nosso intervalo abrange duas ordens de magnitude, por isso uma forma de configurar a curva padrão é com uma progressão logarítmica dos padrões. Nós precisamos de padrões de 0,01 mg a 2 mg. Vamos tentar quantidades de 0,01, 0,02, 0,05, 0,1, 0,2, 0,5, 1, e 2 mg. A última lacuna é bastante grande, por isso, vamos colocar um padrão de, digamos, 1,5 mg. Para preparar padrões, é conveniente começar com uma solução de reserva concentrada da substância. A maior quantidade que precisamos é de 2 mg, em um volume de 0,5 ml. Só para nos dar um pouco de “espaço de manobra” vamos fazer uma solução de reserva de 5 mg/ml de substância X. A tabela seguinte apresenta os cálculos.
Tábua 1. Exemplo de como planejar uma curva padrão. A concentração de proteína na solução de reserva era de 5 mg/ml. Este exemplo é apenas para fins ilustrativos.
| quantidade de substância X (mg) | volume de solução de reserva (µl) | volume de tampão (µl) |
|
0 (referência) |
0 | 500 |
| 0.01 | 2 | 498* |
| 0.02 | 4 | 496* |
| 0.05 | 490 | |
| 0.1 | 20 | 480 |
| 0.2 | 40 | 460 |
| 0.5 | 100 | 400 |
| 1 | 200 | 300 |
| 1.5 | 300 | 200 |
| 2 | 400 | 100 |
*É comum o uso de pipetadores que nos dão volumes que não são precisos a mais de 2 figuras significativas.
O volume de tampão não é tão crítico como o volume de solução de reserva. Os erros no tampão de pipetagem afectam o volume total e, portanto, a concentração do reagente de cor. Erros inferiores a 1% não terão um efeito significativo nos resultados. De facto, se o volume do reagente de cor exceder de longe o volume da amostra (não neste caso) não precisaríamos sequer de equalizar os volumes adicionando o tampão.
alguns laboratórios não estão equipados com pipetadores que vão abaixo de 5 µl com precisão. Pode ser necessário realizar uma diluição em série para obter, digamos, 2 ou 4 µl de solução de reserva em um tubo de ensaio.
Preparação da amostra
A ajuda a ter uma estimativa razoável das gamas de concentrações de amostra que se pode esperar. Mesmo com tal estimativa é bom preparar amostras com um intervalo de diluições, no caso de uma amostra estar tão concentrada que as suas leituras de absorvância estejam fora do intervalo.
Para o ensaio do exemplo, se utilizarmos uma amostra de 500 µl num tubo de ensaio (o volume máximo), a sua concentração teria de ser inferior a 4 mg/ml para dar uma absorvância legível. Por outro lado, desejaríamos isso se a amostra fosse, digamos, dez vezes menos concentrada. Não sabendo nada sobre a concentração de uma determinada amostra, nós carregaríamos um tubo com 500 µl para cobrir essa faixa. Uma vez que o ensaio abrange uma ampla gama de concentrações, podemos usar 50 µl em um segundo tubo de ensaio. Agora a amostra pode ser tão concentrada quanto 40 mg/ml e ainda teremos 4 mg ou menos no tubo de ensaio, dando um resultado legível. Para cobrir todas as bases podemos ensaiar um terceiro tubo com apenas 5 µl de amostra.
Executar o ensaio
Quando todos os padrões e incógnitas estiverem prontos teremos:
- 1 tubo de referência
- algum número de padrões que abrangem toda a gama do ensaio
- dois ou três tubos de ensaio por amostra representando uma série de diluições
É altura de conduzir o procedimento para o desenvolvimento da cor, que pode ser tão simples como adicionar um reagente de cor e deixar as amostras assentarem durante alguns minutos. Quando prático, o tratamento de cada padrão e amostra deve ser cronometrado para que a absorvância seja lida seguindo o mesmo intervalo de tempo para cada tubo. O instrumento deve ser calibrado, depois devem ser tomadas absorvâncias para cada tubo em ordem. Uma curva padrão é obtida traçando a absorvância versus quantidade de substância X. Se a relação for claramente linear, uma curva padrão não é sequer necessária. As quantidades podem ser determinadas através de interpolação. Uma curva deve ser construída na primeira vez que um ensaio é usado, para verificar a precisão e linearidade.
Exemplo de uma curva padrão
Aqui está como o gráfico pode ser visto em um caderno de laboratório (o aluno obviamente tem uma excelente caligrafia). A relação não é perfeitamente linear, mas mostra um típico padrão de extinção.
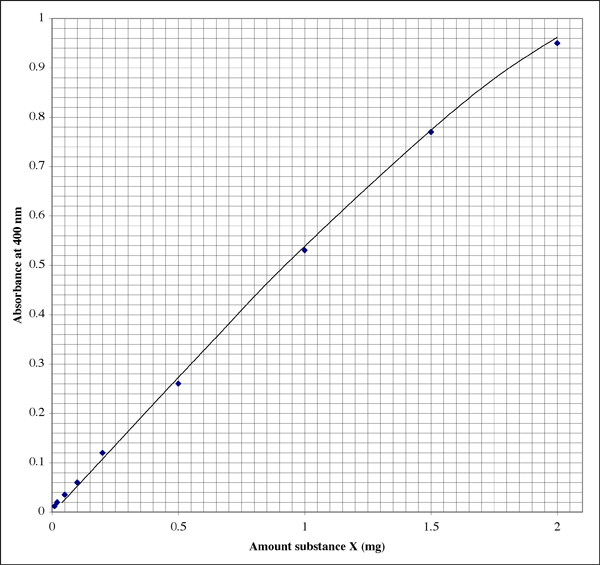
Posto que o intervalo é tão amplo, para amostras que dão leituras de absorvância muito baixa, um aluno pode querer um segundo gráfico de resolução mais alta.
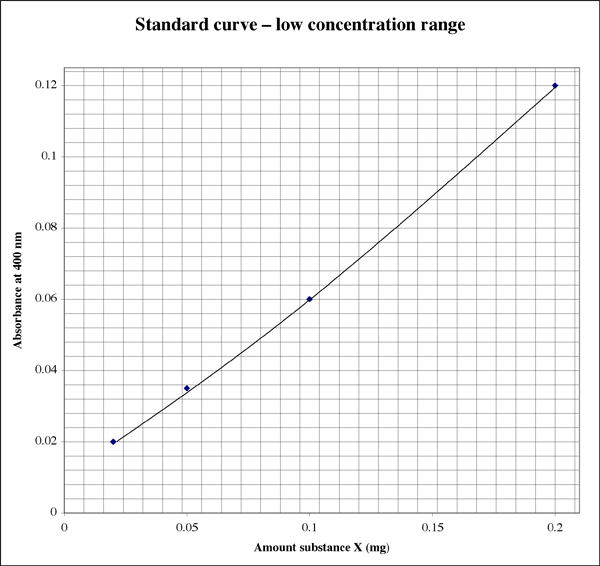
Determinar a concentração de uma amostra
Uma concentração é uma quantidade de algo por unidade de volume. Normalmente relatamos concentrações de proteínas em miligramas por mililitro (mg/ml), embora às vezes seja conveniente usar microgramas/microlitros (µg/µl) ou talvez até µg/ml (para concentrações muito pequenas). Para um desconhecido, dividimos a quantidade de substância (a partir da curva padrão) pelo volume de amostra utilizado no ensaio. Note que este volume não é o volume do ensaio, nem é o volume da amostra diluído. Divida pelo volume de amostra não diluída que você colocou no tubo do ensaio.
Deixe-nos supor que preparou três tubos de ensaio para a amostra #1, contendo 500 µl, 50 µl, e 5 µl de amostra, respectivamente. Suponha que eles deram leituras de absorção de 0,86, 0,12, e 0,01, respectivamente. A última absorvância está fora da escala, é claro. A interceptação deve ser zero, mas não podemos contar com absorvâncias muito baixas dando-nos leituras suficientemente precisas.\
Uma absorvância de 0,86 corresponde a 1,7 mg de substância X. O volume era de 500 µl (0,5 ml), por isso obtemos uma concentração de 3,4 mg/ml. Soa bem. Verificando o outro tubo legível, a absorvância de 0,12 indica que o tubo continha 0,20 mg de substância X. O volume era de 50 µl (0,050 ml). A concentração deve ser de 0,20 mg/0,050 ml = 4,0 mg/ml. Qual o resultado que usamos, ou tomamos uma média?
I’ve found that using the one absorbance reading that falls closest to the middle of the sensitive range gives the most accuracy results. No exemplo acima o centro é uma asorbância de 0,5, correspondente a 0,1 mg de substância. A escala de absorvância é logarítmica, de modo que mesmo a partir de um visor digital as leituras são mais confiáveis na extremidade baixa da escala. No entanto, em absorvâncias muito baixas um ou mais factores desconhecidos, como um defeito no tubo de amostra ou na cubeta, terão um efeito mais profundo no valor da absorvância do que em absorvâncias mais elevadas. Na extremidade superior do intervalo o reagente de cor aproxima-se da saturação, de modo que não só se tem menos resolução entre as leituras de absorvância, como o reagente é menos sensível a diferenças na concentração de proteínas.