Az alábbiakban leírjuk, hogyan állítunk be és futtatunk egy kolorimetriás vizsgálatot egy oldatban lévő anyag koncentrációjának meghatározására.
Általános megközelítés
Nem tudjuk az anyagot mikroszkóp alá helyezni és megszámolni a molekulák számát térfogategységenként, ahogyan a sejtek számát térfogategységenként meg tudjuk számolni. Találnunk kell valamit, amit meg tudunk mérni, ami arányos a vizsgált anyag koncentrációjával. A vizsgálatokban leggyakrabban használt mérés a fényelnyelés. A Beer-törvény azt mondja, hogy ha egy oldott anyag egy bizonyos hullámhosszúságú fényt elnyel, akkor az abszorbancia egyenesen arányos az oldatban lévő anyag koncentrációjával. Az abszorbancia mérésére és számszerűsíthető egységekben történő megjelenítésére és/vagy rögzítésére egy spektrofotométer nevű készüléket használnak. Gyakran előfordul, hogy az anyag önmagában nem nyeli el a fényt, ami lehetővé teszi a gyakorlati vizsgálatot. Előfordulhat, hogy egy vagy több reagenssel színezett vegyületeket kell előállítanunk az ismeretlen koncentrációjával arányosan.
A fény elnyelésének mérése egy minta által nagyon keveset mond el nekünk, hacsak nincs egy standardunk az összehasonlításhoz. Például, ha X minta 0,5 abszorbanciát mutat, mekkora az X tényleges koncentrációja? Ha van egy ismert koncentrációjú mintánk, és ez a minta szintén 0,5-es abszorbanciát ad, akkor eléggé biztosak lehetünk benne, hogy az anyagnak ugyanez a koncentrációja van. Tegyük fel, hogy több mintával rendelkezünk, és azok koncentrációja eltérő. Hasznos lenne, ha több olyan standarddal rendelkeznénk, amelyek az ismeretlenünk valószínű koncentrációjának teljes tartományát lefedik. Itt jön a képbe a standardgörbe. Elkészítjük az X ismert koncentrációjú standardok sorozatát, az alacsony koncentrációtól a magas koncentrációig. Lefuttatjuk a vizsgálatot, és az abszorbanciát a koncentráció függvényében ábrázoljuk minden egyes standard esetében. Ennek a standardgörbének a segítségével le tudjuk olvasni az ismeretlen koncentrációját az abszorbanciaértékének ismeretében.
Kontroll
A vizsgálat futtatásakor biztosítani kell, hogy csak az általunk vizsgált anyag legyen felelős a fény abszorbanciájáért a kívánt hullámhossz-tartományban. Minden olyan körülményt, amely mellett a standardokat és az ismeretleneket előállítjuk, azonosnak kell tartani. Ha a mintapufferekben lévő oldott anyagok befolyásolják az abszorbanciát, akkor problémánk van. Nem fogunk pontos eredményeket kapni, ha a standardok és ismeretlenek előállításának és vizsgálatának térfogatát variáljuk. Az abszorbancia leolvasásának időzítését, a hőmérsékletet, amelyen az anyagokat tartjuk, és minden más fizikai tényezőt azonosnak kell tartani. Mivel nem mindig praktikus, hogy minden ismeretlenhez és standardhoz azonos puffereket használjunk, csak arra kell ügyelnünk, hogy a pufferek egyik összetevője se legyen jelentős hatással az abszorbanciára.
Ha minden standardhoz és ismeretlenhez ugyanazt a térfogatot használjuk, jelentősen leegyszerűsítjük az analízist. A standardgörbe a koncentráció helyett az abszorbancia függvényében ábrázolhatja az anyag mennyiségét. Kevésbé lehet zavaró, ha mennyiségekkel dolgozunk a vizsgálat során, különösen, ha hígításokra van szükség. Amíg ismerjük a mintának a vizsgálathoz használt eredeti térfogatát, a koncentráció meghatározása egyszerű.
Komplikáció
Minden próbának vannak határértékei. Bizonyos minimum alatti anyagmennyiségek nem kimutathatóak. Bizonyos maximális mennyiség vagy koncentráció felett a vizsgálat telítetté válik, azaz a mennyiség vagy koncentráció növekedése nem befolyásolja az abszorbanciát. Általában igyekszünk a vizsgálat lineáris tartományán belül dolgozni, azaz ahol az abszorbancia egyenesen arányos a koncentrációval. Ideális esetben olyan standardokat állítunk fel, amelyek a vizsgálat teljes hasznos tartományát lefedik. Vagyis optimalizáljuk a vizsgálat tartományát.
Egy minta gyakran olyan koncentrált, hogy amikor az előírt mennyiségű mintát vizsgáljuk, az eredmény a skálán kívül esik – a vizsgálati reagens telítődik. A megoldás ilyenkor a minta hígítása. Például, ha minden standard vagy minta térfogata 1 ml, és az ismeretlenből 1 ml olyan eredményt ad, amely a skálán kívül esik, akkor 0,1 ml mintát adhat 0,9 ml pufferrel együtt egy kémcsőbe. Ha leolvas egy koncentrációt a standardgörbéről, akkor szorozza meg az eredményt 10-zel, hogy megkapja a minta tényleges koncentrációját. Ha egy mennyiséget olvas le a standardgörbéről, akkor egyszerűen ossza el ezt a mennyiséget 0,1 ml-rel, hogy megkapja a koncentrációt.
Ha a minták olyan koncentráltak, hogy nem tud elég kis mennyiséget pontosan pipettázni, előfordulhat, hogy sorozatos hígításokat kell végeznie.
Példa: standardgörbe készítése
Egy hipotetikus próbát állítunk fel X anyag mérésére. Amikor X-et próbareagenssel keverjük, egy komplex képződik, amely 400 nm hullámhosszon elnyeli a fényt. A spektrofotométerünk megköveteli, hogy minden küvettába 2 ml térfogatot tegyünk. A küvetta egy átlátszó edény, amelyet a fény útjába kell helyezni az abszorbancia méréséhez. Ahhoz, hogy a vizsgálati reagens és a minta megfelelő arányban legyen, a mintánk térfogatát 0,5 ml-re állítjuk be, és minden egyes kémcsőbe 1,5 ml színezőreagenst adunk. Ilyen módon beállítva a vizsgálat az X mennyiségét akár 10 mikrogrammtól (µg) 2 milligrammig (mg) is képes kimutatni.
Referencia
A spektrofotométer kalibrálásához szükségünk van egy referenciacsőre, amely minden tekintetben megegyezik a standardokkal és a mintákkal, kivéve, hogy nem tartalmaz X anyagot. A fényút elzárásával a spektrofotométert végtelen abszorbanciára állítjuk (egyáltalán nincs fényáteresztés). Ha a referenciacső a fényútban van, a spektrofotométert úgy állítjuk be, hogy nulla abszorbanciát jelezzen. Így az X-et tartalmazó minta abszorbanciája ezen a tartományon belül lesz. A referenciacsövet arra használjuk, hogy a maximális dinamikus tartományt kapjuk.
Ez a hipotetikus példa esetében a referencia 0,5 ml mintapuffert és 1,5 ml színreagenst fog tartalmazni.
Standardok
Ez a példa egy hipotetikus vizsgálatot ír le, csak illusztrációs céllal.
A lehető legnagyobb pontosságot szeretnénk elérni, és a tartományunk két nagyságrendet ölel fel, ezért a standardgörbe felállításának egyik módja a standardok logaritmikus progressziója. Standardokra van szükségünk 0,01 mg-tól 2 mg-ig. Próbáljuk ki a 0,01, 0,02, 0,05, 0,1, 0,2, 0,5, 1 és 2 mg-os mennyiségeket. Az utolsó rés meglehetősen nagy, ezért dobjunk be egy, mondjuk 1,5 mg-os standardot. A standardok elkészítéséhez célszerű az anyag koncentrált törzsoldatával kezdeni. A legnagyobb mennyiség, amire szükségünk van, 2 mg, 0,5 ml térfogatban. Csak hogy legyen egy kis “mozgásterünk”, készítsünk egy 5 mg/ml anyag X törzsoldatot. A következő táblázat a számításokat mutatja be.
1. táblázat. Példa a standardgörbe tervezésére. A törzsoldatban a fehérje koncentrációja 5 mg/ml volt. Ez a példa csak illusztrációs célokat szolgál.
| az X anyag mennyisége (mg) | a törzsoldat térfogata (µl) | a puffer térfogata (µl) |
|
0 (referencia) |
0 | 500 |
| 0.01 | 2 | 498* |
| 0.02 | 4 | 496* |
| 0.05 | 490 | |
| 0.1 | 20 | 480 |
| 0.2 | 40 | 460 |
| 0.5 | 100 | 400 |
| 1 | 200 | 300 |
| 1.5 | 300 | 200 |
| 2 | 400 | 100 |
*Szokásos olyan pipettákat használni, amelyek legfeljebb 2 jelentős számjegy pontosságú térfogatokat adnak meg.
A puffer térfogata nem olyan kritikus, mint a törzsoldat térfogata. A puffer pipettázásának hibái befolyásolják a teljes térfogatot és ezáltal a színreagens koncentrációját. Az 1%-nál kisebb hibáknak nincs jelentős hatása az eredményekre. Valójában, ha a színreagens térfogata jóval meghaladja a minta térfogatát (ebben az esetben nem), még a térfogatokat sem kell kiegyenlítenünk puffer hozzáadásával.
Egyes laboratóriumokban nincsenek olyan pipetták, amelyek 5 µl alá pontosan mennek. Lehet, hogy sorozatos hígítást kell végezni, hogy mondjuk 2 vagy 4 µl törzsoldat kerüljön egy vizsgálati csőbe.
Mintakészítés
Segít, ha van egy ésszerű becslés a várható mintakoncentrációk tartományairól. Még ilyen becsléssel is jó, ha a mintákat hígítási tartományban készítjük el, arra az esetre, ha egy minta annyira koncentrált, hogy az abszorbancia-mérése a tartományon kívül esik.
A példában szereplő vizsgálathoz, ha 500 µl mintát használunk egy vizsgálati csőben (a maximális térfogat), akkor annak koncentrációjának 4 mg/ml-nél kisebbnek kell lennie ahhoz, hogy leolvasható abszorbanciaértéket kapjunk. Másrészt ennyit szeretnénk, ha a minta mondjuk tízszer kisebb koncentrációjú lenne. Mivel semmit sem tudunk az adott minta koncentrációjáról, egy csőbe 500 µl-t töltenénk, hogy lefedjük ezt a tartományt. Mivel a vizsgálat széles koncentrációtartományt ölel fel, egy második kémcsőben 50 µl-t használhatunk. Most a minta lehet akár 40 mg/ml koncentrációjú is, és még mindig 4 mg vagy annál kevesebb lesz a kémcsőben, ami leolvasható eredményt ad. Hogy minden alapot lefedjünk, egy harmadik csövet is megvizsgálhatunk mindössze 5 µl mintával.
Futtassuk le az assay-t
Ha az összes standard és ismeretlen elkészült, akkor lesz:
- 1 referenciacső
- valamilyen számú standard, amely az assay teljes tartományát lefedi
- mintánként két vagy három assay-cső, amelyek hígítások sorozatát képviselik
Elérkezett az idő a színfejlődési eljárás elvégzésére, amely lehet olyan egyszerű, mint egy színreagens hozzáadása és néhány percig hagyni a mintákat állni. Ha praktikus, az egyes standardok és minták kezelését úgy kell időzíteni, hogy az abszorbancia leolvasása minden egyes kémcsőben azonos időintervallumot követően történjen. A műszert kalibrálni kell, majd az abszorbanciát sorrendben kell venni minden egyes csőből. A standardgörbét az abszorbancia és az X anyag mennyiségének ábrázolásával kapjuk meg. Ha az összefüggés egyértelműen lineáris, akkor nincs is szükség standardgörbére. A mennyiségek interpolációval határozhatók meg. A görbét a vizsgálat első használatakor kell elkészíteni a pontosság és a linearitás ellenőrzésére.
Példa a standardgörbére
Íme, így nézhet ki a grafikon egy laborfüzetben (a hallgatónak nyilvánvalóan kiváló a kézírása). Az összefüggés nem tökéletesen lineáris, inkább egy tipikus kihalási mintázatot mutat.
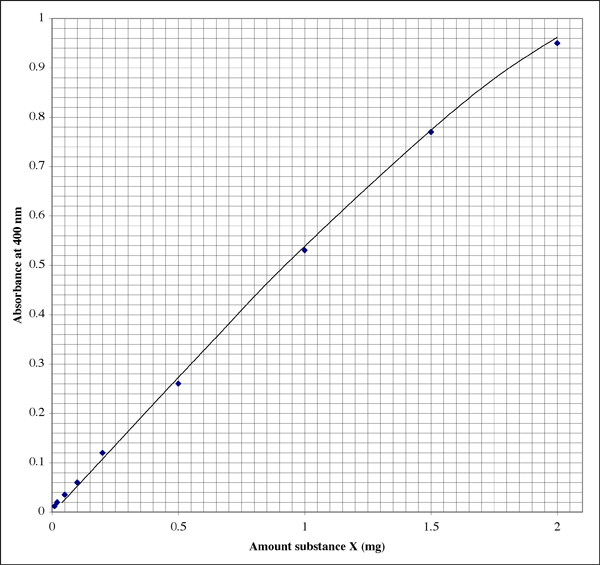
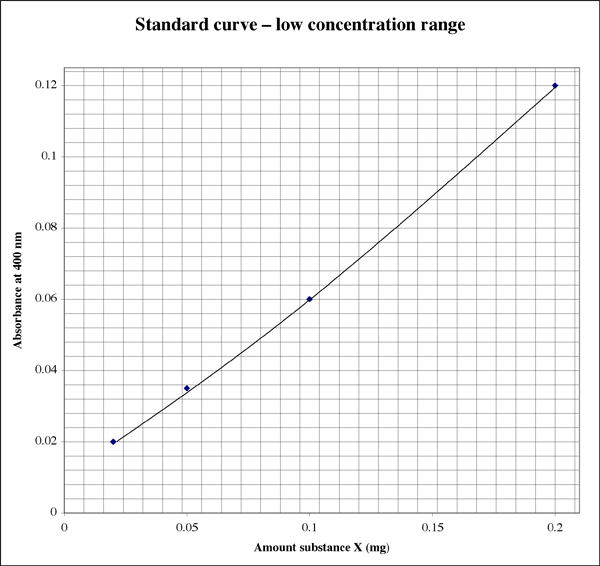
Mivel a tartomány ilyen széles, a nagyon alacsony abszorbanciaértékeket adó minták esetében a hallgatónak szüksége lehet egy második, nagyobb felbontású diagramra.
A minta koncentrációjának meghatározása
A koncentráció valaminek a térfogategységre eső mennyisége. A fehérjekoncentrációkat általában milligramm/milliliterben (mg/ml) adjuk meg, bár néha kényelmes a mikrogramm/mikroliter (µg/µl) vagy esetleg még a µg/ml (nagyon kis koncentrációk esetén) használata is. Egy ismeretlen esetében az anyag mennyiségét (a standard görbéből) elosztjuk a vizsgálathoz használt minta térfogatával. Vegye figyelembe, hogy ez a térfogat nem a vizsgálati térfogat, és nem is a hígított minta térfogata. Osszuk el az assay-csőbe helyezett hígítatlan minta térfogatával.
Tegyük fel, hogy az 1. mintához három vizsgálati csövet készített, amelyekben 500 µl, 50 µl és 5 µl minta van. Tegyük fel, hogy ezek 0,86, 0,12, illetve 0,01 abszorbanciaértéket adtak. Az utolsó abszorbancia természetesen skálán kívül van. A metszéspontnak nullának kellene lennie, de nem számíthatunk arra, hogy a nagyon alacsony abszorbanciák kellően pontos értékeket adnak.\
A 0,86-os abszorbancia 1,7 mg X anyagnak felel meg. A térfogat 500 µl (0,5 ml) volt, így 3,4 mg/ml koncentrációt kapunk. Ez jól hangzik. A másik leolvasható kémcsövet ellenőrizve a 0,12-es abszorbancia azt jelzi, hogy a kémcső 0,20 mg X anyagot tartalmazott. A térfogat 50 µl (0,050 ml) volt. A koncentrációnak 0,20 mg/0,050 ml = 4,0 mg/ml-nek kell lennie. Melyik eredményt használjuk, vagy vegyük az átlagot?
Azt tapasztaltam, hogy az érzékeny tartomány közepéhez legközelebb eső abszorbanciaérték használata adja a legpontosabb eredményt. A fenti példában a középső érték 0,5 asorbancia, ami 0,1 mg anyagnak felel meg. Az abszorbancia-skála logaritmikus, így még a digitális kijelzőn is a skála alsó végénél megbízhatóbbak a leolvasások. Nagyon alacsony abszorbanciaértékeknél azonban egy vagy több ismeretlen tényező, például a mintacső vagy a küvetta hibája nagyobb hatással lesz az abszorbanciaértékre, mint magasabb abszorbanciaértékeknél. A tartomány felső végén a színreagens megközelíti a telítettséget, így nem csak az abszorbanciaértékek közötti felbontás csökken, de a reagens kevésbé érzékeny a fehérjekoncentráció különbségeire.