ここでは、溶液中にある物質の濃度を決定するための比色アッセイの設定と実行方法について説明します。
General approach
我々は顕微鏡下に物質を置いて単位容量あたりの細胞数を数えることができるように、単位容量あたりの分子数を数えることはできません。 目的の物質の濃度に比例して測定できるものを探さなければなりません。 測定に最もよく使われるのは、光の吸光度である。 ベールの法則によれば、溶質が特定の波長の光を吸収する場合、その吸光度は溶液中の物質の濃度に正比例することが分かっています。 吸光度を測定し、定量的な単位で表示・記録するために分光光度計と呼ばれる装置が使用される。 物質単体では光を吸収しないため、実用的な分析ができないことが多い。 そのため、未知物質の濃度に応じた色の化合物を生成するために、1種類以上の試薬を採用する必要がある場合があります。
ある試料の吸光度を測定しても、比較のための標準物質がない限り、ほとんど何もわからない。 例えば、試料Xの吸光度が0.5であった場合、実際のXの濃度はどの程度でしょうか。 もし、濃度のわかっている試料があり、その試料の吸光度が0.5であれば、その物質の濃度は同じであることは間違いないでしょう。 例えば、いくつもの試料があり、その濃度にばらつきがあるとします。 このような場合、未知物質の濃度がどのような範囲にあるかを示す標準物質がいくつかあれば便利です。 そこで登場するのが標準曲線です。 低濃度から高濃度まで、Xの既知濃度の標準試料を何本か用意します。 アッセイを実行し、各標準物質の吸光度対濃度をプロットします。 この標準曲線を用いて、吸光度から未知物質の濃度を読み取ります。
制御
アッセイを行う場合、測定する物質だけが目的の波長域の光の吸光度を持つようにしなければなりません。 標準品と未知試料を調製する条件はすべて同じにする必要があります。 もし、サンプルバッファー中の溶質が吸光度に影響を与えるようであれば、問題です。 標準品と未知試料を調製する際の容量を変えても正確な結果は得られません。 吸光度を読み取るタイミングや保存温度など、物理的な要因はすべて同じにする必要があります。 未知試料や標準試料に同一のバッファーを使用することは現実的ではないので、どのバッファーも吸光度に大きな影響を与えないようにすればよいのです。
すべての標準物質と未知物質を同じ容量で使用すると、分析が非常に簡単になります。 標準曲線は、濃度ではなく、吸光度対物質量をプロットすることができます。 特に希釈が必要な場合、アッセイを行う際に量で作業する方が混乱しないかもしれません。 特に希釈が必要な場合、アッセイに使用した元の試料の量がわかっていれば、濃度を決定するのは簡単です。
コンプリケーション
すべてのアッセイには限界があります。 ある最小値以下の物質量は検出されない。 ある最大量または濃度を超えると、アッセイは飽和状態になり、つまり、量または濃度の増加は吸光度に影響を及ぼさなくなります。 一般的には吸光度が濃度に正比例するような直線範囲内で測定しようとします。 理想的には、アッセイの有用範囲全体を網羅するような標準試料を設定することです。 つまり、アッセイの範囲を最適化するのです。
試料が非常に高濃度であるため、規定量の試料を測定したところ、測定結果がスケールから外れてしまうことがよくあります – 測定試薬が飽和しているのです。 この場合、試料を希釈することで解決します。 例えば、標準品や試料の容量が1mlで、未知試料を1ml測定したところ、オフスケールになった場合、0.1mlの試料と0.9mlの緩衝液を試験管に入れて測定します。 標準曲線から濃度を読み取った場合は、その結果に 10 をかけて、試料中の実際の濃度を求めます。
試料が非常に高濃度で、少量ずつ正確にピペッティングできない場合、連続希釈を行う必要があります。
例:標準曲線の作成
物質Xを測定するために、仮想の測定法を設定します。Xと測定試薬を混ぜると、波長400 nmの光を吸収する複合体が形成されます。 分光光度計では、各キュベットに2mlの容量を入れることになっています。 キュベットとは、吸光度を測定するために光路上に置く透明な容器のことです。 試薬と試料の比率を適正にするため、試料を0.5mlにし、発色試薬を1.5mlずつチューブに入れる。 このように設定すると、わずか10マイクログラム(μg)から最大2ミリグラム(mg)までのXを検出できます。
基準
分光光度計を校正するには、物質Xが入っていないことを除いて、標準試料とあらゆる点で同一の基準管を必要とします。 一方、参照管を光路上に設置した場合は、吸光度がゼロになるように設定します。 そうすれば、Xを含む試料は、その範囲内の吸光度を示すことになる。
この仮想的な例では、0.5mlのサンプルバッファと1.5mlの発色試薬が含まれています。
規格
この例は、説明のための仮想のアッセイを記述しているだけです。
私たちは得られる最高の精度を求め、その範囲は2桁に及ぶので、標準曲線を設定する1つの方法は、標準物質の対数的な進行です。 0.01 mgから2 mgまでの標準物質が必要です。 0.01, 0.02, 0.05, 0.1, 0.2, 0.5, 1, そして 2 mg の量を試してみましょう。 最後のギャップはかなり広いので、例えば1.5 mgの標準を1つ放り込んでみましょう。 標準物質を調製するには、まずその物質の濃縮原液を用意するのが便利です。 必要な最大量は2mgで、容積は0.5mlです。 少し「余裕」を持たせるために、5 mg/ml の物質 X の原液を作るとします。
表1. 標準曲線の計画方法の例 原液中のタンパク質の濃度は5mg/mlとした。 この例は説明のためのものです。
| 物質Xの量 (mg) | ストック溶液の量 (μl) | バッファーの量 (μl) |
|
0(基準) |
0 | 500 |
| 2 | 498* | |
| 0.02 | 4 | 496* |
| 0.05 | 490 | |
| 0.1 | 20 | 480 |
| 0.2 | 40 | 460 |
| 0.5 | 100 | 400 |
| 1 | 200 | 300 |
| 1.5 | 300 | 200 |
| 2 | 400 | 100 |
*ピペッターは有効数字2桁以内の容量を出すことが一般的です
バッファーは原液容量ほど重要ではありません。
緩衝液の量は原液の量ほど重要ではありません。緩衝液の分注の誤差は全体の量に影響し、発色試薬の濃度に影響します。 1%未満の誤差は結果に大きな影響を与えません。 実際、試薬の量が試料の量を大きく上回っている場合(このケースではありません)、バッファーを追加して量を均一化する必要はありません。
ラボによっては、5μl以下のピペッターを正確に装備していないところもあります。 例えば、2~4μlの原液をアッセイチューブに入れるために、連続希釈を行う必要があるかもしれません。
Sample preparation
予想されるサンプルの濃度範囲について、妥当な見積もりをすることができます。 また、濃度が高すぎて吸光度の測定値が範囲外になってしまった場合に備えて、希釈範囲の広い試料を準備しておくとよいでしょう。
例のアッセイでは、アッセイチューブに500μl(最大量)の試料を入れた場合、吸光度を読み取るには4mg/ml以下の濃度にする必要があります。 一方、例えば10倍濃度の低い試料であれば、その程度の吸光度が欲しいところです。 ある試料の濃度について何も知らない場合、その範囲をカバーするために、1本のチューブに500μlを入れることになる。 このアッセイは幅広い濃度範囲に対応しているので、2本目のアッセイチューブには50μlを使用することができます。 この場合、試料は40 mg/mlまで濃縮することができ、アッセイチューブには4 mg以下となり、測定結果を読み取ることができます。 また、3本目のアッセイチューブには5μlのサンプルでアッセイすることも可能です。
アッセイの実行
すべての標準物質と未知物質の準備ができたら、次のような結果が得られます。
- 標準管1本
- アッセイの全範囲をカバーする標準管2~3本
一連の希釈を表すサンプルごとのアッセイ管 の準備ができたら、発色操作を行う時間です。 実用的な場合は、各チューブの吸光度が同じ時間間隔で読み取られるように、各標準物質とサンプルの処理のタイミングを計る必要があります。 装置の校正を行った後、各チューブの吸光度を順番に測定してください。 標準曲線は、吸光度と物質 X の量をプロットして得られますが、明らかに直線的な関係であれば、標準曲線は必要ありません。 量は内挿法で求めることができる。
標準曲線の例
実験ノートにこのようなプロットがあります(この学生は明らかに素晴らしい手書き文字を持っています)。 この関係は完全な直線ではなく、むしろ典型的な消滅パターンを示しています。
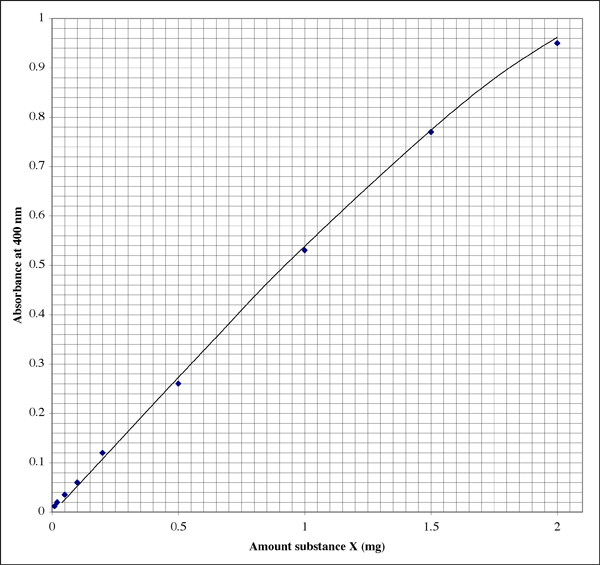
範囲が非常に広いので、非常に低い吸光度の測定値を与えるサンプルでは、学生は 2 番目の高解像度プロットが必要かもしれません。
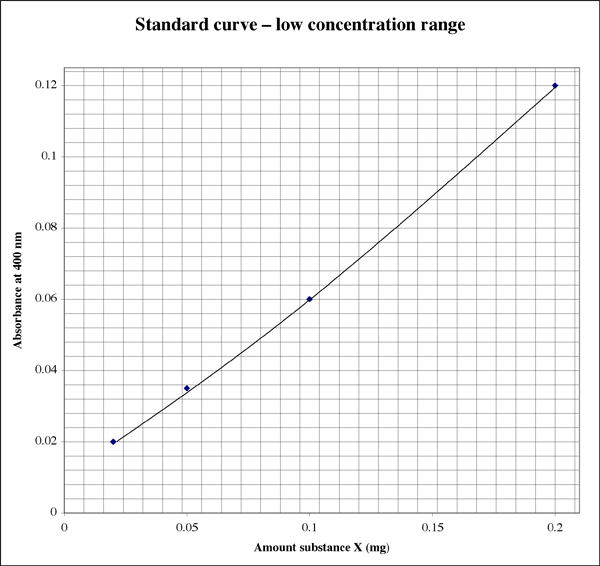
サンプルの濃度を決定する
濃度とは、単位体積あたりの何かの量を表します。 通常、タンパク質の濃度はミリグラム/ミリリットル(mg/ml)で報告しますが、マイクログラム/マイクロリットル(μg/μl)、あるいはμg/ml (非常に小さな濃度の場合)を使用すると便利な場合があります。 未知物質の場合は、標準曲線から求めた物質量を測定に用いた試料の量で割る。 この容量は、アッセイ容量でもなく、希釈したサンプル容量でもないことに注意してください。 アッセイ管に入れた原液の体積で割ります。
サンプル1のアッセイチューブを3本用意し、それぞれ500μl、50μl、5μlのサンプルを入れたとします。 それぞれ吸光度が0.86、0.12、0.01と出たとします。 もちろん、最後の吸光度はスケールから外れています。 0.86の吸光度は1.7mgの物質Xに対応します。容量は500μl(0.5ml)なので、3.4mg/mlの濃度となります。 良さそうですね。 もう一つの読み取り可能なチューブを確認すると、吸光度0.12は、そのチューブに0.20 mgの物質Xが含まれていることを示しています。 濃度は、0.20 mg/0.050 ml = 4.0 mg/ml となるはずです。 どの結果を使うか、それとも平均を取るか?
感度範囲の中央に最も近い吸光度を使用することで、最も正確な結果が得られることが分かっています。 上の例では、中央が0.5の吸光度であり、0.1mgの物質に相当します。 吸光度のスケールは対数であるため、デジタル表示でもスケールが小さいほど信頼性が高くなります。 しかし、非常に低い吸光度では、サンプルチューブやキュベットの欠陥のような1つまたは複数の未知の要因が、高い吸光度よりも吸光度値に大きな影響を及ぼします。 吸光度範囲の上限では試薬が飽和状態に近づくため、吸光度測定値間の分解能が低下するだけでなく、試薬はタンパク質濃度の違いに対する感度が低くなります。