Voici une description de la façon dont on met en place et réalise un test colorimétrique pour déterminer la concentration d’une substance qui est en solution.
Approche générale
Nous ne pouvons pas mettre de la matière sous un microscope et compter le nombre de molécules par unité de volume comme nous pouvons compter le nombre de cellules par unité de volume. Nous devons trouver quelque chose que nous pouvons mesurer et qui est proportionnel à la concentration de la substance d’intérêt. La mesure la plus couramment utilisée dans les analyses est l’absorbance de la lumière. La loi de Beer nous dit que si un soluté absorbe la lumière d’une longueur d’onde particulière, l’absorbance est directement proportionnelle à la concentration de la substance en solution. Un appareil appelé spectrophotomètre est utilisé pour mesurer et afficher et/ou enregistrer l’absorbance en unités quantifiables. Souvent, la substance en elle-même n’absorbe pas la lumière de manière à permettre un dosage pratique. Nous pouvons avoir à employer un ou plusieurs réactifs pour produire des composés colorés en proportion de la concentration d’inconnu.
La mesure de l’absorbance de la lumière par un échantillon nous dit très peu de choses à moins que nous ayons une norme de comparaison. Par exemple, si l’échantillon X présente une absorbance de 0,5, quelle est la concentration réelle de X ? Si nous disposons d’un échantillon de concentration connue et que cet échantillon présente également une absorbance de 0,5, nous sommes raisonnablement sûrs que la substance a la même concentration. Supposons que vous ayez un certain nombre d’échantillons et que leurs concentrations varient. Il serait utile d’avoir un certain nombre d’étalons qui couvrent toute la gamme des concentrations probables de notre inconnu. C’est là qu’intervient la courbe standard. Nous préparons une série d’étalons de concentration connue de X, allant d’une concentration faible à une concentration élevée. Nous effectuons le test et traçons l’absorbance en fonction de la concentration pour chaque étalon. En utilisant cette courbe standard, nous pouvons lire la concentration pour un inconnu étant donné sa lecture d’absorbance.
Contrôles
Lorsque nous effectuons un dosage, nous devons nous assurer que seule la substance que nous dosons est responsable de l’absorption de la lumière dans la gamme de longueur d’onde qui nous intéresse. Toutes les conditions dans lesquelles les étalons et les inconnus sont préparés doivent rester identiques. Si les solutés présents dans les tampons d’échantillon affectent l’absorbance, nous avons un problème. Nous n’obtiendrons pas de résultats précis si nous faisons varier les volumes dans lesquels nous préparons et dosons les étalons et les inconnus. Le moment de la lecture de l’absorbance, la température à laquelle nous conservons les matériaux et tous les autres facteurs physiques doivent rester les mêmes. Comme il n’est pas toujours pratique d’utiliser des tampons identiques pour toutes les inconnues et tous les étalons, nous devons seulement nous assurer qu’aucun des composants de l’un des tampons n’a un effet significatif sur l’absorbance.
Lorsque nous utilisons le même volume pour tous les étalons et les inconnus, nous simplifions considérablement l’analyse. La courbe standard peut tracer l’absorbance en fonction de la quantité de substance au lieu de la concentration. Il peut être moins déroutant de travailler avec des quantités lors d’un dosage, surtout si des dilutions sont nécessaires. Tant que vous connaissez le volume initial de l’échantillon qui a été utilisé dans un dosage, la détermination de la concentration est facile.
Complication
Tous les dosages ont des limites. Des quantités de substance inférieures à un certain minimum seront indétectables. Au-delà d’une certaine quantité ou concentration maximale, un dosage devient saturé, c’est-à-dire que l’augmentation de la quantité ou de la concentration n’affecte pas l’absorbance. Nous essayons généralement de travailler dans la plage linéaire d’un test, c’est-à-dire là où l’absorbance est directement proportionnelle à la concentration. L’idéal serait d’établir des normes qui englobent toute la gamme utile d’un essai. C’est-à-dire que nous optimisons la gamme de l’essai.
Il arrive souvent qu’un échantillon soit si concentré que lorsqu’on dose le volume prescrit d’échantillon, le résultat est hors échelle – le réactif de dosage est saturé. La solution consiste alors à diluer l’échantillon. Par exemple, si le volume de chaque standard ou échantillon est de 1 ml, et que 1 ml de votre inconnu donne un résultat hors échelle, vous pouvez ajouter 0,1 ml d’échantillon dans un tube à essai avec 0,9 ml de tampon. Si vous lisez une concentration sur la courbe standard, multipliez le résultat par 10 pour obtenir la concentration réelle dans l’échantillon. Si vous lisez une quantité à partir de la courbe standard, alors divisez simplement cette quantité par 0,1 ml pour obtenir votre concentration.
Lorsque les échantillons sont si concentrés que vous ne pouvez pas pipeter une quantité suffisamment petite avec précision, vous pouvez avoir à effectuer des dilutions en série.
Exemple : préparation d’une courbe standard
Nous allons mettre en place un essai hypothétique pour mesurer la substance X. Lorsque X est mélangé avec un réactif d’essai, un complexe se forme qui absorbe la lumière à la longueur d’onde 400 nm. Notre spectrophotomètre exige que nous mettions un volume de 2 ml dans chaque cuvette. Une cuvette est un récipient transparent que l’on place dans un trajet lumineux pour mesurer l’absorbance. Pour obtenir la bonne proportion de réactif de dosage par rapport à l’échantillon, nous faisons en sorte que le volume de notre échantillon soit de 0,5 ml et nous ajoutons 1,5 ml de réactif de couleur dans chaque tube. Configuré de cette manière, le dosage peut détecter des quantités de X allant de 10 microgrammes (µg) à 2 milligrammes (mg).
Référence
Pour étalonner le spectrophotomètre, nous avons besoin d’un tube de référence identique en tous points aux étalons et aux échantillons, sauf qu’il ne contient aucune substance X. Avec le trajet lumineux bloqué, le spectrophotomètre sera réglé pour lire une absorbance infinie (aucune transmission de la lumière). Avec le tube de référence dans le trajet de la lumière, nous réglerons le spectrophotomètre pour qu’il indique une absorbance nulle. De cette façon, un échantillon contenant X donnera une absorbance dans cette plage. Le tube de référence est utilisé pour nous donner la gamme dynamique maximale.
Pour cet exemple hypothétique, la référence contiendra 0,5 ml de tampon d’échantillon et 1,5 ml de réactif de couleur.
Normes
Cet exemple décrit un essai hypothétique à des fins d’illustration uniquement.
Nous voulons la meilleure précision possible, et notre gamme s’étend sur deux ordres de grandeur, donc une façon d’établir la courbe standard est avec une progression logarithmique des standards. Nous avons besoin d’étalons de 0,01 mg à 2 mg. Essayons des quantités de 0,01, 0,02, 0,05, 0,1, 0,2, 0,5, 1 et 2 mg. Le dernier écart est plutôt large, alors ajoutons un étalon de, disons, 1,5 mg. Pour préparer les étalons, il est pratique de commencer par une solution mère concentrée de la substance. La plus grande quantité dont nous avons besoin est de 2 mg, dans un volume de 0,5 ml. Pour nous donner un peu de « marge de manœuvre », préparons une solution mère de 5 mg/ml de la substance X. Le tableau suivant présente les calculs.
Tableau 1. Exemple de planification d’une courbe standard. La concentration de protéines dans la solution mère était de 5 mg/ml. Cet exemple n’est donné qu’à titre d’illustration.
| quantité de substance X (mg) | volume de la solution mère (µl) | volume du tampon (µl) |
|
0 (référence) |
0 | 500 |
| 0.01 | 2 | 498* |
| 0.02 | 4 | 496* |
| 0.05 | 490 | |
| 0.1 | 20 | 480 |
| 0.2 | 40 | 460 |
| 0.5 | 100 | 400 |
| 1 | 200 | 300 |
| 1.5 | 300 | 200 |
| 2 | 400 | 100 |
*Il est courant d’utiliser des pipettes qui nous donnent des volumes qui ne sont pas précis à plus de 2 chiffres significatifs.
Le volume du tampon n’est pas aussi critique que le volume de la solution mère. Les erreurs de pipetage du tampon affectent le volume total et, par conséquent, la concentration du réactif coloré. Des erreurs de moins de 1% n’auront pas d’effet significatif sur les résultats. En fait, si le volume du réactif coloré dépasse largement le volume de l’échantillon (pas dans ce cas), nous n’aurions même pas besoin d’égaliser les volumes en ajoutant du tampon.
Certains laboratoires ne sont pas équipés de pipettes qui descendent en dessous de 5 µl avec précision. Il peut être nécessaire d’effectuer une dilution en série pour obtenir, par exemple, 2 ou 4 µl de solution mère dans un tube à essai.
Préparation de l’échantillon
Il est utile d’avoir une estimation raisonnable des plages de concentrations de l’échantillon que l’on peut attendre. Même avec une telle estimation, il est bon de préparer des échantillons avec une gamme de dilutions, au cas où un échantillon est tellement concentré que ses lectures d’absorbance sont hors de la gamme.
Pour le test de l’exemple, si nous utilisons 500 µl d’échantillon dans un tube à essai (le volume maximum), sa concentration devrait être inférieure à 4 mg/ml pour donner une absorbance lisible. En revanche, nous en voudrions autant si l’échantillon était, disons, dix fois moins concentré. Ne sachant rien de la concentration d’un échantillon particulier, nous chargerions un tube avec 500 µl pour couvrir cette gamme. Puisque l’essai couvre une large gamme de concentrations, nous pouvons utiliser 50 µl dans un second tube d’essai. Maintenant, l’échantillon peut être aussi concentré que 40 mg/ml et nous aurons toujours 4 mg ou moins dans le tube de test, donnant un résultat lisible. Pour couvrir toutes les bases, nous pouvons doser un troisième tube avec seulement 5 µl d’échantillon.
Réaliser le test
Quand tous les standards et les inconnus seront prêts, nous aurons :
- 1 tube de référence
- un certain nombre d’étalons qui couvrent toute la gamme de l’essai
- deux ou trois tubes d’essai par échantillon représentant une série de dilutions
Il est temps de réaliser la procédure de développement de la couleur, qui peut être aussi simple que d’ajouter un réactif coloré et de laisser les échantillons reposer pendant quelques minutes. Lorsque cela est possible, le traitement de chaque standard et de chaque échantillon doit être chronométré afin que l’absorbance soit lue après le même intervalle de temps pour chaque tube. L’instrument doit être calibré, puis les absorbances doivent être relevées pour chaque tube dans l’ordre. Une courbe standard est obtenue en traçant l’absorbance en fonction de la quantité de la substance X. Si la relation est clairement linéaire, une courbe standard n’est même pas nécessaire. Les quantités peuvent être déterminées par interpolation. Une courbe doit être construite la première fois qu’un dosage est utilisé, pour vérifier la précision et la linéarité.
Exemple de courbe standard
Voici à quoi pourrait ressembler le tracé dans un cahier de laboratoire (l’étudiant a manifestement une excellente écriture). La relation n’est pas parfaitement linéaire, elle montre plutôt un modèle d’extinction typique.
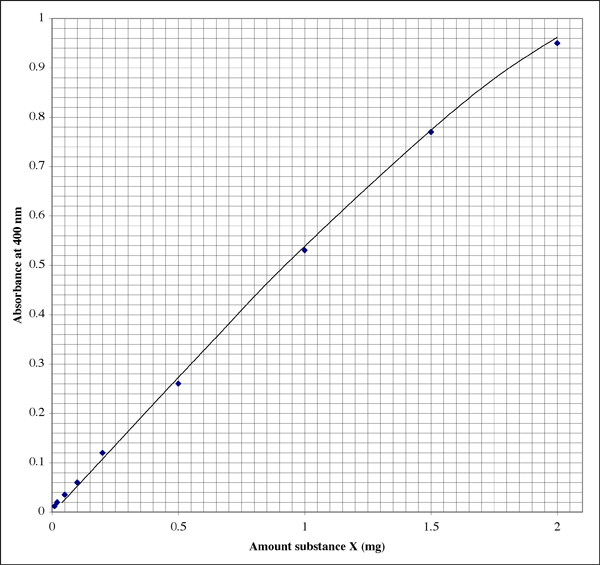
Puisque la gamme est si large, pour les échantillons donnant des lectures d’absorbance très basses, un étudiant pourrait vouloir un second tracé de plus haute résolution.
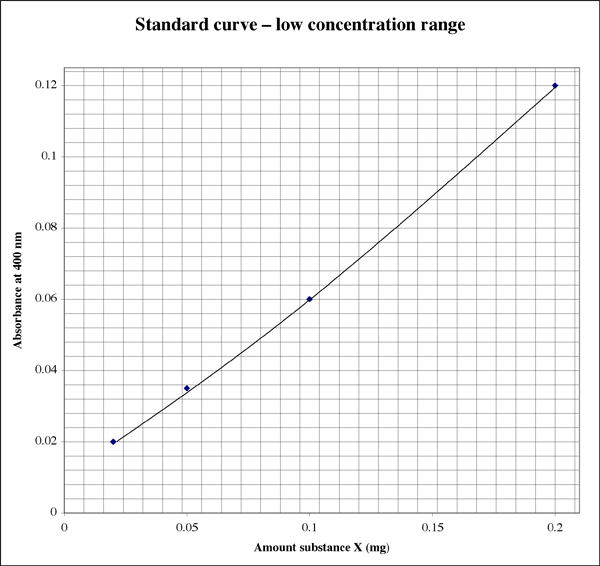
Déterminer la concentration d’un échantillon
Une concentration est une quantité de quelque chose par unité de volume. Nous rapportons généralement les concentrations de protéines en milligrammes par millilitre(mg/ml), bien qu’il soit parfois pratique d’utiliser les microgrammes/microlitre (µg/µl) ou peut-être même µg/ml (pour les très petites concentrations). Pour une inconnue, on divise la quantité de substance (de la courbe standard) par le volume de l’échantillon utilisé dans l’essai. Notez que ce volume n’est pas le volume de l’essai, ni celui de l’échantillon dilué. Divisez par le volume de l’échantillon non dilué que vous avez placé dans le tube de dosage.
Supposons que vous ayez préparé trois tubes de dosage pour l’échantillon n°1, contenant respectivement 500 µl, 50 µl et 5 µl d’échantillon. Supposons qu’ils aient donné des lectures d’absorbance de 0,86, 0,12 et 0,01, respectivement. La dernière absorbance est hors échelle, bien sûr. L’interception devrait être nulle, mais nous ne pouvons pas compter sur des absorbances très faibles pour nous donner des lectures suffisamment précises.\
Une absorbance de 0,86 correspond à 1,7 mg de substance X. Le volume était de 500 µl (0,5 ml), nous obtenons donc une concentration de 3,4 mg/ml. Cela semble bon. En vérifiant l’autre tube lisible, l’absorbance de 0,12 indique que le tube contenait 0,20 mg de substance X. Le volume était de 50 µl (0,050 ml). La concentration devrait être de 0,20 mg/0,050 ml = 4,0 mg/ml. Quel résultat utilisons-nous, ou prenons-nous une moyenne ?
J’ai constaté que l’utilisation de la seule lecture d’absorbance qui se situe le plus près du milieu de la plage sensible donne les résultats les plus précis. Dans l’exemple ci-dessus, le centre est une asorbance de 0,5, correspondant à 0,1 mg de substance. L’échelle d’absorbance est logarithmique, de sorte que même à partir d’un affichage numérique, les lectures sont plus fiables à l’extrémité inférieure de l’échelle. Cependant, à des absorbances très faibles, un ou plusieurs facteurs inconnus, tels qu’un défaut dans le tube ou la cuvette de l’échantillon, auront un effet plus profond sur la valeur d’absorbance qu’à des absorbances plus élevées. À l’extrémité supérieure de l’échelle, le réactif coloré s’approche de la saturation, de sorte que non seulement vous avez moins de résolution parmi les lectures d’absorbance, mais le réactif est moins sensible aux différences de concentration des protéines.