Ptosis, formeel bekend als blepharoptosis, is een veel voorkomende bevinding die wordt gekenmerkt door hangend bovenooglid bij primaire staar. Gewoonlijk is ptosis slechts een realiteit van veroudering, maar sommige voorvallen houden verband met systemische ziekten of genetische afwijkingen. Voor sommige personen met ptosis is cosmesis de eerste zorg, maar meer gevorderde gevallen worden geassocieerd met verstoring van het gezichtsveld, belasting van de oogleden, veranderde hoofdpositie in een poging te compenseren en hoofdpijn door belasting van de voorhoofds- en hoofdhuidspieren.1 Dit alles kan de kwaliteit van leven van een patiënt verminderen.
Hier beschrijven we enkele oorzaken van ptosis, met de nadruk op verworven vormen, en zullen we richtlijnen geven voor het monitoren en opwerken van patiënten.
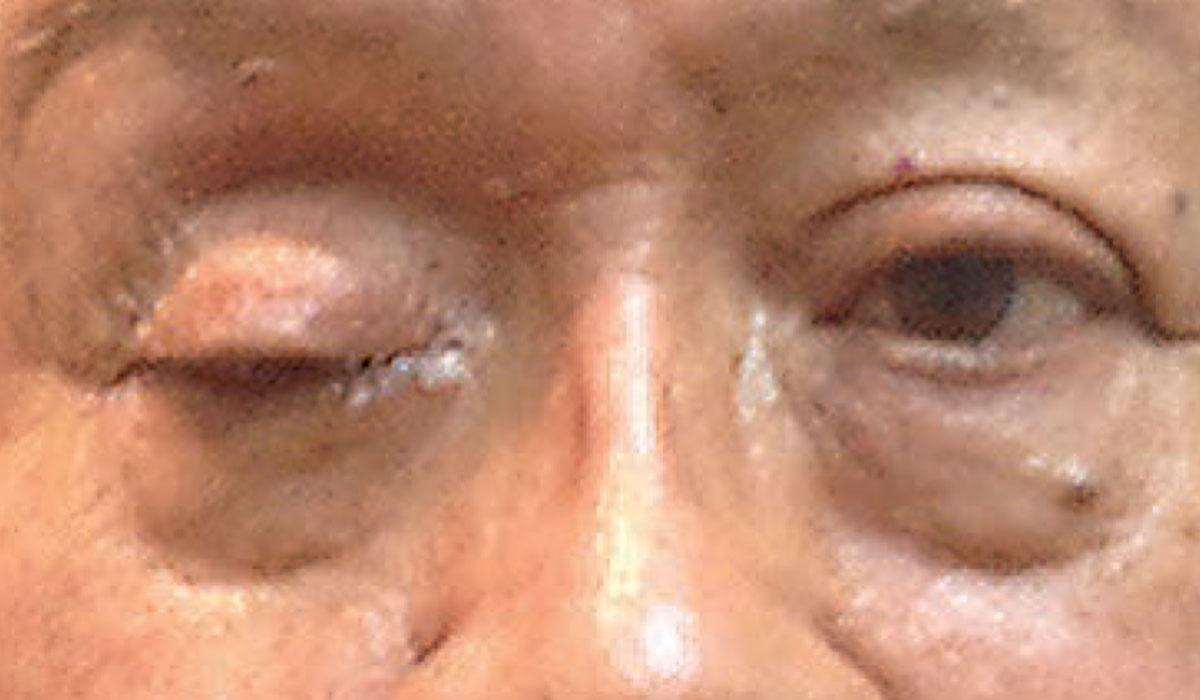
Volledige ptosis kan wijzen op de aanwezigheid van een dringende neurologische aandoening. Foto: Michael Trottini, OD. Klik op de afbeelding om te vergroten.
Anatomische verklaring
Mechanisch gezien houdt ptosis verband met disfunctie van de spieren die verantwoordelijk zijn voor het optrekken van het ooglid. Dit zijn de superieure palpebrale levator en de superieure tarsale spier, ook wel Müllerspier genoemd. Verlies van tonus in één van beide resulteert in ptosis.2 De superieure palpebrale levator is echter de belangrijkste retractor van het bovenste ooglid en daarom veroorzaakt een gebrek in zijn functie een belangrijkere ptosis.2 De levator is afkomstig van de onderste vleugel van het sphenoid en wordt een waaiervormige pezige uitbreiding, de levator aponeurosis, wanneer deze het ooglid binnengaat.2 De vezels van de aponeurosis dringen door het orbitale septum en strekken zich uit tot in het bovenste ooglid, waaierend over de gehele lengte en inserterend op het anterieure aspect van de tarsale plaat. De levator ontvangt zijn innervatie van de superieure afdeling van de craniële zenuw III (CN III).3
Müllerspier ontspringt aan de inferieure zijde van de levator, juist posterieur van de fornix, en insereert op de superieure rand van de tarsale plaat.4
Deze spier wordt geïnnerveerd door sympathische vezels; denervatie van de Müller’s spier zal slechts een milde ptosis van 1mm tot 2mm veroorzaken.3-5
Patiënt Evaluatie
Wanneer een persoon zich presenteert met klachten van ptosis, is de eerste stap het verkrijgen van een grondige klinische geschiedenis. Deze moet een zorgvuldige beoordeling van het verleden omvatten systemische en oculaire medische geschiedenis, eventuele veranderingen in de gezondheid en medicijngebruik.
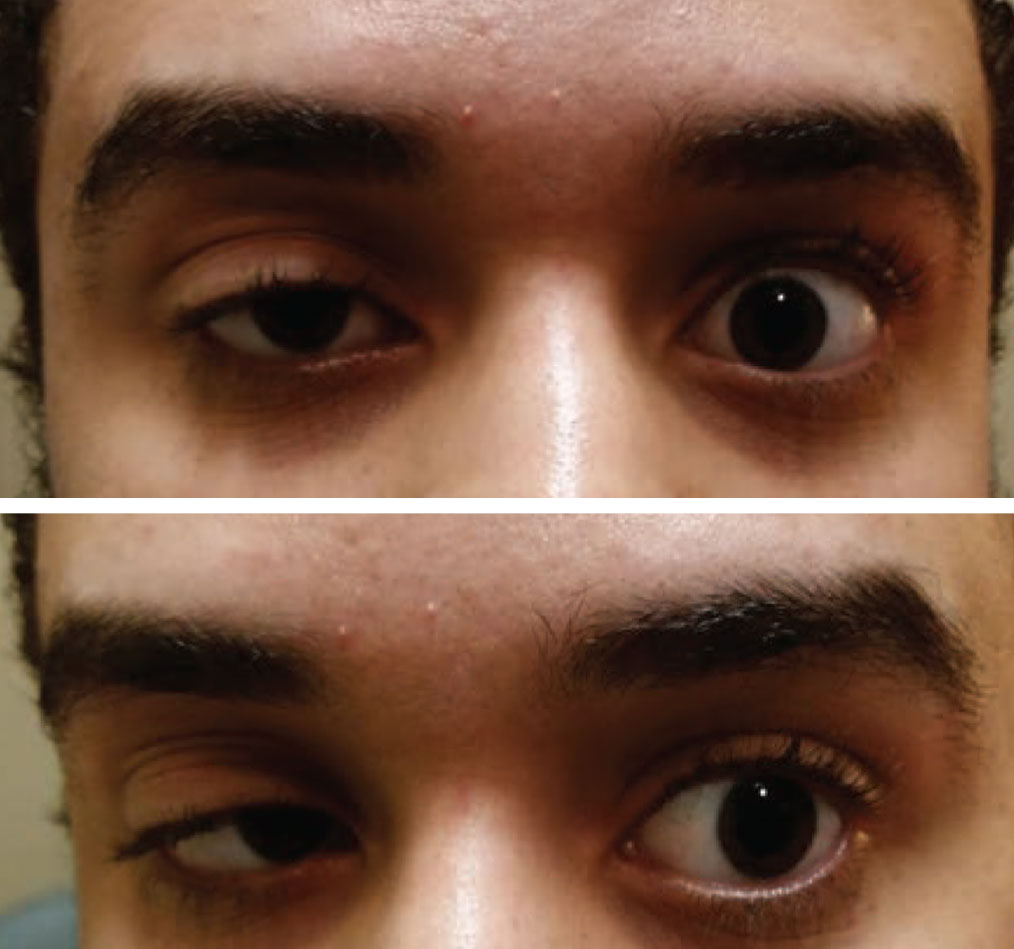
Verworven ptosis aan het ene oog en een beweeglijkheidsbeperking aan het andere oog moet worden beschouwd als myasthenia gravis tot het tegendeel is bewezen. Foto: Paul Ajamian, OD. Klik op de afbeelding om te vergroten.
Ptosis kan zowel aangeboren als verworven zijn, monoculair of binoculair en progressief of niet-progressief. Deze kenmerken moeten worden vermeld in de anamnese, samen met een onderzoek naar eventuele geassocieerde neurologische en oogheelkundige symptomen, zoals wazig zien, diplopie, pijn, perifeer veldverlies, hoofdpijn of gegeneraliseerde spierzwakte. Vraag naar eventuele trauma’s of eerdere oogoperaties, samen met een geschiedenis van botulinum toxine injecties of oogheelkundig gebruik van steroïden.6,7
Inzicht in het beloop met betrekking tot de duur van de ptosis en of deze progressief is, oplost of onveranderd is vanaf het begin is belangrijk, samen met elke indicatie van dagelijkse variabiliteit. Een acuut begin van uren of dagen voor het onderzoek doet vrezen voor een ernstige pathologische etiologie.
Bekijken van oude foto’s kan altijd helpen om een verandering te bevestigen als de patiënt een slechte historicus is.8
Clinisch onderzoek
De beoordeling van patiënten met ptosis omvat veel van de standaardonderdelen van een uitgebreid oogonderzoek. Beoordeling van de gezichtsscherpte en het binoculaire gezichtsvermogen kan helpen bij de indicatie van een mogelijke oorzakelijke systemische ziekte en bij de beoordeling van amblyopie of scheefstand. Indien patiënten een chirurgische correctie van de ptosis ondergaan, kunnen amblyopie of phorias wijzen op mogelijke fusieproblemen. Testen van de pupil en extraoculaire beweeglijkheid, samen met externe observatie voor asymmetrie van de oogbol, zijn van cruciaal belang om te evalueren voor andere gerelateerde pathologie die later wordt besproken. Observatie van de hoofdpositie van de patiënt en gezichtsveldtesten kunnen helpen bij het bepalen van de impact en ernst van de ptosis.
Kwantitatieve metingen van de ooglidpositie helpen bij het beoordelen van de retractor spierfunctie, het identificeren van anatomische afwijkingen en kunnen ook nuttig zijn bij het monitoren van progressie of verbetering van ptosis in de loop van de tijd.
Primeel worden deze metingen, marge reflex afstand (MRD) 1, 2 en 3 genoemd, uitgevoerd met behulp van een penlicht gericht op de ogen van de patiënt terwijl deze in primaire blik staat. Voor MRD1 wordt de afstand in millimeters tussen het centrale deel van de bovenste ooglidrand en de pupilreflex voor beide ogen geregistreerd.9-11 Een normale MRD1 is 4mm tot 5mm.5 Het verschil in MRD1 tussen het normale en het ptotische oog is de mate van ptosis. Als de ptosis significant genoeg is dat de pupilreflex niet kan worden gezien, dan wordt de afstand in millimeters die het ooglid moet worden opgetrokken tot de pupilreflex kan worden gezien, geregistreerd als de MRD1 in negatieve getallen.9
MRD2 verschilt in die zin dat het meet in de primaire oogopslag, vanaf de corneale lichtreflex tot het centrale deel van het onderste ooglid.12 MRD3 bepaalt hoeveel levator te resecteren bij patiënten met congenitale ptosis, die een verticale strabismus hebben geassocieerd met ptosis en bij wie strabismuschirurgie niet geïndiceerd is.12
Levatorfunctie kan worden gemeten door de totale beweging in millimeters van het bovenste ooglid te bepalen van downgaze naar upgaze. Deze meting is belangrijk voor de chirurg bij het bepalen van de meest geschikte corrigerende procedure. Een normale levatorfunctie is gewoonlijk groter dan 15 mm, terwijl 12 mm tot 14 mm als goed wordt beschouwd, 5 mm tot 11 mm als redelijk en minder dan 4 mm als slecht.5
De bovenste ooglidplooi is de verbinding van de levator aponeurosis met de orbicularis spier die erboven ligt. Het gebied van de bovenste ooglidrand in downgaze tot de ooglidplooi meet normaal ongeveer 8 mm bij mannen en 9 tot 10 mm bij vrouwen, hoewel het kan variëren per ras.10 Bij patiënten met congenitale en myogene ptosis, is de bovenste ooglidplooi vaak afwezig of subtiel. Terwijl bij patiënten met aponeurotische ptosis de bovenste ooglidplooi veel hoger ligt.11
De palpebrale fissuur is eenvoudigweg de breedste afstand tussen de bovenste en onderste ooglidranden in primaire oogopslag en geeft een algemene vergelijking van relatieve ptosis. De gemiddelde waarden liggen tussen 8mm en 11mm.10
Acquired Ptosis Classification
Na het uitvoeren van een onderzoek, is de volgende stap het classificeren van de presentatie van uw patiënt. Gebaseerd op etiologie, kan ptosis worden geclassificeerd als aponeurotisch, myogeen, neurogeen, mechanisch of traumatisch. Er kan echter ook sprake zijn van pseudoptosis, wat een ooglid beschrijft dat ptotisch lijkt als gevolg van structurele veranderingen die indirect de positie van het ooglid beïnvloeden.
Aponeurotische ptosis is de meest voorkomende verworven ptosis. Deze ptosis wordt meestal gezien bij oudere personen, maar kan zich op elke leeftijd voordoen als gevolg van trauma, frequent wrijven van de ogen of langdurig gebruik van contactlenzen, waarbij dragers van harde lenzen een hoger risico lopen.6 De levatorfunctie is over het algemeen goed bij deze patiënten, maar de levatoraponeurosis is uitgerekt of verdund als gevolg van herhaalde stress en de effecten van zwaartekracht en veroudering.6 Jongere patiënten die deze vorm van verworven ptosis vertonen, kunnen een hogere ooglidplooi vertonen als gevolg van levator disinsertie.13 Deze patiënten reageren over het algemeen goed op chirurgische correctie.
Mechanische ptosis kan worden veroorzaakt door elke afwijking die de structuur van het ooglid verzwaart of wijzigt, met inbegrip van blepharochalasis, cellulitis, hordeolum, orbitale vetprolaps en ooglid- of orbitale tumoren. Littekenvorming door ontsteking, chirurgie, Stevens-Johnson syndroom of oculair pemphigoid kan ook leiden tot mechanische ptosis.6 Verricht altijd orbitale beeldvorming bij patiënten met een onderliggende massa of infiltratieve laesie. Het aanpakken van de oorzakelijke factoren is de initiële beheersstrategie bij deze patiënten.
Traumatische ptosis kan ontstaan als gevolg van elk trauma aan de orbit. De oorzaken kunnen zijn disinsertie van de levator spier of beschadiging van de levator pees met littekenvorming. Een andere mogelijkheid is beschadiging van de CN III die tot ptosis kan leiden.6,14 In ernstige gevallen die resulteren in aanzienlijke beschadiging van de levator, kunnen patiënten meerdere operaties nodig hebben met weinig kans op herstel van de natuurlijke ooglidsymmetrie.6,14 Patiënten met een verhoogd risico op betrokkenheid van de CN III zijn onder andere patiënten met hoofdletsel, posttraumatische sinus cavernosetrombose, orbitale apex fracturen en zenuwcompressie door vreemde voorwerpen.14 Patiënten met schade aan de CN III-zenuw zullen na verloop van tijd vanzelf genezen en moeten worden geobserveerd op spontaan herstel over een periode van drie tot zes maanden voordat chirurgische interventie wordt overwogen.6,14
Pseudoptosis kan het gevolg zijn van talrijke aandoeningen, waaronder blepharospasm, dermatochalasis met hooding, wenkbrauwptosis, microphthalmos, enophthalmos en phthisis bulbi.8 Dekselretractie in het contralaterale oog, zoals bij schildklieroogziekten, kan ook een relatieve ptotische verschijning aan het niet-aangedane oog veroorzaken.8
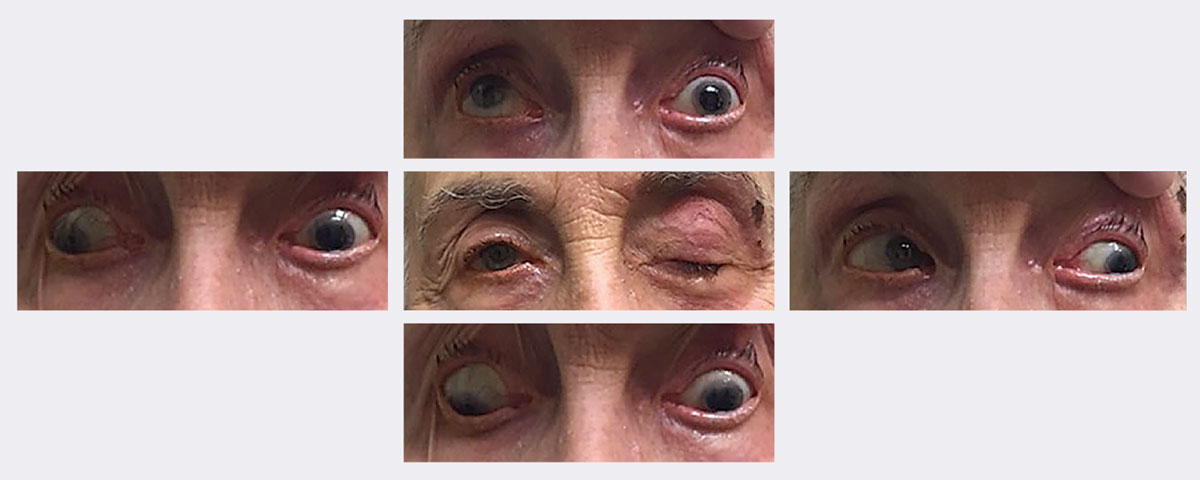
Bij het eerste bezoek van deze patiënte had ze ptosis met beperkte op- en neerwaartse blik en adductie. Uiteindelijk werd bij haar een volledige, pupilsparende linker 3e zenuwverlamming ten gevolge van herpes zoster vastgesteld. Ze herstelde in ongeveer twee weken met behulp van een antiviraal middel. Foto’s: Michael Trottini, OD. Klik op de afbeelding om te vergroten.
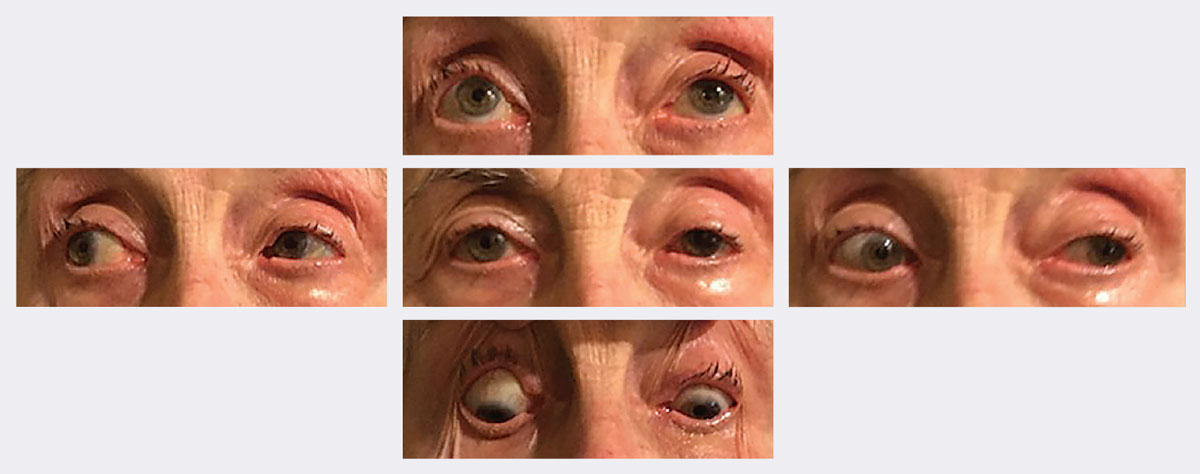
Bij de follow-up waren haar ptosis en beweeglijkheid na twee weken aanzienlijk verbeterd. Foto’s: Michael Trottini, OD. Klik op de afbeelding om te vergroten.
Neurogene ptosis
De verminderde innervatie van de spieren van het bovenste ooglid kan het gevolg zijn van een aantal mogelijke oorzaken, waarvan sommige levensbedreigend kunnen zijn. Snelle identificatie en behandeling van deze aandoeningen zijn van cruciaal belang.
De derde zenuw palsie is de meest voorkomende oorzaak van neurogene ptosis.1 Deze zenuw innerveert de superieure, inferieure en mediale rectusspieren, de inferior oblique, de levator, en de pupillaire sluitspier.15 Wanneer ptosis gepaard gaat met symptomen van diplopie of pupillaire mydriasis, moet een derde zenuw palsie worden overwogen.
Derde zenuw palsies veroorzaken dat het oog een “down-and-out” positie aanneemt met significante zwakte van elevatie, depressie en adductie bij motiliteitstesten.16 De mate van ernst van een derde zenuw palsie kan sterk variëren, afhankelijk van de oorzaak en anatomische locatie van de laesie.15
Ptosis geassocieerd met een derde zenuw palsie kan gedeeltelijk of volledig zijn. Patiënten die zich presenteren met een onvolledige derde zenuw verlamming waarbij er slechts een gedeeltelijke parese van de extraoculaire spieren is of slechts een gedeeltelijke ptosis moeten zeer nauwkeurig worden geëvalueerd op progressie naar een volledige verlamming met pupillaire mydriase. Pupillaire betrokkenheid geassocieerd met een derde zenuw verlamming is zorgwekkend voor een drukkende laesie zoals een aneurysma of neoplasma.
Bij patiënten ouder dan 50 jaar is de meest voorkomende etiologie van derde zenuwverlamming microvasculaire ischemie in aanwezigheid van cardiovasculaire risicofactoren, gevolgd door aneurysma, neoplasma, trauma, en verschillende inflammatoire en infectieuze etiologie.16 Patiënten met ptosis van de derde zenuw en pupilbetrokkenheid moeten dringend een neuro-imaging van het hoofd ondergaan om levensbedreigende aneurysma’s uit te sluiten, in het bijzonder aneurysma’s van de achterste communicerende slagader.15,16
Horner syndroom wordt gekenmerkt door unilaterale ptosis, pupillaire miosis en anhidrosis in het gezicht secundair aan onderbreking van sympathische innervatie naar het oog. De ptosis bij het syndroom van Horner is mild, meestal slechts 1 tot 2 mm, en is te wijten aan een gebrek aan innervatie van de Müellerspier in het bovenste ooglid. Ptosis bij het syndroom van Horner kan variabel zijn en kan zelfs afwezig zijn in tot 12% van de gevallen. Miosis ontstaat door verlies van sympatische tonus van de pupillaire dilatator spier. De resulterende anisocoria is meer uitgesproken in het donker en een dilatatie vertraging is vaak duidelijk binnen de eerste vijf seconden van blootstelling aan het donker.17
Horner syndroom kan het gevolg zijn van een laesie overal langs de drie-neuron oculosympathetic pathway. Bevestiging kan worden verkregen door een farmacologische test met 0,5% apraclonidine of, minder gebruikelijk, cocaïne.17,18 Een positieve apraclonidinetest zal resulteren in dilatatie van de miotische pupil als gevolg van overgevoeligheid van de irisdilatatorspier, alsmede normalisatie van de ooglidstand.1,17
Hydroxyamfetamine kan worden gebruikt om te bepalen of een laesie pre- of postganglionisch is; dit wordt in de moderne praktijk echter zelden gebruikt omdat neuroimaging gewoonlijk toch wordt besteld.17,18
Myasthenia Gravis Tests
Twee tests die gemakkelijk in de onderzoekskamer kunnen worden uitgevoerd om op myasthenia gravis te evalueren, zijn de rust- en de ijstest. Bij de rusttest moeten patiënten met ptosis hun ogen gedurende twee minuten zachtjes dichthouden. Ongeveer 50% van de patiënten met myasthenia gravis vertoont een verbetering van de ptosis van 2 mm of meer met de rusttest.1 Onderzoekers geloven dat dit gebeurt omdat de hoeveelheid ACh in de synaps zich ophoopt, waardoor de spierrespons verbetert.
De ijs-test wordt uitgevoerd door ijs op het ptotische ooglid te leggen gedurende twee minuten en dan de ptosis opnieuw te evalueren. Net als bij de rusttest is een verbetering van 2 mm of meer een positief testresultaat.1,2 Ptosis secundair aan andere oorzaken zal noch met de rusttest noch met de ijstest verbeteren.1
Labonderzoek naar AChR-antilichamen moet ook worden uitgevoerd in verdachte gevallen van myasthenie. Houd er rekening mee dat 30% tot 65% van de patiënten met zuiver oculaire myasthenia gravis seronegatief zal zijn.3,4 Studies tonen aan dat het niveau van AChR antilichamen niet correleert met de ernst van de ziekte of helpt bij het voorspellen van wie gegeneraliseerde ziekte zal ontwikkelen.3,5
De Tensilon-test is lang beschouwd als de primaire diagnostische test voor myasthenia gravis, hoewel hij tegenwoordig minder vaak wordt gebruikt dan vroeger vanwege het risico van cardiale complicaties, syncope en cholinergische crisis. De test heeft ook een hoge incidentie van vals-negatieven en vals-positieven.1
1. Kubis K, Danesh-Meyer H, Savino P, Sergott R. The ice test versus the rest test in myasthenia gravis. Ophthalmol. 2000;107(11):1995-8.
2. Ellis F, Hoyt C, Ellis F, et al. Extraocular muscle responses to orbital cooling (ice test) for ocular myasthenia gravis diagnosis. J AAPOS Off Publ Am Associatr Ophthalmol Strabismus. 2000;4(5):271-81.
3. Monsul N, Patwa H, Knorr A, et al. The effect of prednisone on the progression from ocular to generalized myasthenia gravis. J Neurol Sci. 2004;217(2):131-3.
4. Porter N, Salter B. Oculaire myasthenia gravis. Curr Treat Options Neurol. 2005;7(1):79-88.
5. Kupersmith MJ. Ocular myasthenia gravis: treatment successes and failures in patients with long-term follow-up. J Neurol. 2009;256(8):1314-20.
Emergente beeldvorming voor volwassenen is niet nodig, tenzij het syndroom van Horner zich acuut met pijn presenteert. In recente studies wordt gesteld dat bij patiënten met een nieuw, geïsoleerd Horner-syndroom zonder lokaliserende tekenen of symptomen, de beeldvorming zich moet richten op de gehele oculosympathische route met behulp van MRI en angiografie, omdat er zoveel mogelijke etiologieën zijn. Een oorzakelijk letsel wordt typisch geïdentificeerd in 20% van de gevallen, de meest voorkomende is dissectie van de halsslagader, die spontaan of secundair aan trauma kan optreden.
Myasthenia gravis is een zeldzame aandoening die wordt gekenmerkt door een door antilichamen gemedieerde immuunaanval op de nicotine acetylcholine receptor (AChR).19 Bij tot 65% van de patiënten omvatten de eerste tekenen en symptomen van myasthenia gravis ptosis, extraoculaire spierzwakte, zwakte van de orbicularis oculi of oculaire scheefstand.20 Alle symptomen kunnen zich unilateraal of bilateraal voordoen en zijn meestal recurrent en variabel met progressieve verslechtering door vermoeidheid. Typisch is dat meer dan 90% van de patiënten tijdens het beloop van de ziekte enkele of al deze symptomen in enige mate zal ervaren.21,22 Zuiver oculaire myasthenia gravis komt bij ongeveer 50% voor.21 Ongeveer de helft zal binnen twee jaar overgaan tot gegeneraliseerde ziekte.23-25
Alle patiënten bij wie myasthenia is bevestigd of zelfs wordt vermoed, moeten ook een CT-beeldvorming ondergaan om te evalueren op thymische hyperplasie of thymoma.21 Thymoma komt voor bij ongeveer 10% tot 15% van de patiënten met myasthenia en vereist chirurgische resectie.26
Myogene ptosis
Deze meest voorkomende congenitale ptosis kan zowel verworven als congenitaal zijn en is het gevolg van dysgenese van de levatorspier waarbij fibroadiposeweefsel wordt aangetroffen in plaats van skeletspiervezels.6 Verworven myogene ptosis beschrijft een zeldzame vorm van typisch bilaterale progressieve ptosis, veroorzaakt door systemische spierfunctiestoornissen.6,27,28 Het kan gaan om spierdystrofie, myasthenia gravis (eerder besproken), oculofaryngeale dystrofie en chronische progressieve externe oftalmoplegie (CPEO).6 Minder vaak zijn steroïd-geïnduceerde en HAART-geassocieerde myogene ptosis gerapporteerd.27,28
Myotone dystrofie is de meest voorkomende vorm van volwassen verouderde spierdystrofie. Oculaire bevindingen omvatten symmetrische ptosis, blepharospasme, oftalmoplegie, en kerstboom cataracten. Myotonie (vertraagde ontspanning van de skeletspier na contractie) is vaak het eerste symptoom; daarom kan de diagnose gesteld worden voordat de oogsymptomen optreden. Getroffen patiënten kunnen zich ook presenteren met vroegtijdige frontale alopecia, verslapping van de slaap- en kauwspieren en zwakte van de distale ledematen, verergerd door kou, opwinding of vermoeidheid.29,30 Ademhalingsaandoeningen en cardiale myopathie zijn de meest voorkomende doodsoorzaken.30
Myogene ptosis kan worden gecorrigeerd met een ooglidkruk of een operatie; wees echter voorzichtig bij het aanbevelen van een van beide, omdat deze patiënten een hoger risico hebben op postoperatieve droge oogziekte en blootstelling keratopathie als gevolg van slechte Bell’s fenomeen en onvolledig knipperen.31,32
Wanneer een patiënt zich presenteert met ptosis, zijn een grondige anamnese en klinisch onderzoek van cruciaal belang om te bepalen wanneer verdere work-up of doorverwijzing nodig is, aangezien ptosis het eerste presenterende symptoom kan zijn van een aantal potentieel fatale medische aandoeningen.
Als een algemene klinische parel, telkens wanneer ptosis, pupilafwijking, extraoculaire motiliteitsstoornis, asymmetrie van de oogbol of dystopie wordt waargenomen bij klinisch onderzoek, is een grondige evaluatie van elk gerechtvaardigd omdat zij aanwijzingen kunnen geven voor gelijktijdige ziekte.8,33 Afhankelijk van de etiologie, zullen sommige gevallen van ptosis spontaan verdwijnen, andere zullen behandeling van systemische ziekte vereisen, en sommige zullen een operatie vereisen. Zoals bij elke ingreep kunnen postoperatieve complicaties optreden, met inbegrip van, maar niet beperkt tot ondercorrectie, overcorrectie resulterend in lagophthalmos en droog oog, afwijkingen aan de ooglidplooi en vervorming van de ooglidrand.
Optometristen moeten zich bewust zijn van mogelijke etiologieën en kunnen onderscheiden wanneer ptosis presentatie een spoedeisende situatie is die snel diagnostisch onderzoek, behandeling en verwijzing vereist.
Drs. Reinhard en Spampinato zijn optometristen aan het Cincinnati Veteran’s Administration Medical Center en adjunct-faculteitsleden aan het Ohio State University College of Optometry.
1. Díaz-Manera J, Luna S, Roig C. Oculaire ptosis: differentiële diagnose en behandeling. Curr Opin Neurol. 2018;31(5):618-627.
2. Oyster CW. The Human Eye: Structure and Function. Sunderland, MA: Sinauer Associates; 2006.
3. Remington, L.A. Clinical Anatomy of the Visual System (Second Edition). Butterworth-Heinemann; 2005.
4. Ezra DG, Beaconsfield M, Collin R. Surgical anatomy of the upper eyelid: old controversies, new concepts. Expert Rev Ophthalmol. 2009;4(1):47-57.
5. Pauly M, Sruthi R. (2019). Ptosis: Evaluatie en beheer. Kerala J Ophthalmol. 2019;31(1);11-16.
6. Finsterer J. Ptosis: causes, presentation, and management. Aesthetic Plast Surg. 2003;27(3):193-204.
7. Iliff JW, Pacheco EM. Duane’s Clinical Ophthalmology. (Tasman W, Jaeger E, ed.). Lippincott Williams and Wilkins; 2001.
8. Latting MW, Huggins AB, Marx DP, Giacometti JN. Klinische evaluatie van blepharoptosis: het onderscheiden van leeftijdsgerelateerde ptosis van masquerade condities. Semin Plast Surg. 2017;31(1):5-16.
9. Putterman AM. Marge reflex distance (MRD) 1, 2, en 3: Ophthal Plast Reconstr Surg. 2012;28(4):308-11.
10. Yadegari S. Benadering van een patiënt met blepharoptosis. Neurol Sci. 2016;37(10):1589-96.
11. Lim J, Hou J, Singa R, et al. Relatieve incidentie van blepharoptosis subtypes in een oculoplastische praktijk in een tertiair zorgcentrum. Orbit. 2013;32(4):231-4.
12. Burkat C, Oh D, Yen M. Marge to reflex distance 1,2,3. Eyewiki. eyewiki.aao.org/Margin_to_reflex_distance_1,2,3. 16 september 2019. Accessed March 13, 2020.
13. Savar A, Blaydon S, Nakra T, Shore J. Ptosis surgery: In: Tasman W, Jaeger E eds. Duane’s Oogheelkunde. Pennsylvania: Lippincott Williams & Wilkins; 2013.
14. Jacobs SM, Tyring AJ, Amadi AJ. Traumatische ptosis: evaluatie van etiologie, management en prognose. J Ophthalmic Vis Res. 2018;13(4):447-52.
15. Bhatti MT, Eisenschenk S, Roper SN, Guy JR. Superior divisional third cranial nerve paresis: klinische en anatomische observaties van 2 unieke gevallen. Arch Neurol. 2006;63(5):771-6.
16. Kung N, Stavern GPV. Geïsoleerde oculaire motorische zenuwverlammingen. Semin Neurol. 2015;35(05):539-48.
17. Martin TJ. Horner syndroom: een klinisch overzicht. ACS Chem Neurosci. 2018;9(2):177-186.
18. Beebe J, Kardon R, Thurtell M. The yield of diagnostic imaging in patients with isolated Horner syndrome. Neurol Clin. 2017;35(1):145-51.
19. McGrogan A, Sneddon S, Vries CS de. De incidentie van myasthenia gravis: een systematisch literatuuronderzoek. Neuroepidemiologie. 2010;34(3):171-83.
20. Kupersmith MJ. Ocular myasthenia gravis: treatment successes and failures in patients with long-term follow-up. J Neurol. 2009;256(8):1314-20.
21. Gilbert ME, Savino PJ. Oculaire myasthenia gravis. Int Ophthalmol Clin. 2007;47(4):93-103.
22. Antonio-Santos AA, Eggenberger ER. Medical treatment options for ocular myasthenia gravis. Curr Opin Ophthalmol. 2008;19(6):468-478.
23. Porter NC, Salter BC. Ocular myasthenia gravis. Curr Treat Options Neurol. 2005;7(1):79-88.
24. Gilbert M, De Sousa E, Savino P. Ocular myasthenia gravis treatment: the case against prednisone therapy and thymectomy. Arch Neurol. Dec 2007 (64):1790-2.
25. Kumar V, Kaminski HJ. Behandeling van Myasthenia Gravis. Curr Neurol Neurosci Rep. 2011;11(1):89-96.
26. Silvestri N, Wolfe G. Myasthenia Gravis. Semin Neurol. 2012;32(03):215-226.
27. Song A, Carter K, Nerad J, et al. Steroid-induced ptosis: case studies and histopathologic analysis. Eye. 2008;22(4):491-5.
28. Silkis R, Lee H, Gills Ray V. Highly Active Antiretroviral Therapy-Associated Ptosis in Patients With Human Immunodeficiency Virus. Arch Ophthalmol. 2009;127(3):345-6.
27. Kubis KC, Danesh-Meyer HV, Savino PJ, Sergott RC. The ice test versus the rest test in myasthenia gravis. Ophthalmol. 2000;107(11):1995-8.
28. Ellis F, Hoyt C, Ellis F, et al. Extraocular muscle responses to orbital cooling (ice test) for ocular myasthenia gravis diagnosis. J AAPOS. 2000;4(5):271-81.
29. Nguyen C, Campbell C. Myotone dystrofie type 1. CMAJ Can Med Assoc J. 2016;188(14):1033.
30. Thornton CA. Myotone dystrofie. Neurol Clin. 2014;32(3):705-19.
31. de Castro FAA, Cruz AAV, Sobreira CF da R. Brow Motility in Mitochondrial Myopathy: Ophthal Plast Reconstr Surg. 2010;26(6):416-9.
32. Daut P, Steinemann T, Westfall C. Chronic exposure keratopathy complicating surgical correction of ptosis in patients with chronic progressive external ophthalmoplegia. Am J Ophthalmol. 2000;130(4):519-21.
33. Murchison AP, Bilyk JR, Savino PJ. Ptosis bij neurologische aandoeningen. In:Black E, Nesi F, Calvano C, et al, eds. Smith and Nesi’s Ophthalmic Plastic and Reconstructive Surgery. New York, NY: Springer; 2012:361-92.