Ptosis, formelt kendt som blepharoptosis, er et almindeligt problem, der er karakteriseret ved at det øvre øjenlåg hænger ned i det primære blik. Almindeligvis er ptose blot en realitet i forbindelse med aldring, men nogle forekomster er relateret til systemiske sygdomme eller genetiske lidelser. Mens kosmos kan være den primære bekymring for nogle personer med ptose, er mere avancerede tilfælde forbundet med forstyrrelser i synsfeltet, øjenlågsbelastning, ændret hovedposition i et forsøg på at kompensere og hovedpine på grund af belastning af pande- og hovedbundsmuskler.1 Alt dette kan forringe patientens livskvalitet.
Her beskriver vi nogle af årsagerne til ptose, med vægt på erhvervede former, og vil give retningslinjer for overvågning og oparbejdning af patienter.
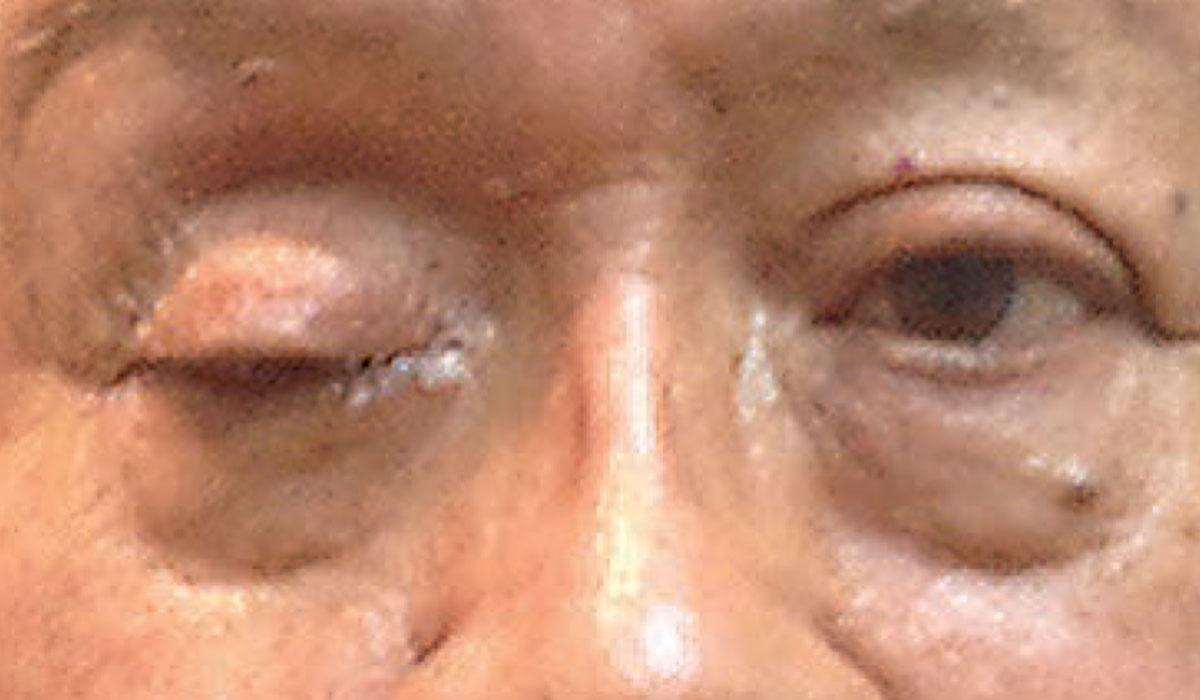
Komplet ptose kan indikere tilstedeværelsen af en akut neurologisk tilstand. Foto: Foto: Michael Trottini, OD. Klik på billedet for at forstørre.
Anatomisk forklaring
Mekanisk set er ptose forbundet med dysfunktion af de muskler, der er ansvarlige for øjenlågshævning. Disse er den overlegne palpebral levator og den overlegne tarsalmuskel, også kaldet Muller’s muskel. Tab af tonus i en af dem resulterer i ptose.2 Den overlegne palpebrale levator er imidlertid den vigtigste retraktor af det øvre øjenlåg, og derfor giver en mangel i dens funktion en mere betydelig ptose.2 Levatoren udspringer fra den lille fløj af sphenoidbenet og bliver til en vifteformet seneudvidelse, levatoraponeurosen, når den går ind i øjenlåget.2 Fibrene i aponeurosen trænger ind i orbitalseptum og strækker sig ind i det øvre øjenlåg og spreder sig ud over hele sin længde og sætter sig ind på den forreste side af tarsalpladen. Levatoren får sin innervation fra den overlegne division af kranienerve III (CN III).3
Müllers muskel udspringer fra det inferiore aspekt af levatoren, lige posteriort til fornix, og indsætter sig på den overlegne kant af tarsalpladen.4
Denne muskel er innerveret af sympatiske fibre; denervation af Mullers muskel vil kun forårsage en mild ptose på 1 mm til 2 mm.3-5
Patientvurdering
Når en person præsenterer sig med klager over ptose, er det første skridt at indhente en grundig klinisk anamnese. Dette bør omfatte en omhyggelig gennemgang af tidligere systemisk og okulær sygehistorie, eventuelle ændringer i helbred og medicinforbrug.
Erhvervet ptose i det ene øje og en motilitetsbegrænsning i det andet øje bør betragtes som myasthenia gravis indtil andet er bevist. Foto: Foto: Paul Ajamian, OD.
Erhvervet ptose i det ene øje og en motilitetsbegrænsning i det andet øje bør betragtes som myasthenia gravis indtil andet er bevist. Foto: Paul Ajamian, OD. Klik på billedet for at forstørre.
Ptose kan enten være medfødt eller erhvervet, monokulær eller binokulær og progressiv eller ikke-progressiv. Disse karakteristika bør noteres i anamnesen sammen med en undersøgelse af eventuelle tilknyttede neurologiske og oftalmiske symptomer, herunder sløret syn, diplopi, smerter, perifert felttab, hovedpine eller generaliseret muskelsvaghed. Forespørg om eventuelle traumer eller tidligere okulære operationer sammen med en historie om tidligere botulinumtoxininjektioner eller oftalmisk steroidbrug.6,7
Det er vigtigt at forstå forløbet med hensyn til varighed af ptosen, og om den er fremadskridende, aftagende eller uændret fra starten, sammen med enhver indikation af døgnvariabilitet. En akut opstået i timer eller dage før undersøgelsen giver anledning til bekymring for en alvorlig patologisk ætiologi.
Gennemgang af gamle fotografier kan altid hjælpe med at bekræfte enhver ændring, hvis patienten er en dårlig historiker.8
Klinisk undersøgelse
Evaluering af patienter med ptose omfatter mange af de standardkomponenter, der indgår i en omfattende øjenundersøgelse. Vurdering af synsstyrke og binokulært syn kan være med til at indikere en mulig forårsagende systemisk sygdom samt til at vurdere amblyopi eller misalignment. Hvis patienterne skulle gennemgå en kirurgisk korrektion af ptosen, kunne amblyopi eller phorias være tegn på potentielle fusionsproblemer. Test af pupil og ekstraokulær motilitet samt ekstern observation af globusasymmetri er afgørende for at vurdere for andre relaterede patologier, som omtales senere. Observation af patientens hovedposition og testning af synsfeltet kan hjælpe med at bestemme ptosens indvirkning og sværhedsgrad.
Kvantitative målinger af øjenlågspositionen hjælper med at vurdere retraktormusklernes funktion, identificere anatomiske abnormiteter og kan også være nyttige til at overvåge progression eller forbedring af ptosen over tid.
Primært udføres disse målinger, kaldet margin reflex distance (MRD) 1, 2 og 3, ved hjælp af en penlight rettet mod patientens øjne, mens den primære blik er rettet mod øjnene. Ved MRD1 registreres afstanden i millimeter mellem den centrale del af den øvre øjenlågsrand og pupilrefleksen for begge øjne.9-11 En normal MRD1 er 4 mm til 5 mm.5 Forskellen i MRD1 mellem det normale og det ptotiske øje er omfanget af ptose. Hvis ptosen er så betydelig, at pupillarrefleksen ikke kan visualiseres, registreres den afstand i millimeter, som øjenlåget skal løftes, indtil pupillarrefleksen kan ses, som MRD1 i negative tal.9
MRD2 adskiller sig ved at måle i det primære blik, fra den corneale lysrefleks til den centrale del af det nedre øjenlåg.12 MRD3 bestemmer, hvor meget levator der skal resekteres hos patienter med med medfødt ptose, som har en vertikal strabismus i forbindelse med ptose, og hos hvem strabismokirurgi ikke er indiceret.12
Levatorfunktionen kan måles ved at bestemme den samlede bevægelse i millimeter af det øvre øjenlåg fra nedadrettet blik til opadrettet blik. Denne måling er vigtig for kirurgen, når han skal bestemme den mest hensigtsmæssige korrigerende procedure. Normal levatorfunktion er typisk større end 15 mm, mens 12 mm til 14 mm betragtes som god, 5 mm til 11 mm betragtes som rimelig, og alt mindre end 4 mm er dårligt.5
Den øvre øjenlågsfold repræsenterer sammenføjningen af levatoraponeurosen med den overliggende orbicularis-muskel. Området fra den øvre øjenlågsrand i downgaze til øjenlågsfolden måler normalt ca. 8 mm hos mænd og 9 mm til 10 mm hos kvinder, selv om det kan variere alt efter race.10 Hos patienter med medfødt og myogen ptose er den øvre øjenlågsfolde ofte fraværende eller ubetydelig. Mens den øvre øjenlågsfisse hos patienter med aponeurotisk ptose er placeret meget højere.11
Den palpebrale fissur er simpelthen den bredeste afstand mellem den øvre og nedre øjenlågsrand i det primære blik og giver en samlet sammenligning af den relative ptose. Gennemsnitsværdierne ligger mellem 8 mm og 11 mm.10
Klassifikation af erhvervet ptose
Når du har foretaget en undersøgelse, er det næste skridt at klassificere din patients præsentation. Baseret på ætiologi kan ptose klassificeres som aponeurotisk, myogenisk, neurogenisk, mekanisk eller traumatisk. De kan dog også have noget, der kaldes pseudoptose, som beskriver et øjenlåg, der ser ptotisk ud på grund af strukturelle ændringer, der indirekte påvirker lågets position.
Aponeurotisk ptose er den mest almindelige erhvervede ptose. Den ses typisk hos ældre personer, men kan forekomme i alle aldre som følge af traumer, hyppig gnidning af øjnene eller langvarig brug af kontaktlinser, hvor bærere af hårde linser har større risiko.6 Levatorfunktionen er generelt god hos disse patienter, men levatoraponeurosen er strakt eller udtyndet på grund af gentagen stress og virkninger af tyngdekraften og aldring.6 Yngre patienter, der udviser denne form for erhvervet ptose, kan udvise en højere øjenlågsfoldning på grund af levatorafsættelse.13 Disse patienter reagerer generelt godt på kirurgisk korrektion.
Mekanisk ptose kan forårsages af enhver abnormitet, der tynger eller ændrer strukturen af øjenlåget, herunder blepharochalasis, cellulitis, hordeolum, orbital fedtprolaps og tumorer i øjenlåget eller orbita. Ardannelse fra inflammation, kirurgi, Stevens-Johnsons syndrom eller okulær pemphigoid kan også føre til mekanisk ptose.6 Der skal altid udføres orbital billeddannelse hos patienter med en underliggende masse eller infiltrativ læsion. Den indledende behandlingsstrategi hos disse patienter er at behandle de forårsagende faktorer.
Traumatisk ptose kan udvikles som følge af ethvert traume mod orbita. Årsagerne kan omfatte disinsertion af levatormusklen eller beskadigelse af levatorsenen med ardannelse. Alternativt kan CN III-skader også få skader, der fører til ptosen.6,14 I alvorlige tilfælde, der resulterer i betydelige skader på levatoren, kan patienterne kræve flere operationer med ringe sandsynlighed for at genoprette den naturlige øjenlågssymmetri.6,14 Patienter, der har en øget risiko for CN III-involvering, omfatter patienter med hovedskader, posttraumatisk sinus cavernosus-trombose, orbitalspidsfrakturer og nervekompression af fremmedlegemer.14 Patienter med CN III-skader vil typisk forsvinde af sig selv med tiden og bør observeres for spontan bedring over en periode på tre til seks måneder, før man overvejer kirurgisk indgreb.6,14
Pseudoptose kan skyldes mange tilstande, herunder blefarospasme, dermatochalasis med hætte, ptose af pande, mikrophthalmos, enophthalmos og phthisis bulbi.8 Lågtilbagetrækning i det kontralaterale øje, som ved sygdom i skjoldbruskkirteløjet, kan også forårsage et relativt ptotisk udseende på det upåvirkede øje.8
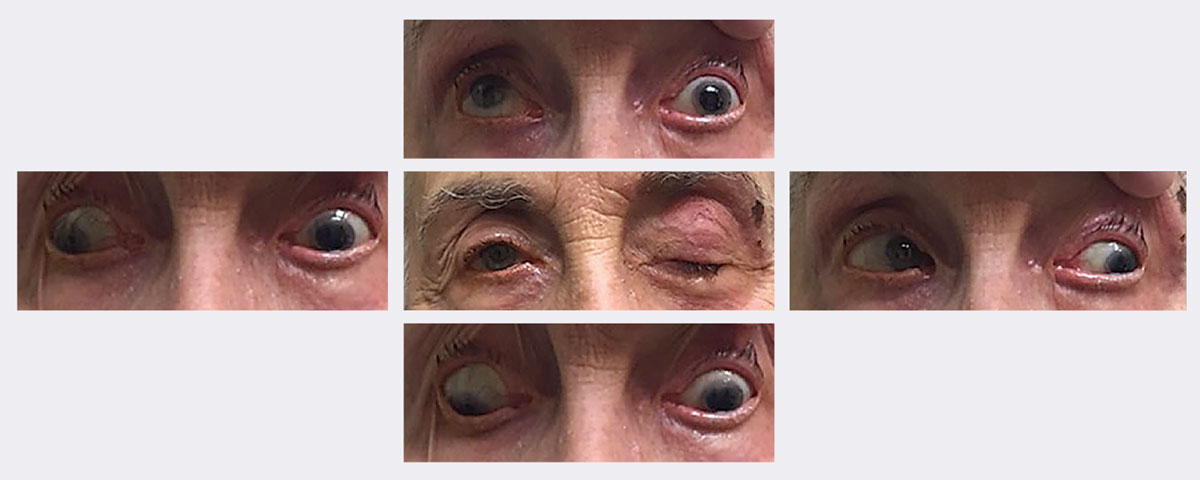
Ved denne patients første besøg havde hun ptose med begrænset op- og nedblik og adduktion. Hun blev i sidste ende diagnosticeret med en komplet, pupilsparende lammelse af venstre 3. nerve sekundært til herpes zoster. Hun blev rask i løbet af ca. to uger ved hjælp af et antiviralt middel. Billeder: Michael Trottini, OD. Klik på billedet for at forstørre.
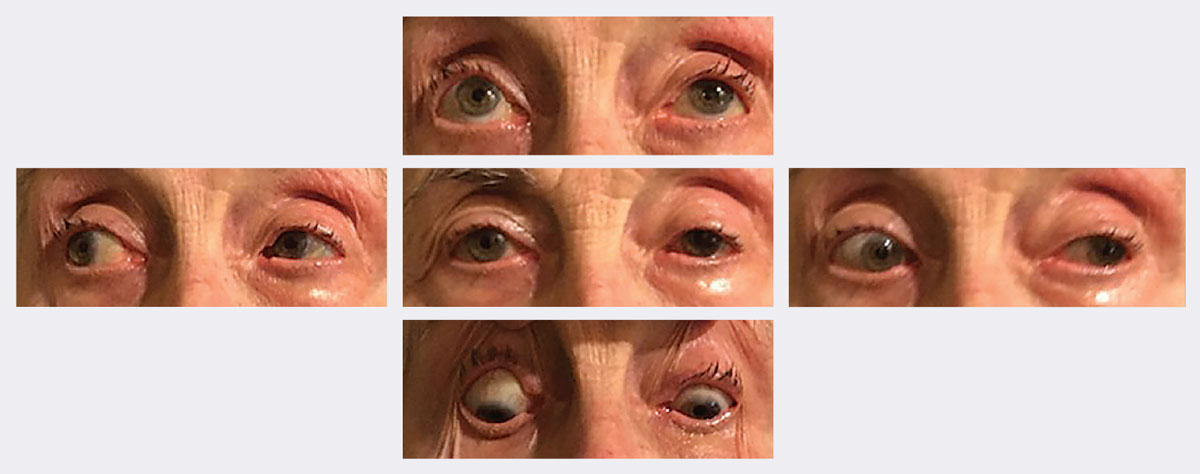
Ved opfølgningen blev hendes ptose og bevægelighed væsentligt forbedret i løbet af to uger. Fotos: Michael Trottini, OD. Klik på billedet for at forstørre.
Neurogen ptose
Denne nedsatte innervation til musklerne i det øvre øjenlåg kan stamme fra en række potentielle ætiologier, hvoraf nogle kan være livstruende. Hurtig identifikation og behandling af disse tilstande er afgørende.
Tredje nervelammelse er den mest almindelige årsag til neurogen ptose.1 Denne nerve innerverer de overlegne, inferiore og mediale rectusmuskler, den inferiore oblique, levator og pupillær sphinctermusklen.15 Når ptose ledsages af symptomer på diplopi eller pupillær mydriasis, skal en tredje nervelammelse overvejes.
Tredje nerveparese medfører, at øjet indtager en “nedadvendt” position med betydelig svaghed ved elevation, depression og adduktion ved motilitetstestning.16 Sværhedsgraden af en tredje nerveparese kan variere meget afhængigt af læsionens årsag og anatomiske placering.15
Ptose i forbindelse med en tredje nerveparese kan være delvis eller fuldstændig. Patienter, der præsenteres med en ufuldstændig tredje nerveparese, hvor der kun er delvis parese af de ekstraokulære muskler eller kun delvis ptose, bør vurderes meget nøje med henblik på progression til fuldstændig palsy med pupillær mydriasis. Pupillær involvering i forbindelse med en lammelse af tredje nerve er bekymrende for en kompressiv læsion som f.eks. et aneurisme eller en neoplasme.
I patienter over 50 år er den hyppigste ætiologi for tredje nerveparese mikrovaskulær iskæmi i tilstedeværelse af kardiovaskulære risikofaktorer, efterfulgt af aneurisme, neoplasme, traumer og forskellige inflammatoriske og infektiøse ætiologier16 . Patienter med tredje nervus palsy og pupillær involvering skal sendes til akut neuroimaging af hovedet for at udelukke livstruende aneurisme, især aneurisme i den bageste kommunikerende arterie.15,16
Horners syndrom er karakteriseret ved unilateral ptose, pupillær miosis og ansigtsanhidrose sekundært til afbrydelse af sympatisk innervation til øjet. Den ptose, der er forbundet med Horners syndrom, er mild, typisk kun 1 mm til 2 mm, og skyldes manglende innervation til Müellers muskel i det øvre øjenlåg. Ptose ved Horners syndrom kan være varierende og kan endda være fraværende i op til 12 % af tilfældene. Miosis opstår på grund af tab af sympatisk tone i pupillærdilatationsmusklen. Den resulterende anisokori er mere udtalt i mørke, og en dilatationsforsinkelse er ofte tydelig inden for de første fem sekunder efter eksponering for mørke.17
Horners syndrom kan skyldes en læsion hvor som helst langs den oculosympatiske nervevej med tre neuroner. Bekræftelse kan foretages ved farmakologisk testning med 0,5 % apraclonidin eller, mindre almindeligt, kokain.17,18 En positiv apraclonidin-test vil resultere i dilatation af den miotiske pupil på grund af overfølsomhed af irisdilatatormusklen samt normalisering af lågets stilling.1,17
Hydroxyamfetamin kan anvendes til at afgøre, om en læsion er præ- eller postganglionær; dette anvendes dog sjældent i moderne praksis, da neuroimaging typisk vil blive bestilt uanset dette.17,18
Myasthenia gravis-testning
To test, der let kan udføres i undersøgelsesrummet for at evaluere for myasthenia gravis, er hvile- og is-test. Ved hviletesten får patienter med ptose besked på at holde øjnene forsigtigt lukkede i to minutter. Ca. 50 % af patienterne med myasthenia gravis vil vise en forbedring af ptosis på 2 mm eller mere med hviletesten.1 Forskerne mener, at dette sker, fordi mængden af ACh i synapsen akkumuleres, hvilket forbedrer musklernes reaktion.
Is-testen udføres ved at placere is på det ptotiske øjenlåg i to minutter og derefter revurdere ptosen. Ligesom hviletesten er en forbedring på 2 mm eller mere et positivt testresultat.1,2 Ptose, der er sekundær til andre årsager, forbedres ikke med hverken hvile- eller istest.1
Labtest for AChR-antistoffer bør også udføres i mistænkte tilfælde af myastheni. Husk på, at mellem 30 % og 65 % af patienter med rent okulær myasthenia gravis vil være seronegative.3,4 Undersøgelser viser, at niveauet af AChR-antistoffer ikke korrelerer med sygdommens sværhedsgrad eller hjælper med at forudsige, hvem der vil udvikle generaliseret sygdom.3,5
Tensilontesten har længe været betragtet som den primære diagnostiske test for myasthenia gravis, selv om den i dag anvendes mindre hyppigt end tidligere på grund af risikoen for kardiale komplikationer, synkope og kolinerge kriser. Den har også en høj forekomst af falsk negative og falsk positive resultater.1
1. Kubis K, Danesh-Meyer H, Savino P, Sergott R. Is-testen versus hviletesten ved myasthenia gravis. Ophthalmol. 2000;107(11):1995-8.
2. Ellis F, Hoyt C, Ellis F, et al. Ekstraokulære muskelresponser på orbital afkøling (istest) til diagnosticering af okulær myasthenia gravis. J AAPOS Off Publ Am Assoc Pediatr Ophthalmol Strabismus. 2000;4(5):271-81.
3. Monsul N, Patwa H, Knorr A, et al. Effekten af prednison på udviklingen fra okulær til generaliseret myasthenia gravis. J Neurol Sci. 2004;217(2):131-3.
4. Porter N, Salter B. Ocular myasthenia gravis. Curr Treat Options Neurol. 2005;7(1):79-88.
5. Kupersmith MJ. Ocular myasthenia gravis: behandlingssucceser og -svigt hos patienter med langtidsopfølgning. J Neurol. 2009;256(8):1314-20.
Emergent billeddannelse for voksne er ikke nødvendig, medmindre Horners syndrom præsenterer sig akut med smerter. Nyere undersøgelser argumenterer for, at hos patienter med nyopstået isoleret Horners syndrom uden lokaliserende tegn eller symptomer bør billeddannelse fokusere på hele den oculosympatiske vej ved hjælp af MRT og angiografi, da de potentielle ætiologier er så mange. En forårsagende læsion identificeres typisk i 20 % af tilfældene, idet den mest almindelige er carotisdissektion, som kan opstå spontant eller sekundært efter et traume.
Andre alvorlige ætiologier, der skal udelukkes, er malignitet, vaskulære læsioner i hjernestammen og sinus cavernus trombose.1,17,18 I tilfælde af langvarigt Horners syndrom, der typisk betragtes som to år eller længere, er billeddannelse måske ikke berettiget, medmindre der opstår nye symptomer.17
Myasthenia gravis er en sjælden lidelse, der er karakteriseret ved et antistofmedieret immunangreb på den nikotiniske acetylcholinreceptor (AChR).19 Hos op til 65 % af patienterne omfatter de første tegn og symptomer på myasthenia gravis ptose, ekstraokulær muskelsvaghed, svaghed i orbicularis oculi eller øjenfejl.20 Alle symptomer kan optræde unilateralt eller bilateralt og har tendens til at være tilbagevendende og variable med progressiv forværring med træthed. Typisk vil mere end 90 % af patienterne opleve nogle eller alle disse symptomer i en eller anden grad i løbet af sygdomsforløbet.21,22 Rent okulær myasthenia gravis forekommer hos ca. 50 %.21 Ca. halvdelen vil udvikle sig til generaliseret sygdom inden for to år.23-25
Alle patienter med bekræftet eller endog mistanke om myasthenia bør også gennemgå CT-billeddannelse for at vurdere for thymisk hyperplasi eller thymom.21 Thymom forekommer hos ca. 10 % til 15 % af patienterne med myasthenia og kræver kirurgisk resektion.26
Myogen ptose
Denne mest almindelige medfødte ptose kan enten være erhvervet eller medfødt og skyldes dysgenese af levatormusklen med fibroadiposevæv fundet i stedet for skeletmuskelfibre.6 Erhvervet myogen ptose beskriver en sjælden form for typisk bilateral progressiv ptose, forårsaget af systemiske muskulære dysfunktioner.6,27,28 Dette kan omfatte muskeldystrofi, myasthenia gravis (tidligere omtalt), oculopharyngeal dystrofi og kronisk progressiv ekstern oftalmoplegi (CPEO).6 Mindre almindeligt er steroidinduceret og HAART-associeret myogen ptose blevet rapporteret.27,28
Myotonisk dystrofi er den mest almindelige form for muskeldystrofi hos voksne. De okulære fund omfatter symmetrisk ptose, blefarospasme, oftalmoplegi og juletræskatarakt. Myotoni (forsinket afslapning af skeletmuskulaturen efter sammentrækning) er ofte det første symptom; således kan de ramte personer diagnosticeres, før der opstår øjensymptomer. De ramte patienter kan også præsentere tidligt indsættende frontal alopeci, udtynding af temporal- og massetermuskler og svaghed i distale lemmer, der forværres af kulde, ophidselse eller træthed.29,30 Åndedrætssygdomme og kardiel myopati er de hyppigste dødsårsager.30
Myogen ptose kan korrigeres med en øjenlågskrue eller operation; man skal dog være forsigtig, når man anbefaler en af disse, da disse patienter har en højere risiko for postoperativ tør øjensygdom og eksponeringskeratopati på grund af dårligt Bell-fænomen og ufuldstændigt blink.31,32
Når en patient præsenterer sig med ptose, er en grundig anamnese og klinisk undersøgelse afgørende for at afgøre, hvornår yderligere udredning eller henvisning er nødvendig, da ptose kan være det første symptom på en række potentielt fatale medicinske tilstande.
Som en generel klinisk perle gælder det, at hver gang ptose, pupillær anomali, ekstraokulær motilitetsdysfunktion, globeasymmetri eller dystopi påvises ved klinisk undersøgelse, er det berettiget at foretage en grundig evaluering af hver enkelt, da de kan give ledetråde til samtidige sygdomme.8,33 Afhængigt af ætiologien vil nogle tilfælde af ptose forsvinde spontant, andre vil kræve behandling af systemisk sygdom, og nogle vil kræve kirurgi. Som ved enhver procedure kan der opstå postoperative komplikationer, herunder, men ikke begrænset til, underkorrektion, overkorrektion, der resulterer i lagophthalmos og tørre øjne, abnormiteter i øjenlågsfolden og forvrængning af øjenlågsranden.
Optometrister skal have en bevidsthed om potentielle ætiologier og evnen til at skelne, hvornår ptosepræsentation er en akut situation, der kræver hurtig diagnostisk testning, behandling og henvisning.
Dr. Reinhard og Spampinato er optometrister ved Cincinnati Veteran’s Administration Medical Center og adjungerede fakultetsmedlemmer ved Ohio State University College of Optometry.
1. Díaz-Manera J, Luna S, Roig C. Ocular ptosis: differentialdiagnose og behandling. Curr Opin Neurol. 2018;31(5):618-627.
2. Oyster CW. Det menneskelige øje: Struktur og funktion. Sunderland, MA: Sinauer Associates; 2006.
3. Remington, L.A. Clinical Anatomy of the Visual System (Second Edition). Butterworth-Heinemann; 2005.
4. Ezra DG, Beaconsfield M, Collin R. Surgical anatomy of the upper eyelid: old controversies, new concepts. Expert Rev Ophthalmol. 2009;4(1):47-57.
5. Pauly M, Sruthi R. (2019). Ptosis: Evaluering og håndtering. Kerala J Ophthalmol. 2019;31(1);11-16.
6. Finsterer J. Ptosis: årsager, præsentation og håndtering. Aesthetic Plast Surg. 2003;27(3):193-204.
7. Iliff JW, Pacheco EM. Duane’s Clinical Ophthalmology. (Tasman W, Jaeger E, red.). Lippincott Williams and Wilkins; 2001.
8. Latting MW, Huggins AB, Huggins AB, Marx DP, Giacometti JN. Klinisk evaluering af blefaroptose: skelnen mellem aldersrelateret ptose og masketilstande. Semin Plast Surg. 2017;31(1):5-16.
9. Putterman AM. Margin reflex distance (MRD) 1, 2 og 3: Ophthal Plast Reconstr Surg. 2012;28(4):308-11.
10. Yadegari S. Tilgang til en patient med blepharoptose. Neurol Sci. 2016;37(10):1589-96.
11. Lim J, Hou J, Singa R, et al. Relativ forekomst af blefaroptose-subtyper i en oculoplastisk praksis på et tertiært behandlingscenter. Orbit. 2013;32(4):231-4.
12. Burkat C, Oh D, Yen M. Margin til refleksafstand 1,2,3. Eyewiki. eyewiki.aao.org/Margin_to_reflex_distance_1,2,3. September 16, 2019. Tilgået 13. marts 2020.
13. Savar A, Blaydon S, Nakra T, Shore J. Ptosekirurgi: In: Tasman W, Jaeger E eds. Duane’s Ophthalmology. Pennsylvania: Lippincott Williams & Wilkins; 2013.
14. Jacobs SM, Tyring AJ, Amadi AJ. Traumatisk ptose: evaluering af ætiologi, håndtering og prognose. J Ophthalmic Vis Res. 2018;13(4):447-52.
15. Bhatti MT, Eisenschenk S, Roper SN, Roper SN, Guy JR. Superior divisional tredje kranienerveparese: kliniske og anatomiske observationer af 2 unikke tilfælde. Arch Neurol. 2006;63(5):771-6.
16. Kung N, Stavern GPV. Isolerede okulære motoriske nerveforlammelser. Semin Neurol. 2015;35(05):539-48.
17. Martin TJ. Horners syndrom: en klinisk gennemgang. ACS Chem Neurosci. 2018;9(2):177-186.
18. Beebe J, Kardon R, Thurtell M. Udbyttet af diagnostisk billeddannelse hos patienter med isoleret Horner-syndrom. Neurol Clin. 2017;35(1):145-51.
19. McGrogan A, Sneddon S, Vries CS de. Forekomsten af myasthenia gravis: en systematisk litteraturgennemgang. Neuroepidemiologi. 2010;34(3):171-83.
20. Kupersmith MJ. Ocular myasthenia gravis: behandlingssucceser og -svigt hos patienter med langtidsopfølgning. J Neurol. 2009;256(8):1314-20.
21. Gilbert ME, Savino PJ. Ocular myasthenia gravis. Int Ophthalmol Clin. 2007;47(4):93-103.
22. Antonio-Santos AA, Eggenberger ER. Medicinske behandlingsmuligheder for okulær myasthenia gravis. Curr Opin Ophthalmol. 2008;19(6):468-478.
23. Porter NC, Salter BC. Ocular myasthenia gravis. Curr Treat Options Neurol. 2005;7(1):79-88.
24. Gilbert M, De Sousa E, Savino P. Ocular myasthenia gravis treatment: the case against prednison therapy and thymectomy. Arch Neurol. Dec 2007 (64):1790-2.
25. Kumar V, Kaminski HJ. Behandling af myasthenia gravis. Curr Neurol Neurosci Rep. 2011;11(1):89-96.
26. Silvestri N, Wolfe G. Myasthenia Gravis. Semin Neurol. 2012;32(03):215-226.
27. Song A, Carter K, Nerad J, et al. Steroidinduceret ptose: casestudier og histopatologisk analyse. Eye. 2008;22(4):491-5.
28. Silkis R, Lee H, Lee H, Gills Ray V. Highly Active Antiretroviral Therapy-Associated Ptosis in Patients With Human Immunodeficiency Virus (højaktiv antiretroviral terapi associeret ptose hos patienter med humant immundefektvirus). Arch Ophthalmol. 2009;127(3):345-6.
27. Kubis KC, Danesh-Meyer HV, Savino PJ, Sergott RC. The ice test versus the rest test in myasthenia gravis. Ophthalmol. 2000;107(11):1995-8.
28. Ellis F, Hoyt C, Ellis F, et al. Ekstraokulære muskelresponser på orbital afkøling (isprøve) til diagnosticering af okulær myasthenia gravis. J AAPOS. 2000;4(5):271-81.
29. Nguyen C, Campbell C. Myotonisk dystrofi type 1. CMAJ Can Med Assoc J. 2016;188(14):1033.
30. Thornton CA. Myotonisk dystrofi. Neurol Clin. 2014;32(3):705-19.
31. de Castro FAA, Cruz AAV, Sobreira CF da R. Brow Motility in Mitochondrial Myopathy: Ophthal Plast Reconstr Surg. 2010;26(6):416-9.
32. Daut P, Steinemann T, Westfall C. Chronic exposure keratopathy complicating surgical correction of ptosis in patients with chronic progressive external ophthalmoplegia. Am J Ophthalmol. 2000;130(4):519-21.
33. Murchison AP, Bilyk JR, Savino PJ. Ptose ved neurologisk sygdom. I: Black E, Nesi F, Calvano C, et al, eds. Smith and Nesi’s Ophthalmic Plastic and Reconstructive Surgery (Smith og Nesi’s Ophthalmic Plastic and Reconstructive Surgery). New York, NY: Springer; 2012:361-92.