Le ptosis, officiellement connu sous le nom de blépharoptose, est une constatation courante caractérisée par une chute de la paupière supérieure dans le regard primaire. Le plus souvent, le ptosis est simplement une réalité du vieillissement, mais certaines occurrences sont liées à des maladies systémiques ou à des troubles génétiques. Alors que le cosmétique peut être la principale préoccupation de certaines personnes atteintes de ptose, les cas plus avancés sont associés à une perturbation du champ visuel, à une tension des paupières, à une modification de la position de la tête dans un effort de compensation et à des maux de tête dus à la tension des muscles du front et du cuir chevelu.1 Tout cela peut diminuer la qualité de vie du patient.
Nous décrivons ici certaines des causes du ptosis, en mettant l’accent sur les formes acquises, et nous proposerons des directives pour le suivi et le travail des patients.
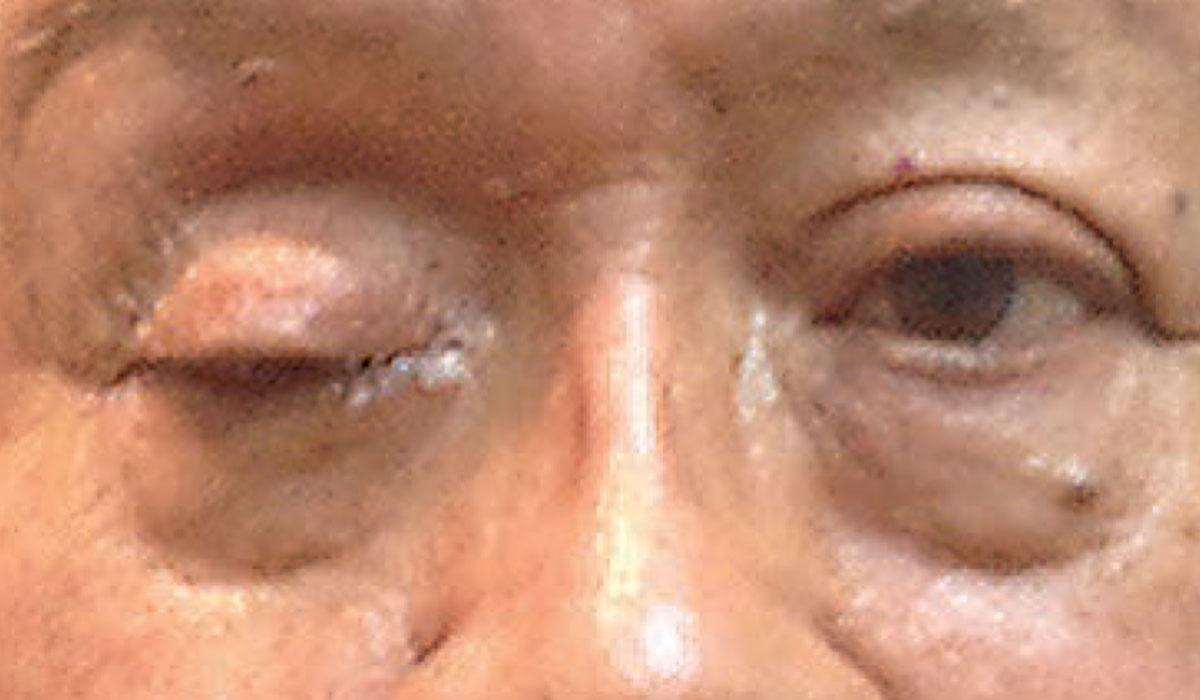
Un ptosis complet pourrait indiquer la présence d’une condition neurologique émergente. Photo : Michael Trottini, OD. Cliquez sur l’image pour l’agrandir.
Explication anatomique
Mécaniquement, le ptosis est lié à un dysfonctionnement des muscles responsables de l’élévation des paupières. Il s’agit du releveur palpébral supérieur et du muscle tarsal supérieur, également appelé muscle de Müller. Une perte de tonus dans l’un ou l’autre de ces muscles entraîne un ptosis.2 Cependant, le releveur palpébral supérieur est le principal rétracteur de la paupière supérieure et, par conséquent, une déficience de sa fonction produit un ptosis plus important.2 Le releveur naît de la petite aile de l’os sphénoïde et se transforme en une expansion tendineuse en forme d’éventail, l’aponévrose du releveur, lorsqu’il pénètre dans la paupière.2 Les fibres de l’aponévrose pénètrent dans le septum orbitaire et s’étendent dans la paupière supérieure, en éventail sur toute sa longueur et s’insèrent sur la face antérieure de la plaque tarsienne. Le levator reçoit son innervation de la division supérieure du nerf crânien III (CN III).3
Le muscle de Müller naît de la face inférieure du levator, juste en arrière du fornix, et s’insère sur le bord supérieur de la plaque tarsienne4.
Ce muscle est innervé par des fibres sympathiques ; la dénervation du muscle de Müller ne provoquera qu’une légère ptose de 1 mm à 2 mm.3-5
Évaluation du patient
Lorsqu’une personne se présente avec des plaintes de ptose, la première étape consiste à obtenir une histoire clinique approfondie. Cela devrait inclure un examen minutieux des antécédents médicaux systémiques et oculaires, de tout changement de santé et de la prise de médicaments.
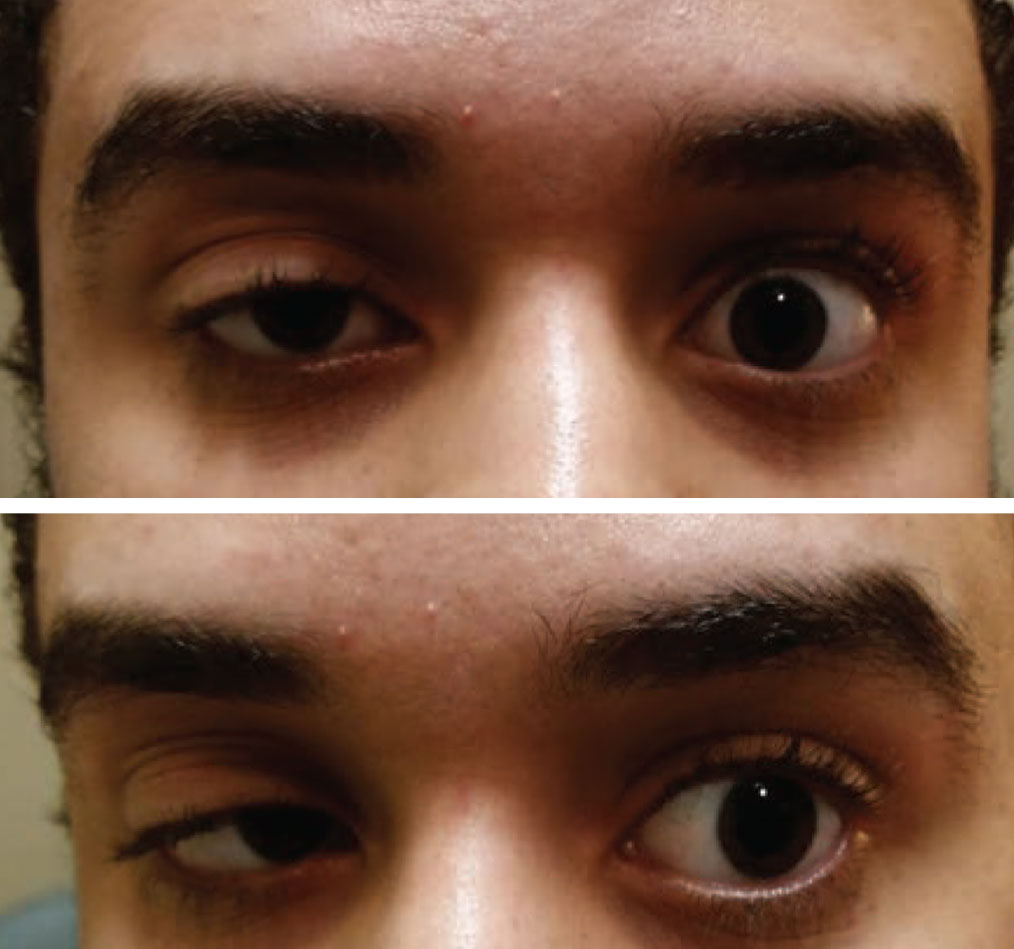
La ptose acquise d’un œil et une restriction de la motilité de l’autre doivent être considérées comme une myasthénie jusqu’à preuve du contraire. Photo : Paul Ajamian, OD. Cliquez sur l’image pour l’agrandir.
La ptose peut être congénitale ou acquise, monoculaire ou binoculaire et progressive ou non progressive. Ces caractéristiques doivent être notées dans l’anamnèse ainsi qu’une enquête sur tout symptôme neurologique et ophtalmique associé, y compris une vision floue, une diplopie, une douleur, une perte de champ périphérique, des maux de tête ou une faiblesse musculaire généralisée. Il faut s’enquérir de tout traumatisme ou de toute chirurgie oculaire antérieure, ainsi que des antécédents d’injections de toxine botulique ou d’utilisation de stéroïdes ophtalmiques.6,7
Il est important de comprendre l’évolution de la durée du ptosis et de savoir s’il progresse, s’il se résorbe ou s’il reste inchangé depuis son apparition, ainsi que toute indication de variabilité diurne. Une apparition aiguë quelques heures ou jours avant l’examen fait craindre une étiologie pathologique grave.
La révision d’anciennes photographies peut toujours aider à confirmer tout changement si le patient est un piètre historien.8
Examen clinique
L’évaluation des patients atteints de ptosis incorpore plusieurs des composantes standard d’un examen oculaire complet. L’évaluation de l’acuité visuelle et de la vision binoculaire peut aider à indiquer une éventuelle maladie systémique causale ainsi qu’à évaluer l’amblyopie ou le désalignement. Si les patients devaient subir une correction chirurgicale du ptosis, l’amblyopie ou les phorias pourraient indiquer des problèmes potentiels de fusion. Les tests de la pupille et de la motilité extra-oculaire ainsi que l’observation externe de l’asymétrie du globe sont essentiels pour évaluer d’autres pathologies connexes abordées plus loin. L’observation de la position de la tête du patient et les tests du champ visuel peuvent aider à déterminer l’impact et la gravité du ptosis.
Les mesures quantitatives de la position des paupières aident à évaluer la fonction du muscle rétracteur, à identifier les anomalies anatomiques et peuvent également être utiles pour surveiller la progression ou l’amélioration du ptosis au fil du temps.
Primairement, ces mesures, appelées distance réflexe de la marge (MRD) 1, 2 et 3, sont effectuées à l’aide d’une lampe-stylo dirigée vers les yeux du patient alors qu’il est en regard primaire. Pour la MRD1, la distance en millimètres entre la partie centrale du bord de la paupière supérieure et le réflexe pupillaire est enregistrée pour les deux yeux.9-11 Une MRD1 normale est de 4mm à 5mm.5 La différence de MRD1 entre l’œil normal et l’œil ptosé est l’importance du ptosis. Si la ptose est suffisamment importante pour que le réflexe pupillaire ne puisse être visualisé, alors la distance en millimètres que la paupière doit être soulevée jusqu’à ce que le réflexe pupillaire puisse être vu est enregistrée comme la MRD1 en nombres négatifs.9
La MRD2 diffère en ce qu’elle mesure dans le regard primaire, du réflexe lumineux cornéen à la partie centrale de la paupière inférieure.12 Le MRD3 détermine la quantité de lévateur à réséquer chez les patients atteints de ptose congénitale, qui ont un strabisme vertical associé à la ptose et chez qui la chirurgie du strabisme n’est pas indiquée.12
La fonction du lévateur peut être mesurée en déterminant le mouvement total en millimètres de la paupière supérieure du regard descendant au regard ascendant. Cette mesure est importante pour le chirurgien lorsqu’il détermine la procédure corrective la plus appropriée. Une fonction normale du lévateur est généralement supérieure à 15 mm, tandis que 12 à 14 mm est considéré comme bon, 5 à 11 mm est considéré comme moyen et tout ce qui est inférieur à 4 mm est mauvais.5
Le pli de la paupière supérieure représente la jonction de l’aponévrose du lévateur au muscle orbiculaire sus-jacent. La zone allant du bord de la paupière supérieure en position couchée jusqu’au pli de la paupière mesure normalement environ 8 mm chez les hommes et 9 à 10 mm chez les femmes, bien qu’elle puisse varier selon la race.10 Chez les patients atteints de ptosis congénital et myogénique, le pli de la paupière supérieure est souvent absent ou subtil. Alors que chez les patients atteints de ptose aponévrotique, le pli de la paupière supérieure est positionné beaucoup plus haut.11
La fente palpébrale est simplement la distance la plus large entre les bords de la paupière supérieure et inférieure dans le regard primaire et fournit une comparaison globale de la ptose relative. Les valeurs moyennes se situent entre 8mm et 11mm.10
Classification du ptosis acquis
Après avoir effectué un examen, l’étape suivante consiste à classer la présentation de votre patient. Sur la base de l’étiologie, le ptosis peut être classé comme aponévrotique, myogène, neurogène, mécanique ou traumatique. Cependant, ils peuvent également avoir quelque chose appelé pseudoptose, qui décrit une paupière qui semble ptotique en raison de changements structurels qui affectent indirectement la position de la paupière.
Le ptosis aponévrotique est le ptosis acquis le plus commun. Généralement observé chez les personnes âgées, il peut se présenter à tout âge à la suite d’un traumatisme, d’un frottement fréquent des yeux ou d’un port prolongé de lentilles de contact, les porteurs de lentilles dures étant plus à risque.6 La fonction des lévateurs est généralement bonne chez ces patients, mais l’aponévrose des lévateurs est étirée ou amincie en raison du stress répétitif et des effets de la gravité et du vieillissement6. Les patients plus jeunes présentant cette forme de ptose acquise peuvent présenter un pli de paupière plus élevé en raison de la désinsertion du lévateur.13 Ces patients répondent généralement bien à la correction chirurgicale.
La ptose mécanique peut être causée par toute anomalie qui alourdit ou modifie la structure de la paupière, notamment le blépharochalasis, la cellulite, l’hordeolum, le prolapsus de la graisse orbitaire et les tumeurs de la paupière ou de l’orbite. Les cicatrices d’une inflammation, d’une intervention chirurgicale, du syndrome de Stevens-Johnson ou d’une pemphigoïde oculaire peuvent également entraîner une ptose mécanique.6 Il faut toujours effectuer une imagerie orbitaire chez les patients présentant une masse sous-jacente ou une lésion infiltrante. La stratégie initiale de prise en charge de ces patients consiste à traiter les facteurs causaux.
La ptose traumatique peut se développer à la suite de tout traumatisme de l’orbite. Les causes peuvent inclure la désinsertion du muscle releveur ou une lésion du tendon releveur avec formation d’une cicatrice. Par ailleurs, les lésions du CN III peuvent également être à l’origine du ptosis.6,14 Dans les cas graves qui entraînent des lésions importantes du lévator, les patients peuvent avoir besoin de plusieurs interventions chirurgicales avec une faible probabilité de rétablir la symétrie naturelle de la paupière.6,14 Les patients qui présentent un risque accru d’atteinte du CN III sont ceux qui ont subi un traumatisme crânien, une thrombose post-traumatique du sinus caverneux, des fractures de l’apex orbitaire et une compression nerveuse par des corps étrangers.14 Les patients présentant une atteinte du CN III se résorberont généralement d’eux-mêmes avec le temps et il convient d’observer leur guérison spontanée sur une période de trois à six mois avant d’envisager une intervention chirurgicale.6,14
La pseudoptose peut résulter de nombreuses affections, notamment le blépharospasme, la dermatochalasis avec capuchon, la ptose sourcilière, la microphtalmie, l’énophtalmie et la phtisie bulbaire.8 La rétraction de la paupière dans l’œil controlatéral, comme dans la maladie de l’œil thyroïde, peut également provoquer un aspect ptotique relatif à l’œil non affecté.8
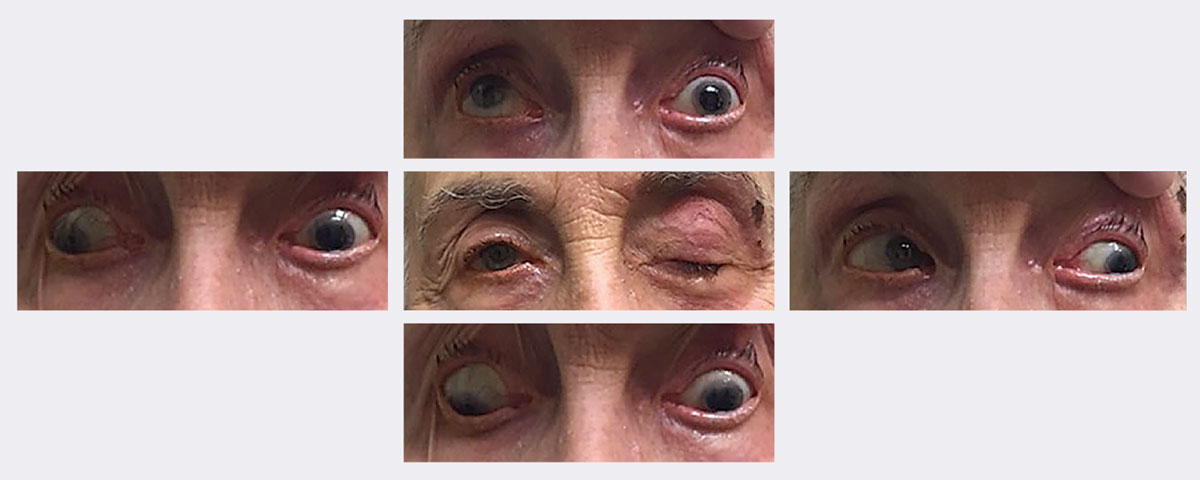
Lors de la visite initiale de cette patiente, elle présentait un ptosis avec une restriction du regard vers le haut, vers le bas et en adduction. On lui a finalement diagnostiqué une paralysie complète du 3e nerf gauche, épargnant la pupille, secondaire à un zona. Elle a guéri en deux semaines environ grâce à un antiviral. Photos : Michael Trottini, OD. Cliquez sur l’image pour l’agrandir.
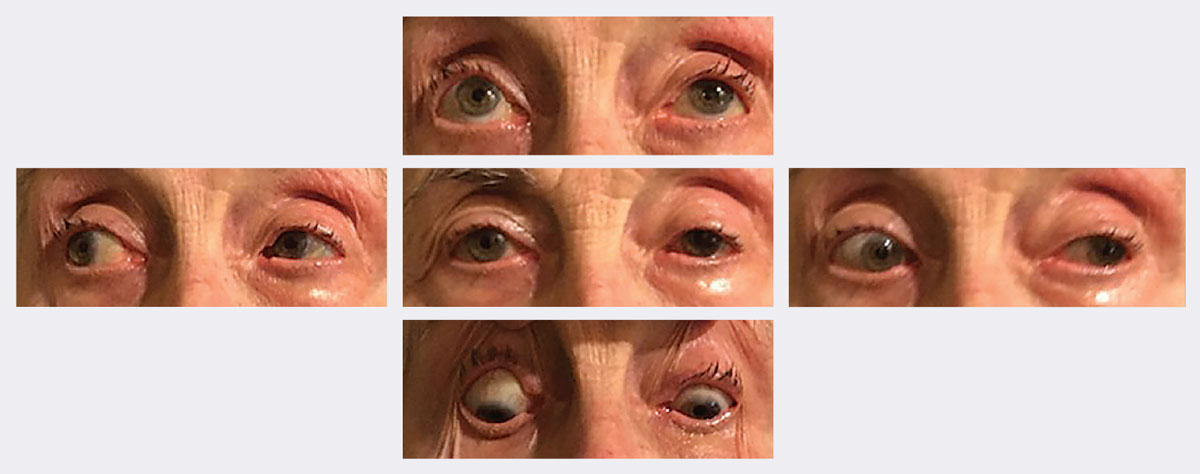
Au suivi, son ptosis et ses motilités se sont significativement améliorés en deux semaines. Photos : Michael Trottini, OD. Cliquez sur l’image pour l’agrandir.
Ptosis neurogène
Cette diminution de l’innervation des muscles de la paupière supérieure peut provenir d’un certain nombre d’étiologies potentielles, dont certaines peuvent mettre la vie en danger. L’identification et la prise en charge rapides de ces affections sont essentielles.
La paralysie du troisième nerf est la cause la plus fréquente de ptosis neurogène.1 Ce nerf innerve les muscles droits supérieur, inférieur et médial, l’oblique inférieur, le releveur et le muscle sphincter pupillaire.15 Lorsque le ptosis s’accompagne de symptômes de diplopie ou de mydriase pupillaire, il faut envisager une paralysie du troisième nerf.
Les paralysies du troisième nerf font que l’œil adopte une position « down-and-out » avec une faiblesse significative de l’élévation, de la dépression et de l’adduction lors des tests de motilité.16 Le degré de gravité d’une paralysie du troisième nerf peut varier considérablement selon la cause et la localisation anatomique de la lésion.15
Le ptosis associé à une paralysie du troisième nerf peut être partiel ou complet. Les patients présentant une paralysie incomplète du troisième nerf dans laquelle il n’y a qu’une parésie partielle des muscles extra-oculaires ou une ptose seulement partielle doivent être évalués de très près pour une évolution vers une paralysie complète avec mydriase pupillaire. Une atteinte pupillaire associée à une paralysie du troisième nerf est préoccupante pour une lésion compressive telle qu’un anévrisme ou un néoplasme.
Chez les patients de plus de 50 ans, l’étiologie la plus fréquente de la paralysie du troisième nerf est l’ischémie microvasculaire en présence de facteurs de risque cardiovasculaire, suivie par l’anévrisme, le néoplasme, le traumatisme et diverses étiologies inflammatoires et infectieuses16. Les patients présentant une paralysie du troisième nerf et une atteinte pupillaire doivent être envoyés en neuro-imagerie urgente de la tête afin d’exclure un anévrisme mettant en jeu le pronostic vital, en particulier un anévrisme de l’artère communicante postérieure.15,16
Le syndrome de Horner est caractérisé par un ptosis unilatéral, un myosis pupillaire et une anhidrose faciale secondaire à l’interruption de l’innervation sympathique de l’œil. Le ptosis associé au syndrome de Horner est léger, généralement de 1 à 2 mm, et est dû à un manque d’innervation du muscle de Müeller dans la paupière supérieure. Le ptosis dans le syndrome de Horner peut être variable et peut même être absent dans jusqu’à 12 % des cas. Le myosis est dû à la perte du tonus sympathique du muscle dilatateur des pupilles. L’anisocorie qui en résulte est plus prononcée dans l’obscurité et un retard de dilatation est souvent évident dans les cinq premières secondes d’exposition à l’obscurité.17
Le syndrome de Horner peut résulter d’une lésion n’importe où le long de la voie oculosympathique à trois neurones. La confirmation peut être faite par un test pharmacologique avec de l’apraclonidine à 0,5 % ou, plus rarement, de la cocaïne.17,18 Un test positif à l’apraclonidine entraînera une dilatation de la pupille myotique due à une hypersensibilité du muscle dilatateur de l’iris ainsi qu’une normalisation de la position des paupières.1,17
L’hydroxyamphétamine peut être utilisée pour déterminer si une lésion est pré- ou postganglionnaire ; cependant, elle est rarement utilisée dans la pratique moderne puisque la neuro-imagerie sera généralement demandée quoi qu’il en soit.17,18
Tests de myasthénie grave
Deux tests qui peuvent facilement être effectués dans la salle d’examen pour évaluer la myasthénie grave sont les tests de repos et de glace. Pour le test de repos, on demande aux patients atteints de ptose de garder les yeux doucement fermés pendant deux minutes. Environ 50 % des patients atteints de myasthénie présenteront une amélioration de la ptose de 2 mm ou plus avec le test de repos.1 Les chercheurs pensent que cela se produit parce que la quantité d’ACh à l’intérieur de la synapse s’accumule, améliorant la réponse musculaire.
Le test de la glace est effectué en plaçant de la glace sur la paupière ptosée pendant deux minutes, puis en réévaluant le ptosis. Comme pour le test de repos, une amélioration de 2 mm ou plus est un résultat positif.1,2 Le ptosis secondaire à d’autres causes ne s’améliorera ni avec le test de repos ni avec le test de la glace.1
Les tests de laboratoire pour les anticorps AChR doivent également être effectués dans les cas suspects de myasthénie. Il faut garder à l’esprit que de 30 % à 65 % des patients atteints de myasthénie purement oculaire sont séronégatifs.3,4 Les études montrent que le taux d’anticorps anti-AChR n’est pas corrélé à la gravité de la maladie et ne permet pas de prédire qui développera une maladie généralisée.3,5
Le test de Tensilon a longtemps été considéré comme le principal test diagnostique de la myasthénie, bien qu’il soit aujourd’hui moins fréquemment utilisé que par le passé en raison du risque de complications cardiaques, de syncope et de crise cholinergique. Il présente également une incidence élevée de faux négatifs et de faux positifs.1
1. Kubis K, Danesh-Meyer H, Savino P, Sergott R. Le test de la glace par rapport au test du repos dans la myasthénie grave. Ophtalmol. 2000;107(11):1995-8.
2. Ellis F, Hoyt C, Ellis F, et al. Extraocular muscle responses to orbital cooling (ice test) for ocular myasthenia gravis diagnosis. J AAPOS Off Publ Am Assoc Pediatr Ophthalmol Strabismus. 2000;4(5):271-81.
3. Monsul N, Patwa H, Knorr A, et al. L’effet de la prednisone sur la progression de la myasthénie oculaire à généralisée. J Neurol Sci. 2004;217(2):131-3.
4. Porter N, Salter B. Myasthénie oculaire. Curr Treat Options Neurol. 2005;7(1):79-88.
5. Kupersmith MJ. Myasthénie oculaire : succès et échecs du traitement chez les patients ayant un suivi à long terme. J Neurol. 2009;256(8):1314-20.
L’imagerie émergente pour les adultes n’est pas nécessaire à moins que le syndrome de Horner ne présente une douleur aiguë. Des études récentes soutiennent que chez les patients présentant un syndrome de Horner isolé d’apparition récente et sans signes ou symptômes localisés, l’imagerie doit se concentrer sur l’ensemble de la voie oculosympathique en utilisant l’IRM et l’angiographie puisque les étiologies potentielles sont si nombreuses. Une lésion causale est typiquement identifiée dans 20% des cas, la plus fréquente étant la dissection de l’artère carotide, qui peut se produire spontanément ou être secondaire à un traumatisme.
Les autres étiologies graves qui doivent être écartées sont les tumeurs malignes, les lésions vasculaires du tronc cérébral et la thrombose du sinus caverneux.1,17,18 Dans les cas de syndrome de Horner de longue date, généralement considérés comme deux ans ou plus, l’imagerie peut ne pas être justifiée à moins que de nouveaux symptômes ne se développent17.
La myasthénie grave est une maladie rare caractérisée par une attaque immunitaire médiée par des anticorps sur le récepteur nicotinique de l’acétylcholine (AChR).19 Chez jusqu’à 65% des patients, les signes et symptômes initiaux de la myasthénie grave comprennent un ptosis, une faiblesse des muscles extra-oculaires, une faiblesse de l’orbiculaire ou un mauvais alignement oculaire.20 Tous les symptômes peuvent se présenter de manière unilatérale ou bilatérale et ont tendance à être récurrents et variables avec une aggravation progressive avec la fatigue. Typiquement, plus de 90 % des patients éprouveront certains ou tous ces symptômes à un certain degré au cours de la maladie.21,22 La myasthénie purement oculaire survient chez environ 50 % des patients.Environ la moitié d’entre eux évolueront vers une maladie généralisée dans les deux ans.23-25
Tous les patients présentant une myasthénie confirmée ou même suspectée doivent également subir une imagerie CT afin d’évaluer la présence d’une hyperplasie thymique ou d’un thymome.21 Le thymome survient chez environ 10 % à 15 % des patients atteints de myasthénie et nécessite une résection chirurgicale.26
Ptose myogénique
Cette ptose congénitale la plus courante peut être acquise ou congénitale et est due à une dysgénésie du muscle releveur avec du tissu fibroadipeux trouvé à la place des fibres musculaires squelettiques.6 La ptose myogénique acquise décrit une forme rare de ptose progressive typiquement bilatérale, causée par des dysfonctionnements musculaires systémiques6,27,28. Il peut s’agir d’une dystrophie musculaire, d’une myasthénie grave (discutée précédemment), d’une dystrophie oculopharyngée et d’une ophtalmoplégie externe chronique progressive (OECP).6 Moins fréquemment, des ptoses myogéniques induites par les stéroïdes et associées à la multithérapie antirétrovirale ont été signalées.27,28
La dystrophie myotonique est la forme la plus courante de dystrophie musculaire à l’âge adulte. Les constatations oculaires comprennent un ptosis symétrique, un blépharospasme, une ophtalmoplégie et des cataractes en arbre de Noël. La myotonie (relaxation tardive des muscles squelettiques après la contraction) est souvent le symptôme initial ; ainsi, les personnes atteintes peuvent être diagnostiquées avant l’apparition des symptômes oculaires. Les patients atteints peuvent également présenter une alopécie frontale à début précoce, une fonte des muscles temporaux et masséters et une faiblesse des membres distaux exacerbée par le froid, l’excitation ou la fatigue29,30. Les maladies respiratoires et la myopathie cardiaque sont les causes les plus fréquentes de décès30.
La ptose myogénique peut être corrigée à l’aide d’une béquille pour les paupières ou d’une chirurgie ; toutefois, il faut faire preuve de prudence lorsqu’on recommande l’une ou l’autre de ces solutions, car ces patients présentent un risque plus élevé de sécheresse oculaire postopératoire et de kératopathie d’exposition en raison d’un mauvais phénomène de Bell et d’un clignement incomplet.31,32
Lorsqu’un patient présente un ptosis, une anamnèse et un examen clinique approfondis sont essentiels pour déterminer si un bilan plus approfondi ou une orientation est nécessaire, car le ptosis peut être le symptôme initial d’un certain nombre d’affections médicales potentiellement mortelles.
Comme perle clinique générale, chaque fois qu’un ptosis, une anomalie pupillaire, un dysfonctionnement de la motilité extraoculaire, une asymétrie du globe ou une dystopie sont détectés à l’examen clinique, une évaluation approfondie de chacun d’entre eux est justifiée car ils peuvent donner des indices d’une maladie concomitante.8,33 Selon l’étiologie, certains cas de ptosis se résorberont spontanément, d’autres nécessiteront une prise en charge de la maladie systémique et d’autres encore nécessiteront une intervention chirurgicale. Comme pour toute intervention, des complications post-chirurgicales peuvent survenir, y compris, mais sans s’y limiter, une sous-correction, une surcorrection entraînant une lagophtalmie et une sécheresse oculaire, des anomalies du pli de la paupière et une distorsion du bord de la paupière.
Les optométristes doivent avoir une conscience des étiologies potentielles et la capacité de discerner quand la présentation d’un ptosis est une situation émergente nécessitant des tests de diagnostic, un traitement et une orientation rapides.
Les docteurs Reinhard et Spampinato sont optométristes au Cincinnati Veteran’s Administration Medical Center et membres adjoints du corps professoral de l’Ohio State University College of Optometry.
1. Díaz-Manera J, Luna S, Roig C. Ptose oculaire : diagnostic différentiel et traitement. Curr Opin Neurol. 2018;31(5):618-627.
2 Oyster CW. L’œil humain : structure et fonction. Sunderland, MA : Sinauer Associates ; 2006.
3. Remington, L.A. Anatomie clinique du système visuel (deuxième édition). Butterworth-Heinemann ; 2005.
4. Ezra DG, Beaconsfield M, Collin R. Anatomie chirurgicale de la paupière supérieure : anciennes controverses, nouveaux concepts. Expert Rev Ophthalmol. 2009;4(1):47-57.
5. Pauly M, Sruthi R. (2019). Ptosis : Évaluation et prise en charge. Kerala J Ophthalmol. 2019;31(1);11-16.
6. Finsterer J. Ptosis : causes, présentation et gestion. Aesthetic Plast Surg. 2003;27(3):193-204.
7. Iliff JW, Pacheco EM. L’ophtalmologie clinique de Duane. (Tasman W, Jaeger E, ed.). Lippincott Williams and Wilkins ; 2001.
8. Latting MW, Huggins AB, Marx DP, Giacometti JN. Évaluation clinique de la blépharoptose : distinguer la ptose liée à l’âge des conditions de mascarade. Semin Plast Surg. 2017;31(1):5-16.
9. Putterman AM. Margin reflex distance (MRD) 1, 2 et 3 : Ophthal Plast Reconstr Surg. 2012;28(4):308-11.
10. Yadegari S. Approche d’un patient atteint de blépharoptose. Neurol Sci. 2016;37(10):1589-96.
11. Lim J, Hou J, Singa R, et al. Incidence relative des sous-types de blépharoptose dans un cabinet d’oculoplastie d’un centre de soins tertiaires. Orbit. 2013;32(4):231-4.
12. Burkat C, Oh D, Yen M. Marge à la distance réflexe 1,2,3. Eyewiki. eyewiki.aao.org/Margin_to_reflex_distance_1,2,3. 16 septembre 2019. Consulté le 13 mars 2020.
13. Savar A, Blaydon S, Nakra T, Shore J. Ptosis surgery : In : Tasman W, Jaeger E eds. Duane’s Ophthalmology. Pennsylvania : Lippincott Williams & Wilkins ; 2013.
14. Jacobs SM, Tyring AJ, Amadi AJ. Ptosis traumatique : évaluation de l’étiologie, de la gestion et du pronostic. J Ophthalmic Vis Res. 2018;13(4):447-52.
15. Bhatti MT, Eisenschenk S, Roper SN, Guy JR. Parésie du troisième nerf crânien divisionnaire supérieur : observations cliniques et anatomiques de 2 cas uniques. Arch Neurol. 2006;63(5):771-6.
16. Kung N, Stavern GPV. Les paralysies isolées du nerf moteur oculaire. Semin Neurol. 2015;35(05):539-48.
17. Martin TJ. Le syndrome de Horner : une revue clinique. ACS Chem Neurosci. 2018;9(2):177-186.
18. Beebe J, Kardon R, Thurtell M. Le rendement de l’imagerie diagnostique chez les patients atteints du syndrome de Horner isolé. Neurol Clin. 2017;35(1):145-51.
19. McGrogan A, Sneddon S, Vries CS de. L’incidence de la myasthénie grave : une revue systématique de la littérature. Neuroépidémiologie. 2010;34(3):171-83.
20. Kupersmith MJ. Myasthénie oculaire : succès et échecs du traitement chez les patients avec un suivi à long terme. J Neurol. 2009;256(8):1314-20.
21. Gilbert ME, Savino PJ. Ocular myasthenia gravis. Int Ophthalmol Clin. 2007;47(4):93-103.
22. Antonio-Santos AA, Eggenberger ER. Options de traitement médical pour la myasthénie oculaire. Curr Opin Ophthalmol. 2008;19(6):468-478.
23. Porter NC, Salter BC. Ocular myasthenia gravis. Curr Treat Options Neurol. 2005;7(1):79-88.
24. Gilbert M, De Sousa E, Savino P. Ocular myasthenia gravis treatment : the case against prednisone therapy and thymectomy. Arch Neurol. Dec 2007 (64):1790-2.
25. Kumar V, Kaminski HJ. Traitement de la myasthénie grave. Curr Neurol Neurosci Rep. 2011;11(1):89-96.
26. Silvestri N, Wolfe G. Myasthenia Gravis. Semin Neurol. 2012;32(03):215-226.
27. Song A, Carter K, Nerad J, et al. Ptosis induit par les stéroïdes : études de cas et analyse histopathologique. Eye. 2008;22(4):491-5.
28. Silkis R, Lee H, Gills Ray V. Highly Active Antiretroviral Therapy-Associated Ptosis in Patients With Human Immunodeficiency Virus. Arch Ophthalmol. 2009;127(3):345-6.
27. Kubis KC, Danesh-Meyer HV, Savino PJ, Sergott RC. The ice test versus the rest test in myasthenia gravis. Ophthalmol. 2000;107(11):1995-8.
28. Ellis F, Hoyt C, Ellis F, et al. Extraocular muscle responses to orbital cooling (ice test) for ocular myasthenia gravis diagnosis. J AAPOS. 2000;4(5):271-81.
29. Nguyen C, Campbell C. Dystrophie myotonique de type 1. CMAJ Can Med Assoc J. 2016;188(14):1033.
30. Thornton CA. La dystrophie myotonique. Neurol Clin. 2014;32(3):705-19.
31. de Castro FAA, Cruz AAV, Sobreira CF da R. Motilité du sourcil dans la myopathie mitochondriale : Ophthal Plast Reconstr Surg. 2010;26(6):416-9.
32. Daut P, Steinemann T, Westfall C. Chronic exposure keratopathy complicating surgical correction of ptosis in patients with chronic progressive external ophthalmoplegia. Am J Ophthalmol. 2000;130(4):519-21.
33. Murchison AP, Bilyk JR, Savino PJ. Ptosis dans les maladies neurologiques. Dans : Black E, Nesi F, Calvano C, et al, eds. Smith and Nesi’s Ophthalmic Plastic and Reconstructive Surgery. New York, NY : Springer ; 2012:361-92.