Ptosis, joka tunnetaan virallisesti nimellä blefaroptoosi, on yleinen löydös, jolle on ominaista yläsilmäluomen roikkuminen ensisijaisessa katseessa. Yleensä ptoosi on pelkkä ikääntymisen tosiasia, mutta jotkut tapaukset liittyvät systeemisiin sairauksiin tai geneettisiin häiriöihin. Joidenkin ptoosia sairastavien ensisijainen huolenaihe voi olla kosmeettisuus, mutta pidemmälle edenneisiin tapauksiin liittyy näkökenttähäiriöitä, silmäluomien rasitusta, pään asentoa kompensoidakseen ja otsa- ja päänahkalihasten rasituksesta johtuvaa päänsärkyä.1 Kaikki tämä voi heikentää potilaan elämänlaatua.
Tässä kuvaamme joitakin ptoosin syitä, painottaen hankittuja muotoja, ja annamme ohjeita potilaiden seurantaan ja työstämiseen.
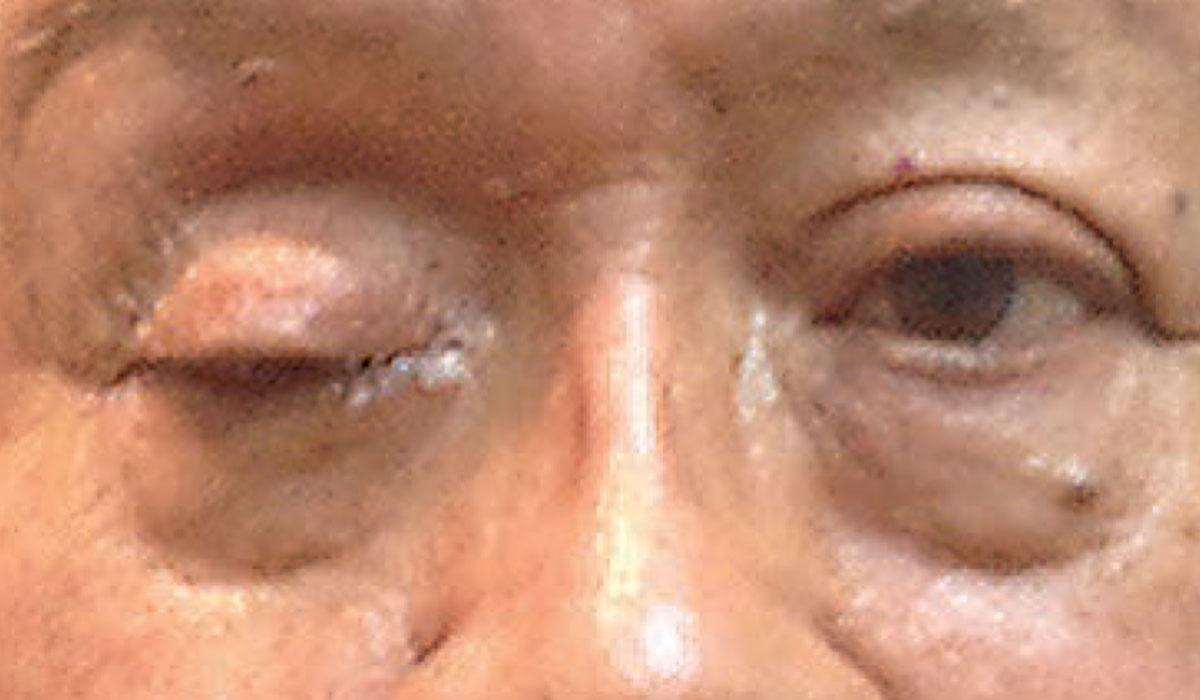
Täydellinen ptoosi voi viitata kiireellisen neurologisen tilan olemassaoloon. Kuva: Michael Trottini, OD. Klikkaa kuvaa suurentaaksesi.
Anatominen selitys
Mekaanisesti ptoosi liittyy silmäluomen kohoamisesta vastaavien lihasten toimintahäiriöön. Näitä ovat ylempi palpebral levator ja ylempi tarsaalilihas, jota kutsutaan myös Müllerin lihakseksi. Kummankin lihaksen tonuksen menetys johtaa ptoosiin.2 Ylempi palpebral levator on kuitenkin yläluomen tärkein vetäjä, ja siksi sen toiminnan puute aiheuttaa merkittävämmän ptoosin.2 Levatori saa alkunsa sulkaluun pienemmästä siivestä ja muuttuu viuhkanmuotoiseksi jänteiseksi laajentumaksi, levatorin aponeuroosiksi, kun se tulee silmäluomeen.2 Aponeuroosin kuidut läpäisevät silmäluomen väliseinän ja ulottuvat yläluomen sisään, viuhkoutuvat koko pituudeltaan ja asettuvat tervalevyn etupuolelle. Levator saa innervaationsa kallohermo III:n (CN III) ylemmästä jaostosta.3
Müllerin lihas saa alkunsa levatorin inferioripuolelta, juuri fornixin takapuolelta, ja se asettuu tervalevyn ylempään reunaan.4
Tätä lihasta hermottavat sympaattiset kuidut; Müllerin lihaksen denervaatio aiheuttaa vain lievän, 1 mm:n tai 2 mm:n ptoosin.3-5
Potilaan arviointi
Kun henkilö esittää ptoosivaivoja, ensimmäisenä askeleena on perusteellisen anamneesin kerääminen. Tähän tulisi sisältyä huolellinen katsaus aiempaan systeemiseen ja silmäsairaushistoriaan, mahdollisiin terveydentilan muutoksiin ja lääkkeiden käyttöön.
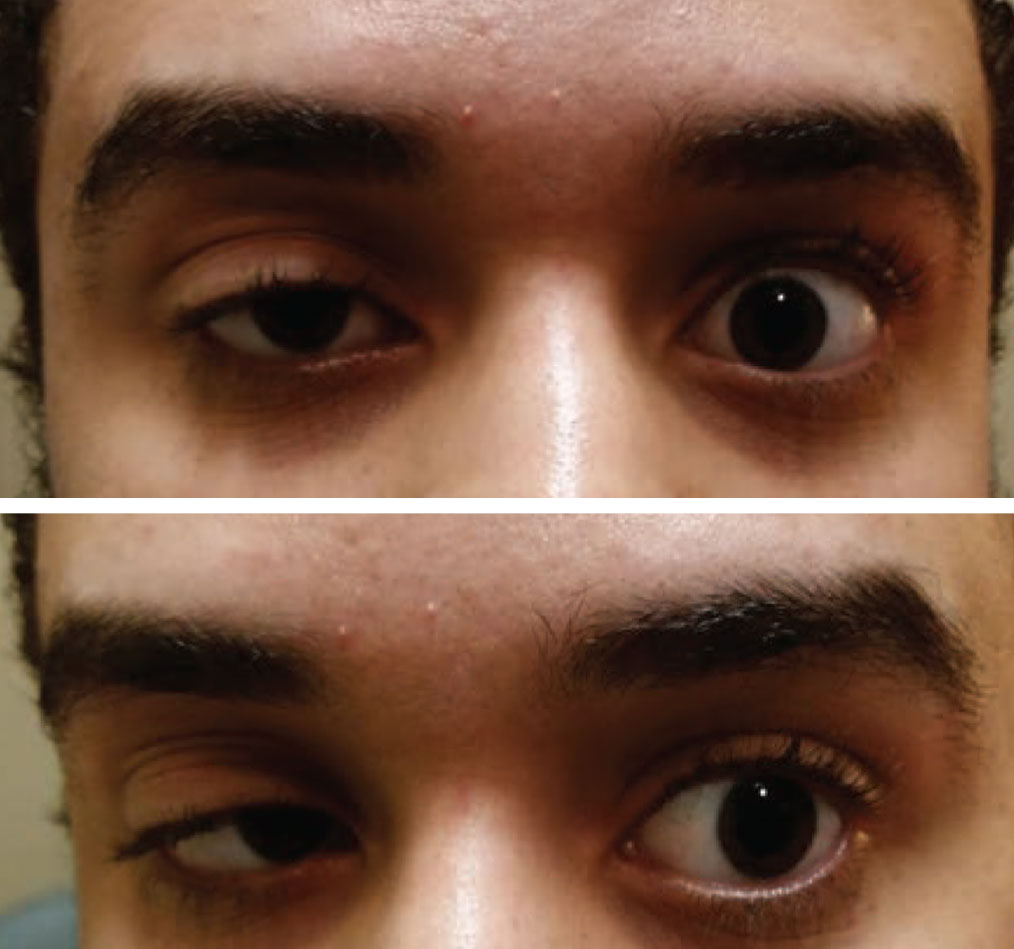
Toisen silmän hankittua ptoosia ja toisen silmän motiliteettirajoitusta tulisi pitää myasthenia gravisina, kunnes toisin todistetaan. Photo: Paul Ajamian, OD. Klikkaa kuvaa suurentaaksesi.
Ptoosi voi olla joko synnynnäinen tai hankittu, monokulaarinen tai binokulaarinen ja progressiivinen tai ei-progressiivinen. Nämä ominaispiirteet on kirjattava anamneesiin, ja samalla on selvitettävä mahdolliset neurologiset ja silmäoireet, kuten näön hämärtyminen, diplopia, kipu, perifeerinen näkökentän menetys, päänsärky tai yleistynyt lihasheikkous. Kysy mahdollisista traumoista tai aiemmista silmäleikkauksista sekä aiemmista botuliinitoksiini-injektioista tai silmästeroidien käytöstä.6,7
Ptoosin keston ymmärtäminen ja sen selvittäminen, eteneekö ptoosi, korjaantuuko se vai onko se pysynyt muuttumattomana, on tärkeää, samoin kuin mahdolliset merkit vuorokausivaihteluista. Akuutti alkaminen tunteja tai päiviä ennen tutkimusta herättää huolta vakavasta patologisesta etiologiasta.
Vanhojen valokuvien tarkastelu voi aina auttaa vahvistamaan muutokset, jos potilas on huono historioitsija.8
Kliininen tutkimus
Potilaiden, joilla on ptoosi, arviointi sisältää monia kattavan silmätutkimuksen vakiokomponentteja. Näöntarkkuuden ja binokulaarisen näön arviointi voi auttaa osoittamaan mahdollisen aiheuttavan systeemisairauden sekä arvioimaan amblyopiaa tai virheasentoa. Jos potilaille tehdään ptoosin kirurginen korjaus, amblyopia tai foria voivat viitata mahdollisiin fuusio-ongelmiin. Pupillin ja ekstraokulaarisen motiliteetin testaaminen sekä pallon epäsymmetrian ulkoinen havainnointi ovat kriittisen tärkeitä, jotta voidaan arvioida muita asiaan liittyviä patologioita, joita käsitellään myöhemmin. Potilaan pään asennon tarkkailu ja näkökenttätestaus voivat auttaa määrittämään ptoosin vaikutuksen ja vakavuuden.
Silmäluomien asennon kvantitatiiviset mittaukset auttavat arvioimaan retraktorilihasten toimintaa, tunnistamaan anatomiset poikkeavuudet ja voivat myös auttaa seuraamaan ptoosin etenemistä tai paranemista ajan myötä.
Ensisijaisesti nämä mittaukset, joita kutsutaan marginaalirefleksietäisyydeksi (MRD) 1, 2 ja 3, tehdään käyttämällä kynälamppua, joka kohdistetaan potilaan silmiin primaarisen katseen aikana. MRD1:n osalta kirjataan millimetreinä ilmaistu etäisyys yläluomen reunan keskiosan ja pupillarefleksin välillä molemmista silmistä.9-11 Normaali MRD1 on 4 mm – 5 mm.5 MRD1:n ero normaalin ja ptoottisen silmän välillä on ptoosin määrä. Jos ptoosi on niin merkittävä, että pupillaarista refleksiä ei voida havaita, MRD1:ksi kirjataan millimetreinä ilmaistu etäisyys, joka silmäluomea on nostettava, kunnes pupillaarinen refleksi voidaan havaita, negatiivisina lukuina.9
MRD2 eroaa siitä, että se mittaa primaarisen katseen sarveiskalvon valorefleksistä alaluomen keskiosaan.12 MRD3 määrittää, kuinka paljon levatoria on resekoitava synnynnäistä ptoosia sairastavilla potilailla, joilla on ptoosiin liittyvä vertikaalinen karsastus ja joilla karsastusleikkaus ei ole indikoitu.12
Levatorin toimintaa voidaan mitata määrittelemällä yläluomen kokonaisliike millimetreinä alaspäin suuntautuvasta katseesta ylöspäin suuntautuvaan katseeseen. Tämä mittaus on kirurgille tärkeä, kun hän määrittää sopivinta korjaavaa toimenpidettä. Normaali levatorin toiminta on tyypillisesti yli 15 millimetriä, kun taas 12-14 millimetriä pidetään hyvänä, 5-11 millimetriä tyydyttävänä ja alle 4 millimetriä huonona.5
Yläluomen rypytys edustaa levatorin aponeuroosiksen ja sen yläpuolella olevan orbicularis-lihaksen yhtymäkohtaa. Yläluomen reunasta alaspäin kulkevan silmäluomen reunan ja silmäluomen rypyn välinen alue on tavallisesti noin 8 mm miehillä ja 9-10 mm naisilla, mutta se voi vaihdella rodun mukaan.10 Potilailla, joilla on synnynnäinen ja myogeeninen ptoosi, yläluomen rypy puuttuu usein tai se on hienojakoinen.10 Potilailla, joilla on synnynnäinen ja myogeeninen ptoosi, yläluomen rypy puuttuu usein kokonaan tai se on ohut. Aponeuroottista ptoosia sairastavilla potilailla yläluomen rypytys on paljon korkeammalla.11
Palpebral fissure on yksinkertaisesti levein etäisyys yläluomen ja alaluomen reunojen välillä ensisijaisessa katseessa, ja sen avulla voidaan vertailla yleistä suhteellista ptoosia. Keskimääräiset arvot ovat 8 mm:n ja 11 mm:n välillä.10
Asioituneen ptoosin luokittelu
Tutkimuksen suorittamisen jälkeen seuraava vaihe on luokitella potilaan esitys. Etiologian perusteella ptoosi voidaan luokitella aponeuroottiseksi, myogeeniseksi, neurogeeniseksi, mekaaniseksi tai traumaattiseksi. Heillä voi kuitenkin olla myös niin sanottu pseudoptoosi, joka kuvaa silmäluomea, joka näyttää ptoottiselta johtuen rakenteellisista muutoksista, jotka vaikuttavat epäsuorasti silmäluomen asentoon.
Aponeuroottinen ptoosi on yleisin hankittu ptoosi. Sitä esiintyy tyypillisesti iäkkäillä henkilöillä, mutta se voi ilmetä missä iässä tahansa trauman, silmien tiheän hankauksen tai piilolinssien pitkäaikaisen käytön seurauksena, ja kovien linssien käyttäjillä riski on suurempi.6 Näillä potilailla levator aponeuroosin toiminta on yleensä hyvä, mutta levator aponeuroosi on venynyt tai ohentunut toistuvan rasituksen sekä painovoiman ja ikääntymisen vaikutusten vuoksi.6 Nuoremmilla potilailla, joilla esiintyy tätä hankitun ptoosin muotoa, voi olla korkeampi silmäluomen prässi levatorin disinsertion vuoksi.13 Nämä potilaat reagoivat yleensä hyvin kirurgiseen korjaukseen.
Mekaaninen ptoosi voi johtua mistä tahansa poikkeavuudesta, joka painaa alaspäin tai muuttaa silmäluomen rakennetta, mukaan luettuina blefarokalaasi, selluliitti, hordeolum, silmänympäryspään rasvaprolapsi ja silmäluomen tai silmänympäryspään kasvaimet. Myös tulehduksen, leikkauksen, Stevens-Johnsonin oireyhtymän tai silmän pemfigoidin aiheuttama arpeutuminen voi johtaa mekaaniseen ptoosiin.6 Orbitaalikuvaus on aina tehtävä potilaille, joilla on taustalla massa tai infiltroiva vaurio. Aiheuttavien tekijöiden korjaaminen on näiden potilaiden ensimmäinen hoitostrategia.
Traumaattinen ptoosi voi kehittyä minkä tahansa silmäkuoppaan kohdistuvan trauman seurauksena. Syitä voivat olla levator-lihaksen irtoaminen tai levator-jänteen vaurioituminen ja arpien muodostuminen. Vaihtoehtoisesti myös CN III voi vaurioitua, mikä johtaa ptoosiin.6,14 Vaikeissa tapauksissa, joissa levator-lihas vaurioituu merkittävästi, potilaat saattavat tarvita useita leikkauksia, jolloin luonnollisen silmäluomen symmetrian palauttaminen on epätodennäköistä.6,14 Potilailla, joilla on suurentunut CN III:n vaurioitumisriski, ovat muun muassa potilaat, joilla on päävammoja, traumaperäinen sivuontelon tromboosi, silmäkuopan apexin murtumat ja vieraiden kappaleiden aiheuttama hermokompressio.14 Potilaat, joilla on CN III -vaurio, paranevat tyypillisesti itsestään ajan myötä, ja heidän spontaania toipumistaan on tarkkailtava kolmesta kuuteen kuukauteen, ennen kuin harkitaan kirurgista toimenpidettä.6,14
Pseudoptoosi voi johtua lukuisista tiloista, kuten blefarospasmista, dermatokalaasista, johon liittyy huppuuntuminen (huppuuntuminen), silmänpohjan ptoosista (kulmahalvaus), mikrophthalmoksesta (mikrosilmäisyys), silmänpohjan silmänpohjan silmänpohjan (silmänpohjatulehdus) ja phthalmus bulbi (bulvaaninen kurkkukipulöydös). Luomen vetäytyminen kontralateraalisessa silmässä, kuten kilpirauhasen silmäsairaudessa, voi myös aiheuttaa suhteellisen ptoosin vaikutuksen sairastamattomaan silmään.8
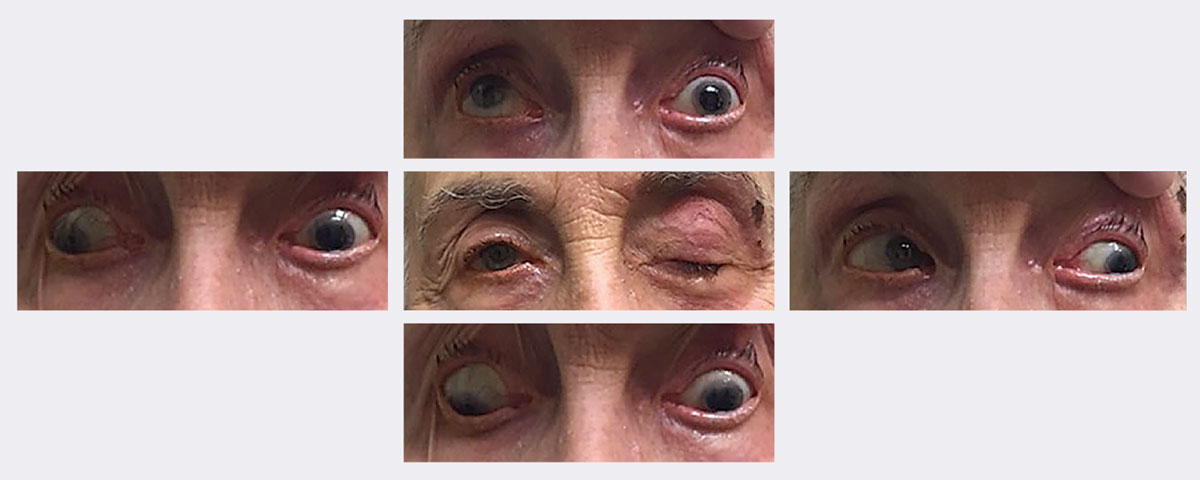
Tämän potilaan ensikäynnillä hänellä oli ptoosi, johon liittyi rajoitettu ylös- ja alaspäin katselu sekä adduktio. Lopulta hänellä diagnosoitiin täydellinen, pupillia säästävä vasemman kolmannen hermon halvaus, joka oli seurausta herpes zosterista. Hän parani noin kahdessa viikossa käyttämällä viruslääkettä. Kuvat: Michael Trottini, OD. Klikkaa kuvaa suurentaaksesi.
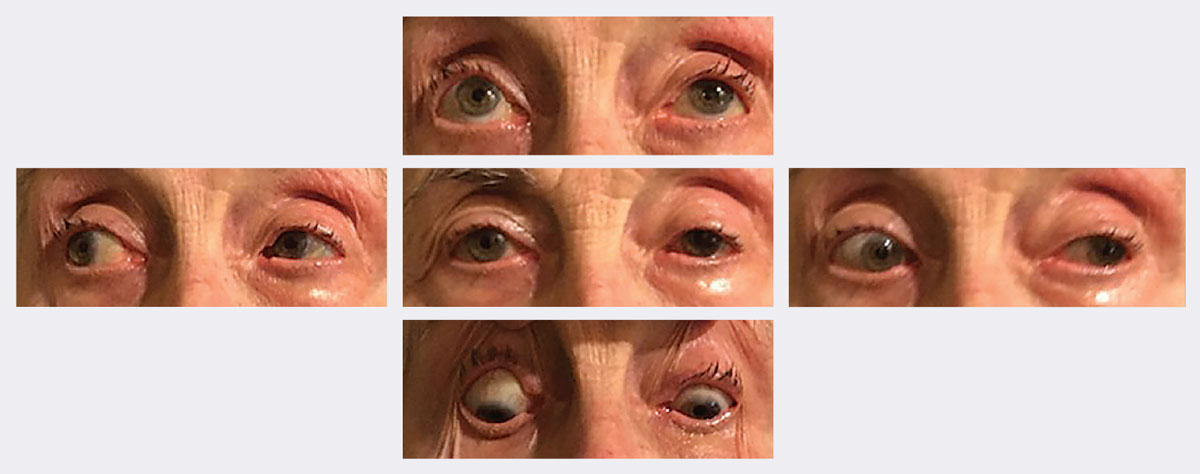
Seurannassa hänen ptoosinsa ja motiliteettinsa paranivat merkittävästi kahdessa viikossa. Kuvat: M: Michael Trottini, OD. Klikkaa kuvaa suurentaaksesi.
Neurogeeninen ptoosi
Tämä yläluomen lihasten heikentynyt innervaatio voi johtua useista mahdollisista etiologioista, joista osa voi olla hengenvaarallisia. Näiden tilojen nopea tunnistaminen ja hoito ovat ratkaisevan tärkeitä.
Kolmannen hermon halvaus on yleisin neurogeenisen ptoosin syy.1 Tämä hermo hermottaa ylempää, alempaa ja keskimmäistä rectuslihasta, inferior oblique -lihasta, levator-lihasta ja pupillin sulkijalihasta.15 Kun ptoosiin liittyy diplopian tai pupillin mydriaasin kaltaisia oireita, kolmannen hermon halvausta on harkittava.
Kolmannen hermon lamaannukset aiheuttavat sen, että silmä ottaa ”alas- ja ulospäin”-asennon, johon liittyy motiliteettitesteissä huomattavaa kohoamisen, painumisen ja adduktion heikkoutta.16 Kolmannen hermon lamaannuksen vaikeusaste voi vaihdella suuresti riippuen vauriota aiheuttavasta syystä ja vauriokohdan anatomisesta sijainnista.15
Kolmannen hermon lamaannukseen liittyvä ptoosi voi olla osittainen tai täydellinen. Potilaita, joilla on epätäydellinen kolmannen hermon halvaus, jossa on vain osittainen silmänulkoisten lihasten pareesi tai vain osittainen ptoosi, on arvioitava hyvin tarkasti sen varalta, että ne etenevät täydelliseksi halvaukseksi, johon liittyy pupillin mydriaasi. Kolmannen hermon halvaukseen liittyvä pupillaarinen osallistuminen on huolestuttavaa, jos kyseessä on kompressiivinen vaurio, kuten aneurysma tai kasvain.
Kolmannen hermohermon halvauksen yleisin etiologia yli 50-vuotiailla potilailla on mikrovaskulaarinen iskemia kardiovaskulaaristen riskitekijöiden yhteydessä, ja seuraavina ovat aneurysma, kasvain, trauma sekä erilaiset tulehdukselliset ja infektioperäiset etiologiat.16 Potilaat, joilla on kolmannen hermon halvaus ja pupillien osallistuminen, on lähetettävä kiireellisesti pään neurokuvaukseen, jotta voidaan sulkea pois henkeä uhkaava aneurysma, erityisesti takimmaisen viestivaltimon aneurysma.15,16
Hornerin oireyhtymälle on ominaista silmän sympaattisen innervaation katkeamisen seurauksena ilmenevä unilateraalinen ptoosi, pupillin miosis ja kasvojen anhidroosi. Hornerin oireyhtymään liittyvä ptoosi on lievä, tyypillisesti vain 1 mm tai 2 mm, ja se johtuu yläluomen Müellerin lihaksen innervaation puutteesta. Hornerin oireyhtymään liittyvä ptoosi voi vaihdella, ja jopa 12 prosentissa tapauksista se voi puuttua kokonaan. Miosis johtuu pupillin laajentajalihaksen sympaattisen tonuksen heikkenemisestä. Tästä johtuva anisokoria on voimakkaampi pimeässä, ja laajentumisviive on usein havaittavissa viiden ensimmäisen sekunnin kuluessa pimeäaltistuksesta.17
Hornerin oireyhtymä voi johtua vauriosta missä tahansa kolmen neuronin oculosympaattisen radan varrella. Varmistus voidaan tehdä farmakologisella testauksella 0,5-prosenttisella apraklonidiinilla tai harvemmin kokaiinilla.17,18 Positiivinen apraklonidiinitesti johtaa iiriksen dilataattorilihaksen yliherkkyyden aiheuttamaan mioottisen pupillin laajentumiseen sekä silmäluomen asennon normalisoitumiseen.1,17
Hydroksiamfetamiinia voidaan käyttää sen määrittämiseksi, onko vaurio pre- vai postganglioninen; tätä käytetään kuitenkin harvoin nykykäytännössä, koska neurokuvantaminen tilataan tyypillisesti siitä huolimatta.17,18
Myasthenia Gravis -testi
Kaksi testiä, jotka voidaan helposti tehdä tutkimushuoneessa myasthenia gravisin arvioimiseksi, ovat lepo- ja jäätesti. Lepotestiä varten ptoosipotilaita pyydetään pitämään silmänsä kevyesti kiinni kahden minuutin ajan. Noin 50 prosentilla potilaista, joilla on myastenia gravis, ptoosi paranee vähintään 2 mm:n verran lepokokeella.1 Tutkijat uskovat, että tämä johtuu siitä, että ACh:n määrä kertyy synapsiin, mikä parantaa lihasreaktiota.
Jäätesti tehdään asettamalla jäätä ptoosiin sairastuneen silmäluomen päälle kahdeksi minuutiksi ja arvioimalla sitten ptoosia uudelleen. Lepotestin tavoin vähintään 2 mm:n parannus on positiivinen testitulos.1,2 Muista syistä johtuva ptoosi ei parane lepo- eikä jäätestillä.1
Laboratoriokokeet AChR-vasta-aineiden varalta olisi tehtävä myös epäiltäessä myasteniaa. On muistettava, että 30-65 prosenttia potilaista, joilla on puhtaasti okulaarinen myastenia gravis, on seronegatiivisia.3,4 Tutkimukset osoittavat, että AChR-vasta-aineiden taso ei korreloi taudin vaikeusasteen kanssa eikä auta ennustamaan, kenelle kehittyy yleistynyt tauti.3,5
Tensilon-testiä on pitkään pidetty ensisijaisena diagnostisena testinä myasthenia graviksen varalta, vaikka sitä käytetään nykyään harvemmin kuin aikaisemmin sydänkomplikaatioiden, synkopeen ja kolinergisen kriisin riskin vuoksi. Siinä esiintyy myös paljon vääriä negatiivisia ja vääriä positiivisia tuloksia.1
1. Kubis K, Danesh-Meyer H, Savino P, Sergott R. Jäätesti vs. lepotesti myastenia gravisissa. Ophthalmol. 2000;107(11):1995-8.
2. Ellis F, Hoyt C, Ellis F, et al. Extraocular muscle responses to orbital cooling (ice test) for ocular myasthenia gravis diagnosis. J AAPOS Off Publ Am Assoc Pediatr Ophthalmol Strabismus. 2000;4(5):271-81.
3. Monsul N, Patwa H, Knorr A, et al. Prednisonin vaikutus etenemiseen okulaarisesta yleistyneeseen myastenia gravikseen. J Neurol Sci. 2004;217(2):131-3.
4. Porter N, Salter B. Ocular myasthenia gravis. Curr Treat Options Neurol. 2005;7(1):79-88.
5. Kupersmith MJ. Ocular myasthenia gravis: hoitomenestykset ja -epäonnistumiset pitkäaikaisseurannassa olevilla potilailla. J Neurol. 2009;256(8):1314-20.
Aikuisten kiireellinen kuvantaminen ei ole tarpeen, ellei Hornerin oireyhtymässä esiinny akuutisti kipua. Viimeaikaisissa tutkimuksissa on esitetty, että potilailla, joilla on hiljattain alkanut eristetty Hornerin oireyhtymä ja joilla ei ole paikallisia oireita, kuvantamisessa olisi keskityttävä koko okulosympaattiseen rataan magneettikuvauksen ja angiografian avulla, koska mahdollisia etiologisia syitä on niin paljon. Syyllinen vaurio tunnistetaan tyypillisesti 20 prosentissa tapauksista, joista yleisin on kaulavaltimon dissekaatio, joka voi tapahtua spontaanisti tai trauman seurauksena.
Muita vakavia etiologioita, jotka on suljettava pois, ovat pahanlaatuisuus, aivorungon verisuonivauriot ja sinus cavernosuksen tromboosi.1,17,18 Pitkään jatkuneessa Hornerin oireyhtymässä, jota tyypillisesti pidetään vähintään kaksi vuotta kestäneenä tai pidempään jatkuneen oireyhtymänä, kuvantaminen ei välttämättä ole perusteltua, ellei uusia oireita ilmaannu.17
Myastenia gravis on harvinainen sairaus, jolle on ominaista vasta-aineiden välittämä immuunihyökkäys nikotiiniseen asetyylikoliinireseptoriin (AChR).19 Jopa 65 %:lla potilaista myastenia gravisin ensimmäisiin merkkeihin ja oireisiin kuuluvat ptoosi, silmänulkoisten lihasten heikkous, orbicularis oculi -lihaksen heikkous tai silmien vääristymät.20 Kaikki oireet voivat ilmetä yksi- tai molemminpuolisesti, ja niillä on taipumus esiintyä toistuvina ja vaihtelevina, ja niiden ilmenemismuotona on asteittainen paheneminen, kun potilaat alkavat väsyä. Tyypillisesti yli 90 %:lla potilaista esiintyy joitakin tai kaikkia näistä oireista jossakin määrin taudin aikana.21,22 Puhtaasti okulaarista myastenia gravista esiintyy noin 50 %:lla potilaista.21 Noin puolet etenee yleistyneeksi taudiksi kahden vuoden kuluessa.23-25
Potilaille, joilla on varmistunut myastenia tai joita edes epäillään siitä, on tehtävä myös tietokonetomografia kateenkorvan liikakasvun tai kateenkorvan kyhmyooman varalta.21 Kateenkorvan kyhmyooma esiintyy noin 10-15 %:lla potilaista, jotka sairastavat myasteniaa, ja se vaatii kirurgista poistoa.26
Myogeeninen ptoosi
Tämä yleisin synnynnäinen ptoosi voi olla joko hankittu tai synnynnäinen, ja se johtuu levator-lihaksen dysgeneesistä, jossa luurankolihaksen kuitujen tilalla on fibroadipoosikudosta.6 Hankittu myogeeninen ptoosi kuvaa harvinaista tyypillisesti molemminpuolista etenevää molemminpuolista ptoosia, jonka aiheuttavat systeemiset lihasten toimintahäiriöt.6,27,28 Tällaisia voivat olla lihasdystrofia, myasthenia gravis (jota käsiteltiin aiemmin), okulofaryngeaalinen dystrofia ja krooninen etenevä ulkoinen oftalmoplegia (CPEO).6 Harvemmin on raportoitu steroidien aiheuttamaa ja HAART:n aiheuttamaa myogeenistä ptoosia.27,28
Myotoninen dystrofia on yleisin aikuisiän lihasdystrofian muoto. Silmälöydöksiä ovat symmetrinen ptoosi, blefarospasmi, oftalmoplegia ja joulukuusi kaihi. Myotonia (luurankolihaksen viivästynyt rentoutuminen supistumisen jälkeen) on usein ensimmäinen oire, joten sairastuneet henkilöt voidaan diagnosoida ennen silmäoireiden ilmaantumista. Sairastuneilla potilailla voi myös esiintyä varhain alkanutta otsalohkon hiustenlähtöä, ohimo- ja ohimolihasten ja lihaslihasten hupenemista ja raajojen distaalista heikkoutta, jota kylmyys, kiihtymys tai väsymys pahentaa.29,30 Yleisimpiä kuolinsyitä ovat hengityselinsairaudet ja sydänlihastulehdus.30
Myogeeninen ptoosi voidaan korjata silmäluomen kainalosauvalla tai leikkauksella; on kuitenkin noudatettava varovaisuutta, kun suositellaan jompaakumpaa näistä menetelmistä, sillä näillä potilailla on suurempi riski postoperatiiviseen kuivasilmäisyyteen ja altistuskeratopatiaan, jotka johtuvat huonosta Bellin ilmiöstä ja epätäydellisestä räpyttelystä.31,32
Kun potilaalla esiintyy ptoosia, perusteellinen anamneesi ja kliininen tutkimus ovat ratkaisevia sen määrittämiseksi, milloin lisätutkimukset tai lähetteen antaminen on tarpeen, sillä ptoosi voi olla useiden mahdollisesti kuolemaan johtavien sairauksien ensimmäinen oire.
Yleisenä kliinisenä helmiohjeena voidaan todeta, että aina kun kliinisessä tutkimuksessa havaitaan ptoosia, pupillien anomaliaa, ekstraokulaarisen motiliteetin toimintahäiriötä, pallon epäsymmetriaa tai dystopiaa, on perusteltua arvioida kukin niistä perusteellisesti, koska ne voivat antaa viitteitä samanaikaisesta sairaudesta.8,33 Etiologiasta riippuen jotkin ptoositapaukset korjaantuvat spontaanisti, jotkin vaativat systeemisen sairauden hoitoa ja jotkin vaativat leikkausta. Kuten minkä tahansa toimenpiteen yhteydessä, leikkauksen jälkeisiä komplikaatioita voi esiintyä, muun muassa alikorjaus, ylikorjaus, joka johtaa lagoftalmoosiin ja kuivasilmäisyyteen, silmäluomen rypyn poikkeavuudet ja silmäluomen reunan vääristymät.
Optometristien on oltava tietoisia mahdollisista etiologioista ja kyettävä erottamaan, milloin ptoosin esiintyminen on hätätilanne, joka edellyttää nopeaa diagnostista testausta, hoitoa ja lähetettä.
Tohtorit Reinhard ja Spampinato ovat Cincinnatin Veteran’s Administration Medical Centerin optometristeja ja Ohio State University College of Optometryn ylimääräisiä opettajia.
1. Díaz-Manera J, Luna S, Roig C. Silmän ptoosi: erotusdiagnoosi ja hoito. Curr Opin Neurol. 2018;31(5):618-627.
2. Oyster CW. The Human Eye: Structure and Function. Sunderland, MA: Sinauer Associates; 2006.
3. Remington, L.A. Clinical Anatomy of the Visual System (Second Edition). Butterworth-Heinemann; 2005.
4. Ezra DG, Beaconsfield M, Collin R. Surgical anatomy of the upper eyelid: old controversies, new concepts. Expert Rev Ophthalmol. 2009;4(1):47-57.
5. Pauly M, Sruthi R. (2019). Ptosis: Evaluation and management. Kerala J Ophthalmol. 2019;31(1);11-16.
6. Finsterer J. Ptosis: syyt, esittely ja hoito. Aesthetic Plast Surg. 2003;27(3):193-204.
7. Iliff JW, Pacheco EM. Duane’s Clinical Ophthalmology. (Tasman W, Jaeger E, toim.). Lippincott Williams and Wilkins; 2001.
8. Latting MW, Huggins AB, Marx DP, Giacometti JN. Blefaroptoosin kliininen arviointi: ikään liittyvän ptoosin erottaminen naamiointitiloista. Semin Plast Surg. 2017;31(1):5-16.
9. Putterman AM. Margin reflex distance (MRD) 1, 2 ja 3: Ophthal Plast Reconstr Surg. 2012;28(4):308-11.
10. Yadegari S. Lähestymistapa potilaalle, jolla on blefaroptoosi. Neurol Sci. 2016;37(10):1589-96.
11. Lim J, Hou J, Singa R, et al. Blefaroptoosin alatyyppien suhteellinen esiintyvyys tertiäärikeskuksen silmäplastikkakäytännössä. Orbit. 2013;32(4):231-4.
12. Burkat C, Oh D, Yen M. Margin to reflex distance 1,2,3. Eyewiki. eyewiki.aao.org/Margin_to_reflex_distance_1,2,3. September 16, 2019. Accessed March 13, 2020.
13. Savar A, Blaydon S, Nakra T, Shore J. Ptosis surgery: In: Tasman W, Jaeger E eds. Duane’s Ophthalmology. Pennsylvania: Lippincott Williams & Wilkins; 2013.
14. Jacobs SM, Tyring AJ, Amadi AJ. Traumaattinen ptoosi: etiologian, hoidon ja ennusteen arviointi. J Ophthalmic Vis Res. 2018;13(4):447-52.
15. Bhatti MT, Eisenschenk S, Roper SN, Guy JR. Superior divisional third cranial nerv paresis: kliinisiä ja anatomisia havaintoja kahdesta ainutlaatuisesta tapauksesta. Arch Neurol. 2006;63(5):771-6.
16. Kung N, Stavern GPV. Eristetyt silmän liikehermon halvaukset. Semin Neurol. 2015;35(05):539-48.
17. Martin TJ. Hornerin oireyhtymä: kliininen katsaus. ACS Chem Neurosci. 2018;9(2):177-186.
18. Beebe J, Kardon R, Thurtell M. Diagnostisen kuvantamisen tuotto potilailla, joilla on eristetty Hornerin oireyhtymä. Neurol Clin. 2017;35(1):145-51.
19. McGrogan A, Sneddon S, Vries CS de. Myasthenia gravisin esiintyvyys: systemaattinen kirjallisuuskatsaus. Neuroepidemiology. 2010;34(3):171-83.
20. Kupersmith MJ. Ocular myasthenia gravis: hoitomenestykset ja -epäonnistumiset pitkäaikaisseurannassa olevilla potilailla. J Neurol. 2009;256(8):1314-20.
21. Gilbert ME, Savino PJ. Ocular myasthenia gravis. Int Ophthalmol Clin. 2007;47(4):93-103.
22. Antonio-Santos AA, Eggenberger ER. Silmän myasthenia graviksen lääkehoitovaihtoehdot. Curr Opin Ophthalmol. 2008;19(6):468-478.
23. Porter NC, Salter BC. Ocular myasthenia gravis. Curr Treat Options Neurol. 2005;7(1):79-88.
24. Gilbert M, De Sousa E, Savino P. Ocular myasthenia gravis -hoito: prednisonihoitoa ja tyymektomiaa vastaan. Arch Neurol. Dec 2007 (64):1790-2.
25. Kumar V, Kaminski HJ. Myasthenia graviksen hoito. Curr Neurol Neurosci Rep. 2011;11(1):89-96.
26. Silvestri N, Wolfe G. Myasthenia Gravis. Semin Neurol. 2012;32(03):215-226.
27. Song A, Carter K, Nerad J, et al. Steroidien aiheuttama ptoosi: tapaustutkimuksia ja histopatologinen analyysi. Eye. 2008;22(4):491-5.
28. Silkis R, Lee H, Gills Ray V. Highly Active Antiretroviral Therapy-Associated Ptosis in Patients With Human Immunodeficiency Virus. Arch Ophthalmol. 2009;127(3):345-6.
27. Kubis KC, Danesh-Meyer HV, Savino PJ, Sergott RC. Jäätesti verrattuna lepotestiin myasthenia gravisissa. Ophthalmol. 2000;107(11):1995-8.
28. Ellis F, Hoyt C, Ellis F, et al. Extraocular muscle responses to orbital cooling (ice test) for ocular myasthenia gravis diagnosis. J AAPOS. 2000;4(5):271-81.
29. Nguyen C, Campbell C. Myotoninen dystrofia tyyppi 1. CMAJ Can Med Assoc J. 2016;188(14):1033.
30. Thornton CA. Myotoninen dystrofia. Neurol Clin. 2014;32(3):705-19.
31. de Castro FAA, Cruz AAV, Sobreira CF da R. Brow Motility in Mitochondrial Myopathy: Ophthal Plast Reconstr Surg. 2010;26(6):416-9.
32. Daut P, Steinemann T, Westfall C. Krooninen altistuskeratopatia, joka komplisoi ptoosin kirurgista korjausta potilailla, joilla on krooninen etenevä ulkoinen oftalmoplegia. Am J Ophthalmol. 2000;130(4):519-21.
33. Murchison AP, Bilyk JR, Savino PJ. Ptosis in neurologic disease. In: Black E, Nesi F, Calvano C, et al, eds. Smith and Nesi’s Ophthalmic Plastic and Reconstructive Surgery. New York, NY: Springer; 2012:361-92.