Introduktion
Shikimatvejen er tæt forbundet med de aromatiske aminosyrer (L-tryptofan, L-phenylalanin og L-tyrosin) og har i landplanter meget høje flows med skøn over mængden af fast kulstof, der passerer gennem vejen, der varierer mellem 20 og 50% (Weiss, 1986; Corea et al., 2012; Maeda og Dudareva, 2012). Der er blevet lagt betydelig forskningsmæssig fokus på denne vej, da de aromatiske aminosyrer ikke produceres af mennesker og monogastrisk husdyr og derfor er en vigtig kostkomponent (Tzin og Galili, 2010). Desuden er et af enzymerne i denne vej – 5-enolpyruvalshikimat-3-fosfat-syntase (EPSP) – et af de mest anvendte herbicid-målesteder (se Duke og Powles, 2008). Desuden syntetiseres, som vi for nylig har beskrevet, sekundære phenoliske metabolitter og deres forstadier i planter via shikimatbiosyntesevejen og dens mange forgreninger (Tohge et al., 2013). Shikimatvejen er meget bevaret og findes i svampe, bakterier og plantearter, hvor den fungerer i biosyntesen af ikke blot de tre aromatiske aminosyrer, der er beskrevet ovenfor, men også af utallige aromatiske sekundære metabolitter som f.eks. alkaloider, flavonoider, ligniner og aromatiske antibiotika. Mange af disse forbindelser er bioaktive og spiller vigtige roller i planternes forsvar mod biotisk og abiotisk stress og miljøinteraktioner (Hamberger et al., 2006; Maeda og Dudareva, 2012), og som sådan er de meget fysiologisk vigtige. Det anslås, at under normale forhold strømmer så meget som 20 % af det samlede fastlagte kulstof gennem shikimatvejen (Ni et al., 1996), med en større kulstofstrøm gennem vejen under perioder med plantestress eller hurtig vækst (Corea et al., 2012). I betragtning af dens betydning er det måske ikke overraskende, at alle medlemmer af biosyntetiske gener og tilsvarende enzymer, der er involveret i shikimatvejen, er blevet karakteriseret i modelplanter som Arabidopsis. Sammenligning på tværs af arter af shikimat biosyntetiske enzymer har afsløret, at de deler sekvens lighed, divergerende evolution og fællestræk i reaktionsmekanismer (Dosselaere og Vanderleyden, 2001). Alle andre arter adskiller sig imidlertid betydeligt fra svampe, som har udviklet et komplekst system med et enkelt pentafunktionelt polypeptid, kendt som AroM-komplekset, der udfører fem på hinanden følgende reaktioner (Lumsden og Coggins, 1977; Duncan et al., 1987). I denne gennemgang vil vi opsummere den nuværende viden om den genetiske karakter af denne vej med fokus på sammenligninger på tværs af arter, der bygger bro over en bred vifte af arter, herunder alger (Chlamydomonas reinhardtii, Volvox carteri, Micromonas sp., Ostreococcus tauri, Ostreococcus lucimarinus), mosser (Selaginella moellendorffii, Physcomitrella patens), monokotyper (Sorghum bicolor, Zea mays, Brachypodium distachyon, Oryza sativa ssp. japonica og Oryza sativa ssp. indica) og tokimbladede arter (Vitis vinifera, Theobroma cacao, Carica papaya, Arabidopsis thaliana, Arabidopsis lyrata, Populus trichocarpa, Ricinus communis, Manihot esculenta, Malus domestica, Fragaria vesca, Glycine max, Lotus japonicus, Medicago truncatula) (tabel 1). Endelig sammenligner og kontrasterer vi udviklingen af denne vej med udviklingen af de mere specialiserede veje for phenylpropanoidbiosyntese.
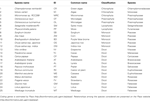
Tabel 1. Oversigt over de arter, der er anvendt i undersøgelsen.
Shikimatbiosyntese og phenylalaninafledt sekundærmetabolisme i planter
Da phenoliske sekundære metabolitter, der er afledt af phenylalanin via shikimatbiosyntese, er vidt udbredt i planter og andre eukaryoter, er gener, der koder for shikimatbiosyntetiske enzymer, generelt meget bevarede i naturen. Der er henholdsvis otte og to reaktioner involveret i shikimat- og phenylalaninbiosyntesen. Både medlemmer af alle genfamilier og de tilsvarende biosyntetiske enzymer, der er involveret i disse veje, er blevet karakteriseret i modelplanter såsom Arabidopsis (figur 1A). I modsætning hertil udviser phenoliske sekundære metabolitter, der er afledt af phenylalanin, en betydelig artsspecifik fordeling, idet de phenoliske sekundære metabolitter er fundet i planteriget som f.eks. kumarin-derivater, monolignal, lignin, spermidin-derivater, flavonoid og tannin, der er til stede i specifikke familier inden for den grønne slægt (figur 1B). Denne mangfoldighed er opstået ved hjælp af forskellige evolutionære strategier, f.eks. genduplikation og cis-regulatorisk evolution med henblik på tilpasning til de fremherskende miljøforhold. I betragtning af deres artsspecifikke fordeling anvendes generne, der er involveret i planternes phenoliske sekundære metabolisme, såsom phenylammonia-lyase (PAL), polyketidsyntase (PKS), 2-oxoglutarat-afhængige deoxygenaser (2ODD’er) og UDP-glycosyltransferaser (UGT’er) ofte som casestudier af planteevolutionen (Tohge et al., 2013). På trods af at shikimat-phenylalanin biosyntetiske gener er velkonserverede i alle arter, herunder algearter, blev phenoliske sekundære metabolisme-relaterede ortologous gener ikke påvist i alle algearter (Tabel 2, Tohge et al., 2013). Dette resultat tyder på en betydeligt mere gammel oprindelse af shikimat-fenylalaninvejene. I de næste afsnit vil vi diskutere udviklingen af shikimat-phenylalanin-banerne med fokus på sammenligninger på tværs af arter for hvert gen, der koder for et af de konstituerende enzymer i begge baner.
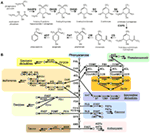
Figur 1. Shikimat- og phenylalaninafledte sekundære metabolitter biosyntesen i planter. (A) Shikimat biosyntese med udgangspunkt i phosphoenolpyruvat (PEP) og D-erythrose 4-phosphat er beskrevet med karakteriserede gener og rapporterede intermediære metabolitter. (B) phenylalaninafledt større phenolisk sekundær mebolit biosyntese i den grønne slægt. Pilen angiver enzymatisk reaktion, cirklen angiver metabolit. Forkortelse: DAHPS, 3-deoxy-D-arabino-heptulosonat 7-fosfat-syntase; DQS, 3-dehydroquinat-syntase; DHQD/SD, 3-dehydroquinat-dehydratase; SK, shikimatkinase; ESPS, 3-fosfosfoshikimat 1-carboxyvinyltransferase; CS, chorismatsyntase; CM, chorismatmutase; PAT, præfenataminotransferase; ADT, arogenat-dehydratase. PAL, phenylalaninammoniaklyase; C4H, cinnamat-4-hydroxylase; 4CL, 4-cumarat-CoA-ligase; CAD, cinnamoyl-alkohol-dehydrogenase; F5H, ferulat-5-hydroxylase; C3H, cumarat-3-hydroxylase; ALDH, aldehyddehydrogenase; CCR, cinnamoyl-CoA reduktase; HCT, hydroxycinnamoyl-Coenzym A shikimat/quinat hydroxycinnamoyltransferase; CCoAOMT, caffeoyl/CoA-3-O-metheltransferase; CHS, chalcon synthese; CHI, chalcon isomerase; F3H, flavanon 3-hydroxylase; F3′H, flavonoid-3′-hydroxylase; F3GT, flavonoid-3-O-glycosyltransferase; FS, flavonsyntase; FOMT, flavonoid O-methyltransferase; FCGT, flavon-C-glycosyltransferase; FLS, flavonolsyntese; F3GT, flavonoid-3-O-glycosyltransferase; DFR, dihydroflavonolreduktase; ANS, anthocyanidinsyntese; AGT, flavonoid-O-glycosyltransferase; AAT, anthocyaninacyltransferase; BAN, oxidoreduktase|dihydroflavonolreduktase-lignende; LAC, laccase.

Tabel 2. Shikimat- og phenylalaninbiosyntetiske gener og homologer i hver art med/uden tandemduplikerede gener.
3-Deoxy-D-Arabino-Heptulosonat 7-fosfat-syntase
Det første enzymatiske trin i shikimatvejen, 3-deoxy-D-arabino-heptulosonat 7-fosfat-syntase (DAHPS), katalyserer en aldolkondensation af phosphoenolpyruvat (PEP) og D-erythrose 4-phosphat (E4P) for at producere 3-deoxy-D-arabino-heptulosonat 7-fosfat (DAHP) (figur 1). I henhold til deres proteinstruktur kan DAHPS’er grupperes i to forskellige homologiklasser. De mikrobielt afledte klasse I DAHPS’er indeholder en bifunktionel chorismatmutase (CM)-DAHPS-domæne, og derfor klassificeres mikrobielle DAHPS’er, f.eks. E. coli (AroF, G og H) og S. cerevisiae (Aro3 og 4), som klasse I DAHPS’er. I modsætning hertil blev klasse II DAHPS tidligere anset for kun at være til stede i plantearter, men er efterfølgende blevet rapporteret i visse mikrober såsom Streptomyces coelicolor, Streptomyces rimosus og Neurospora crassa (Bentley, 1990; Maeda og Dudareva, 2012). DAHPS- (AroA) og CM- (AroQ) aktiviteterne i B. subtilis DAHPS er imidlertid adskilt ved domæne-trunkering. Detaljeret sekvensstrukturanalyse af de bakterielle AroA- og AroQ-familier, enzymatiske undersøgelser med det fulde protein i fuld længde og de trunkerede domæner af AroA og AroQ fra B. subtilis og sammenligning med fusionsproteiner fra Porphyromonas gingivalis, hvor AroQ-domænet blev fusioneret til AroA’s C-terminus, tyder på, at “feedback-regulering” faktisk kan være det evolutionære link mellem de to klasser, der er udviklet fra et primitivt ureguleret medlem af klasse II DAHPS (Wu og Woodard, 2006). Klasse II plante DAHPS’er er blevet rapporteret fra gulerodsrødder (Suzich et al., 1985) og kartoffelcellekultur (Pinto et al., 1986; Herrmann og Weaver, 1999). DAHPS er kodet af tre gener i Arabidopsis-genomet (AtDAHPS1, AT4G39980; AtDAHPS2, At4g33510; AtDAHPS3, At1g22410). Orthologe gen-søgningsforespørgsler ved hjælp af Arabidopsis DAHPS’erne afslørede et enkelt gen i algearter (Chlamydomonas reinhardtii, Volvox carteri, Micromonas sp. og Ostreococcus tauri) og Lotus japonica, men to til otte isoformer i andre højere plantearter (tabel 2). Gener af AtDAHPS1-typen og AtDAHPS2-typen viser differentiel ekspression i Arabidopsis thaliana, Solanum lycopersicum og Solanum tuberosum (Maeda og Dudareva, 2012). AtDAHPS1-type gener, som desuden er underlagt redoxregulering af ferredoxin-thioredoxinsystemet, udviser betydelig induktion ved sårdannelse og patogeninfektion (Keith et al., 1991; Gorlach et al., 1995; Maeda og Dudareva, 2012), hvorimod AtDAHPS2-type gener udviser konstitutiv ekspression (Gorlach et al., 1995). En fylogenetisk analyse af DAHPS-gener afslører fire hovedklader, (i) en mikrophyte-klade, (ii) en bryofyte-duplikator-klade, (iii) monokot og dicot træagtige arter-klade, (iv) en AtDAHPSs-klade (Figur 2Aa). Desuden har hovedklade iv fire undergrupper, (iv-a) AtDAHPS2-gruppe, (iv-b) monokot, (iv-c) AtDAHPS1-gruppe og (iv-d) AtDAHP3-gruppe. Dette resultat viser, at de konstitutivt udtrykte gener af typen AtDAHPS1 og de stressresponsive gener af typen AtDAHPS 3 har en velkonserveret sekvens mellem arterne (klade iv-c og iv-d), mens de anden konstitutivt udtrykte gener af typen AtDAHPS2 er klart adskilt mellem monokotyde- og dikotydearter (klade iv-a).

Figur 2. Fylogenetisk træanalyse af shikimat- og phenylalaninbiosyntetiske gener i 25 arter. Fylogenetiske træer med aminosyresekvenser for (A) shikimatvejen: (a), DAHPS, (b) DHS, (c) DHQD/SD, (d) SK, (e) ESPS og (f) CS, (B) phenylalanin-relaterede gener, (a) CM og (b) PAT. Aminosyresekvenserne af shikimatbiosyntetiske gener er hentet fra Plaza-databasen (http://bioinformatics.psb.ugent.be/plaza/). Forholdet mellem de betragtede arter er præsenteret på Plaza-webstedet. Det fylogenetiske træ blev konstrueret med de justerede proteinsekvenser ved hjælp af MEGA (version 5.10; http://www.megasoftware.net/; Kumar et al., 2004) ved hjælp af neighbor-joining-metoden med følgende parametre: Poisson-korrektion, fuldstændig sletning og bootstrap (1000 replikater, tilfældigt frø). Proteinsekvenserne blev justeret ved hjælp af Plaza. Værdier på grenene angiver bootstrap-støtte i procent.
3-dehydroquinat-syntase
Det andet trin i shikimatvejen katalyseres af 3-dehydroquinat-syntase (DHQS), et enzym, der fremmer den intramolekylære udveksling af DAHP-ringens ilt med kulstof 7 for at omdanne DAHP til 3-dehydroquinat. I modsætning til svampesituationen, der er beskrevet ovenfor, er DHQS-genet i planter monofunktionelt og findes kun som en enkelt kopi i alle arter med undtagelse af Glycine max, som har to gener i sit genom (figur 2Ab). En fylogenetisk analyse af DHQS generne afslører tre hovedklasser bestående af (i) mikrophyte, (ii) bryofyt, (iii) monokot, (iv) Brassicaceae og (v) dicot arter. I modsætning til andre shikimat biosyntetiske gener er genekspressionen af DHQS genet i modsætning til andre shikimat biosyntetiske gener ikke godt korreleret med phenylpropanoidproduktionen i Arabidopsis (Hamberger et al, 2006).
3-dehydroquinat dehydratase/shikimat dehydrogenase
3-Deoxy-D-arabino-heptulosonat 7-fosfat omdannes til 3-dehydroquinat af det bifunktionelle enzym 3-dehydroquinat dehydratase/shikimat dehydrogenase (DHQD/SD), som først katalyserer dehydreringen af DAHP til 3-dehydroshikimat og derefter den reversible reduktion af dette mellemprodukt til shikimat ved hjælp af NADPH som co-faktor. DHQD/SD findes i tre former; bakteriespecifikke shikimatdehydrogenaser af klasse I (AroE-typen), shikimat/quinatdehydrogenaser af klasse II (YdiB-typen) og shikimatdehydrogenase-lignende shikimatdehydrogenase af klasse III (SHD-L-typen) (Michel et al., 2003; Singh et al., 2005). I planter klasse IV er den enzymatiske aktivitet af DHQD 10 gange højere end SD-aktiviteten, hvilket indikerer, at mængden af 3-dehydroshikimat vil være mere end tilstrækkelig til at understøtte flux gennem shikimatvejen (Fiedler og Schultz, 1985). Dette bifunktionelle enzym spiller en vigtig rolle i reguleringen af metabolismen af flere phenoliske sekundære metaboliske veje (Bentley, 1990; Ding et al., 2007). Generelt indeholder frøplanter et enkelt DHQD/SD-gen, som indeholder en sekvens, der koder for et plastisk transitpeptid i deres genom (Maeda et al., 2011, tabel 2). En undtagelse fra dette udsagn er dog Nicotiana tabacum, som indeholder to gener i sit genom. Det er interessant, at silencing af NtDHD/SHD-1 resulterer i stærk væksthæmning og reduktion af niveauet af aromatiske aminosyrer, klorogensyre og ligninindholdet (Ding et al., 2007), men en anden cytosolisk isoform kan kompensere for produktionen af shikimat, men ikke på fænotypisk niveau. På et mere generelt grundlag afslører fylogenetisk analyse, at mikrofytter også indeholder et lavt antal DHQD/SD-gener (mellem et og to), mens der kunne observeres en klar adskillelse mellem (i) mikrofytkladen, (ii) bryofytekladen, (iii) monokotkladen, (iv) kladen af træagtige arter med specifik tandemgenduplikering og (v) dikotkladerne (Figur 2Ac; Tabel 2). Det er interessant, at observationen af den træagtige artsspecifikke tandemgen-duplikeringsklade tyder på, at disse arter udviklede sig efter DHQD/SD-gen-duplikering. Den cytosoliske lokalisering af NtDHD/SHD-2 er spændende, da tilstedeværelsen af DAHP-syntase, ESPS-syntase og CM-isoformer, der mangler N-terminale plastidmålingssekvenser, er blevet rapporteret (d’Amato, 1984; Mousdale og Coggins, 1985; Ganson et al., 1986). Desuden tyder resultaterne af, at både ESPS-syntase og shikimatkinase (SK) er aktive, selv når de beholder deres målsekvenser (Dellacioppa et al., 1986; Schmid et al., 1992), på, at de potentielt også kunne være bestanddele af en cytosolisk vej. Endelig er der eksperimenter, hvor isolerede og meget rene mitokondrier blev forsynet med 13C-mærket glukose for at undersøge bindingen af de cytosoliske isoformer af glykolysen (Giege et al, 2003) viste også 13C-berigelse i shikimat (Sweetlove og Fernie, 2013), hvilket indikerer, at en fuld cytosolisk vej også er sandsynlig i denne art.
Shikimatkinase
Den femte reaktion i shikimatvejen katalyseres af SK, som katalyserer den ATP-afhængige fosforylering af shikimat til shikimat-3-fosfat (S3P). E. coli har to SK’er, en af klasse I (AroL-typen) og en af II (AroK-typen), som kun har 30% sekvensidentitet (Griffin og Gasson, 1995; Whipp og Pittard, 1995; Herrmann og Weaver, 1999). I planter findes der forskelligt antal SK-isoformer hos flere arter; kun én hos grønalger, lycofytter og bryofytter, men mellem én og tre hos monokotone og dikotone planter (tabel 2). En fylogenetisk analyse af SK-generne viser fem hovedklader bestående af (i) mikrophyte, (ii) bryofyt, (iii) dikotyte-artsspecifik klade, (iv) monokotyte-klade og (v) dikotyte-artsklade (figur 2Ad). En analyse af SK-proteinet fra Spinacia olerancea afslørede, at det blev moduleret af energistatus og derfor ligner bakterielt SK-protein og andre ATP-brugende enzymer (Pacold og Anderson, 1973; Huang et al., 1975; Schmidt et al., 1990). Derfor er det for nylig blevet postuleret, at SK kan knytte sig til den energikrævende shikimatvej til den cellulære energibalance (Maeda og Dudareva, 2012), men direkte eksperimentel støtte for denne hypotese mangler i øjeblikket. I Arabidopsis er det blevet påvist, at homologe gener ved navn SKL1 og SKL2, som er funktionelt nødvendige for kloroplastbiogenese, er opstået på grund af SK-genduplikation (Fucile et al., 2008). SKL1- og SKL2-ortologer er fundet i flere frøplantearter, men ikke i grønalger (tabel 2).
5-enolypyruvylshikimat 3-fosfat-syntase
5-enolypyruvylshikimat 3-fosfat-syntase (EPSPS, 3-phosphoshikimat 1-carboxyvintltransferase) er det sjette trin, og her kondenseres en anden PEP med S3P til 5-enolypyruvylshiukimat 3-fosfat (EPSP). Da EPSPS er det eneste kendte mål for herbicidet glyphosat (Steinrucken og Amrhein, 1980), klassificeres isoformer af dette enzym ofte efter deres følsomhed over for glyphosat, idet glyphosatfølsom EPSPS klasse I findes i bakterier og plantearter, mens glyphosatuafhængig EPSPS klasse II, som er blevet rapporteret i visse bakterier som Agrobacterium (Fucile et al., 2011). I planter findes der forskelligt antal EPSPS-isoformer i flere arter; kun en enkelt isoform i grønalger, lycofytter og bryofytter, men enten en eller to findes i monokotone og dikotone arter (tabel 2). En fylogenetisk analyse af EPSPS-gener viste, atypisk for gener, der er forbundet med shikimatmetabolisme, at der kunne observeres fem hovedgrupper; (i) mikrophyte, (ii) bryofyt, (iii) Brassicaceae-specifik klade, (iv) monokottearter og (v) dikottearter (Figur 2Ae). Der er klare indikationer på, at duplikerede EPSPS-gener i Arabidopsis, æble, vindrue, sojabønne og poppel er resultatet af uafhængige duplikeringsbegivenheder inden for deres slægter med begge kopier, der er bevaret i Arabidopsis (Hamberger et al, 2006), men årsagen til den unikke divergens i dette gen af vejen er i øjeblikket uklar.
Chorismat-syntase
Chorismat, det endelige produkt af shikimatvejen, dannes efterfølgende af chorismatsyntase (CS), som katalyserer trans-1,4-eliminering af fosfat fra EPSP. CS’er kategoriseres inden for en af to funktionelle grupper (i) svampetype bifunktionelle CS’er, som er associeret med NADPH-afhængig flavinreduktase eller (ii) bakterie- og plantetype monofunktionelle CS’er (Schaller et al., 1991; Maeda og Dudareva, 2012). Den reaktion, der katalyseres af CS, kræver flavinmononukleotid (FMN), og dens samlede reaktion er redoxneutral (Ramjee et al., 1991; Macheroux et al., 1999; Maclean og Ali, 2003). FMN repræsenterer leverer en elektrondonor til EPSP, som letter spaltningen af fosfat. Det første klonede CS-gen fra planter var det fra C. sempervirens (Schaller et al., 1991), som kun indeholder et CS-gen i sit genom. Da dette gen har en 5′-signalsekvens for plastidimport, tyder disse resultater på, at der muligvis ikke findes nogen CS uden for plastiden hos denne art. En undersøgelse af andre arter viste, at der fandtes et til to CS-gener i grønalger, lycofytter og bryofytter samt i dikotytearter, men at der findes et til tre CS-gener i genomerne af æble- og bælgplantearter (tabel 2). En fylogenetisk analyse af CS-gener afslører tre hovedklasser bestående af (i) mikrophyter, (ii) monokotyper og (iii) dikotyper (figur 2Af).
Chorismatmutase
Chorismatmutase katalyserer det første trin i phenylalanin- og tyrosinbiosyntesen og udgør desuden et vigtigt trin i retning af grenopdelingen af tryptofanbiosyntesen. CM katalyserer omdannelsen af chorismat til præfenat via en Claisen-omlægning. De bakterielle mindre CM-proteiner (AroQ-type, klasse I CM) udviser monofunktionel enzymatisk aktivitet, mens flere bifunktionelle CM’er såsom CM-PDT, CM-PDH og CM-DAHP desuden er fundet i svampe og bakterier (klasse II CM, Euverink et al., 1995; Romero et al., 1995; Chen et al., 2003; Baez-Viveros et al., 2004). På trods af, at der kun findes ét CM-gen i alge- og lycophytgenomer, findes der flere genkopier (to til fem) i bryofytter samt monokotone og dikotone arter (tabel 2). I frøplanter bærer CM1 et putativt plastidtransitpeptid, men CM2 gør ikke og er desuden normalt ufølsom over for allosterisk regulering af aromatiske aminosyrer (Benesova og Bode, 1992; Eberhard et al., 1996; Maeda og Dudareva, 2012). Adskillige plantearter, især dicotplanter, har et yderligere CM3-familiegen, som viser stor sekvenslighed med CM2, men som alligevel bærer et formodet plastidtransitpeptid. For eksempel har Arabidopsis tre isozymer ved navn AtCM1 (At3g29200), AtCM2 (At5g10870) og AtCM3 (At1g69370) (Mobley et al., 1999; Tzin og Galili, 2010). Den fylogenetiske analyse af CS-generne afslører tre hovedklasser bestående af (i) AtCM2-kladen, (ii) mikrophyte- og bryofyte-kladen og (iii) AtCM2-kladen (figur 2Ba). Derudover viser klade iii to undergrupper, (iii-a) AtCM3-undergruppe og (iii-b) AtCM1-undergruppe (figur 2Ba) (Eberhard et al., 1996). På trods af at CM2-undergruppen indeholder alle arter af frøplanter, er monokotyper ikke indeholdt i AtCM3-undergruppen. For nylig er CM’s betydning blevet udvidet ud over intracellulær metabolisme. I Zea mays er den chorismatmutase Cmu1, der udskilles af Ustilago maydis, et udbredt patogen, der er karakteriseret ved udvikling af store plantetumorer og almindeligvis kendt som smut, en virulensfaktor. Optagelsen af Ustilago CMu1-proteinet i planteceller muliggør en omlægning af plantemetabolismen og ændrer disse cellers metaboliske status via metabolisk priming (Djamei et al., 2011). Det viser sig nu, at der findes sekreterede CM’er i mange planterelaterede mikrober, og denne form for værtsmanipulation synes at være et generelt våben i plantepatogeners arsenal.
Phenataminotransferase og arogenatdehydratase
Phenataminotransferase (PAT) og arogenatdehydratase (ADT) katalyserer de sidste trin til produktion af phenylalanin. Mens ADT først blev klonet i 2007 (Cho et al., 2007; Huang et al., 2010), er det først for nylig, at PAT er blevet klonet. Artikler offentliggjort i 2011 identificerede PAT i Petunia hybrid, Arabidopsis thaliana og Solanum lycopersicum (Dal Cin et al., 2011; Maeda et al., 2011) og fastslog, at det styrer kulstofstrømmen fra præfenat til arogenat, men også at det er stærkt og koordineret opreguleret med gener for primær metabolisme og phenylalaninafledte smagsstoffer. I plantearter er der fundet et forskelligt antal PAT isoformer. Selv om grønalger kun indeholder enkelte PAT- og ADT-gener, har monokotyper mellem en og to PAT’er og mellem to og fire ADT’er, mens dicotypernes genomer indeholder det samme antal PAT’er, men to til otte ADT’er (tabel 2). En fylogenetisk analyse af PAT-gener viser tre hovedklasser af (i) mikrophyte-, (ii) monokotyte- og (iii) dicotyte-arter (figur 2Bb).
Gener involveret i plantefænoliske sekundære metabolismer
Fænoliske sekundære metabolismer udviser en enorm kemisk diversitet som følge af evolutionen af enzymatiske gener, der er involveret i de forskellige biosyntetiske og dekorative veje. En sådan variation skyldes diversitet og redundans af flere nøglegener i phenolisk sekundær metabolisme såsom PKS’er, cytokrom P450’er (CYP’er), Fe2+/2-oxoglutarat-afhængige dioxygenaser (2ODD’er) og UDP-glycosyltransferaser (UGT’er). På den anden side er der andre generelle phenylpropanoidrelaterede biosyntetiske gener, phenylalaninammoniaklyase (PAL), cinnamat-4-hydroxylase (C4H) og 4-coumarat:coenzym A-ligase (4CL), som er nødvendige for at kunne differentiere forskellige klasser af phenolisk sekundær metabolisme. Alle disse kernegener koder for vigtige enzymer, som aktiverer en række hydroxycinnaminsyrer for at tilvejebringe prækursorer til biosyntesen af ligniner, monolignaler og faktisk alle andre vigtige phenoliske sekundære metabolitter i højere planter (Lozoya et al., 1988; Allina et al., 1998; Hu et al., 1998; Ehlting et al., 1999; Lindermayr et al., 2002; Hamberger og Hahlbrock, 2004). Da phenolisk sekundær metabolisme udviser betydelig artsspecificitet, anvendes undersøgelser af generne, der koder for de ansvarlige biosyntetiske enzymer, ofte som et eksempel på kemotaksonomi til at forstå planteevolutionen. Men da udviklingen af disse gener isoleret set er ret restriktiv, opnås en dybere forståelse ved at kombinere dette med en undersøgelse af udviklingen af de shikimat-fenylalanin biosyntetiske gener i den grønne slægt.
Slutning
I løbet af den lange evolutionære periode, der dækker fra vandalger til landplanter, har planter tilpasset sig de miljømæssige nicher med evolutionære strategier som genduplikation og konvergent evolution ved filtrering af naturlig udvælgelse. Generne for planters shikimatbiosyntese har udviklet sig i overensstemmelse hermed (figur 3). I denne gennemgang har vi påvist, at biosyntetiske gener for primær metabolisme af aromatiske aminosyrer er velkonserverede mellem alger og alle landplanter. Men i modsætning til algearter, som hverken har isoformer eller duplikerede gener i deres genomer, har alle landplanter genduplikeringer, herunder tandemgenduplikeringer, som er særligt fremtrædende i tilfælde af DAHPS, DHQD/SD, CS, CM og ADT (figur 3A; tabel 2). Vores fylogenetiske analyse afslørede en klar adskillelse mellem alger, monokotyper, dikotyper, træagtige arter og bælgplanter. En analyse af tilstedeværelsen og antallet af kopier af nøglegener på tværs af disse arter giver adskillige indikationer på, hvordan vi kan forbedre vores forståelse af det stillads, hvorfra disse gener har udviklet sig. Det nøjagtige evolutionære pres på generne for shikimatbiosyntese, herunder den unikke forekomst af Arom-komplekset, vil imidlertid kræve omfattende yderligere undersøgelser. Når det er sagt, er det spændende at sammenligne og kontrastere biosyntetiske gener med dem, der ligger nedstrøms for dem i produktionen af plantefenoler (figur 3B). Det er interessant, at shikimatvejens gener er allestedsnærværende i hele den grønne slægt, mens dette ikke kan siges om alle nedstrømsgener for phenylpropanoidbiosyntese. Desuden er der en langt større genduplikation inden for phenylpropanoidbiosyntesen end inden for shikimatbiosyntesen (figur 3A; tabel 2). Denne kendsgerning afspejles også i niveauet af kemisk diversitet i de respektive veje, idet shikimatvejens essentielle karakter forhindrer megen diversitet, mens phenylpropanoid-arter ofte er redundante i deres funktion i forhold til hinanden. Det forekommer sandsynligt, at phenylpropanoidvejen oprindeligt opstod via mutationer, der akkumuleres i generne for shikimatvejen. Men mens disse var potentielt gavnlige i landplanter af grunde, som vi diskuterer i vores nylige gennemgang af disse forbindelser (Tohge et al., 2013), ser de ikke ud til at dele shikimats essentielle egenskab på tværs af hele den grønne slægt.
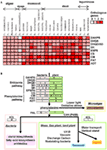
Figur 3. Heatmap for isoformer af shikimat-fenylalaninbiosyntetiske gener i plantegenomer og hypotetisk skema for evolutionen af phenylalaninafledt phenolisk sekundær metabolisme. (A) Heap map-oversigt over antallet af isoformer af shikimat-fenylalanin-biosyntetiske genisoformer i 25 arter. (B) Hypotetisk skematisk figur for shikimat-fenylalanin-biosyntetiske gener og deres evolution af phenolisk sekundær metabolisme.
Interessekonflikterklæring
Forfatterne erklærer, at forskningen blev udført uden kommercielle eller økonomiske relationer, der kunne opfattes som en potentiel interessekonflikt.
Akkreditering
Forskningsaktivitet af Takayuki Tohge er støttet af Alexander von Humboldt Foundation. Der takkes for støtte fra Max-Planck-Society (til Takayuki Tohge, Mutsumi Watanabe, Rainer Hoefgen, Alisdair R. Fernie).
Benesova, M., og Bode, R. (1992). Chorismat mutase isoformer fra frø og frøplanter af Papaver somniferum. Phytochemistry 31, 2983-2987.
CrossRef Full Text
Fiedler, E., og Schultz, G. (1985). Lokalisering, oprensning og karakterisering af shikimat oxidoreduktase-dehydroquinathydrolase fra stroma af spinat-chloroplaster. Plant Physiol. 79, 212-218.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Hamberger, B., Ehlting, J., Barbazuk, B., og Douglas, C. J. (2006). Komparativ genomforskning af shikimatvejen i Arabidopsis, Populus trichocarpa og Oryza sativa: shikimatvejenes genfamiliestruktur og identifikation af kandidater for manglende led i phenylalaninbiosyntesen. Nyere Adv. Phytochem. 40, 85-113.
CrossRef Full Text
Maclean, J., og Ali, S. (2003). Strukturen af chorismatsyntase afslører en ny flavinbinding til en unik kemisk reaktion. Structure 11, 1499-1511.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Schmid, J., Schaller, A., Leibinger, U., Boll, W., og Amrhein, N. (1992). Den in vitro syntetiserede tomat shikimatkinaseprækursor er enzymatisk aktiv og importeres og forarbejdes til det modne enzym af chloroplaster. Plant J. 2, 375-383.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tzin, V., og Galili, G. (2010). Ny indsigt i shikimat- og aromatiske aminosyrebiosyntesevejene i planter. Mol. Plant 3, 956-972.
Pubmed Abstract | Pubmed Full Text | Pubmed Full Text | CrossRef Full Text