Úvod
Šikimátová dráha je úzce propojena s dráhou aromatických aminokyselin (L-tryptofan, L-fenylalanin a L-tyrosin) a u suchozemských rostlin nese velmi vysoké toky, přičemž odhady množství fixovaného uhlíku procházejícího touto dráhou se pohybují mezi 20 a 50 % (Weiss, 1986; Corea et al., 2012; Maeda a Dudareva, 2012). Značná pozornost výzkumu byla věnována této dráze, protože aromatické aminokyseliny nejsou produkovány lidmi a monogastrickými hospodářskými zvířaty, a jsou proto důležitou složkou potravy (Tzin a Galili, 2010). Navíc jeden z enzymů této dráhy – 5-enolpyruvalšikimát-3-fosfát syntáza (EPSP) – je jedním z nejpoužívanějších cílových míst herbicidů (viz, Duke a Powles, 2008). Navíc, jak jsme nedávno popsali, rostlinné fenolické sekundární metabolity a jejich prekurzory jsou syntetizovány prostřednictvím dráhy biosyntézy šikimátu a jejích četných větví (Tohge et al., 2013). Šikimátová dráha je vysoce konzervovaná a vyskytuje se u hub, bakterií i rostlinných druhů, kde se podílí na biosyntéze nejen tří výše popsaných aromatických aminokyselin, ale také nesčetných aromatických sekundárních metabolitů, jako jsou alkaloidy, flavonoidy, ligniny a aromatická antibiotika. Mnohé z těchto sloučenin jsou bioaktivní a také hrají důležitou roli v obraně rostlin proti biotickým a abiotickým stresům a interakcím s prostředím (Hamberger et al., 2006; Maeda a Dudareva, 2012), a jako takové jsou velmi fyziologicky důležité. Odhaduje se, že za normálních podmínek proudí do šikimátové dráhy až 20 % celkového fixovaného uhlíku (Ni et al., 1996), přičemž větší tok uhlíku touto dráhou probíhá v době stresu rostlin nebo rychlého růstu (Corea et al., 2012). Vzhledem k jejímu významu asi nepřekvapí, že všichni členové biosyntetických genů a příslušných enzymů zapojených do šikimátové dráhy byli charakterizováni u modelových rostlin, jako je Arabidopsis. Mezidruhové srovnání biosyntetických enzymů šikimátu odhalilo, že mají společnou sekvenční podobnost, divergentní evoluci a společné reakční mechanismy (Dosselaere a Vanderleyden, 2001). Všechny ostatní druhy se však značně liší od hub, u nichž se vyvinul komplexní systém s jediným pentafunkčním polypeptidem známým jako komplex AroM, který provádí pět po sobě jdoucích reakcí (Lumsden a Coggins, 1977; Duncan a kol., 1987). V tomto přehledu shrneme současné poznatky týkající se genetické podstaty této dráhy se zaměřením na mezidruhové srovnání překlenující širokou škálu druhů včetně řas (Chlamydomonas reinhardtii, Volvox carteri, Micromonas sp., Ostreococcus tauri, Ostreococcus lucimarinus), mechů (Selaginella moellendorffii, Physcomitrella patens), jednoděložných rostlin (Sorghum bicolor, Zea mays, Brachypodium distachyon, Oryza sativa ssp. japonica a Oryza sativa ssp. indica) a dvouděložné druhy (Vitis vinifera, Theobroma cacao, Carica papaya, Arabidopsis thaliana, Arabidopsis lyrata, Populus trichocarpa, Ricinus communis, Manihot esculenta, Malus domestica, Fragaria vesca, Glycine max, Lotus japonicus, Medicago truncatula) (tabulka 1). Nakonec srovnáváme a porovnáváme evoluci této dráhy s evolucí specializovanějších drah biosyntézy fenylpropanoidů.
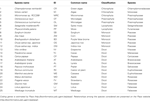
Tabulka 1. Přehled druhů použitých ve studii.
Biosyntéza šikimátu a sekundární metabolismus odvozený od fenylalaninu u rostlin
Vzhledem k tomu, že fenolické sekundární metabolity, které jsou odvozeny od fenylalaninu prostřednictvím biosyntézy šikimátu, jsou u rostlin a dalších eukaryot široce rozšířeny, geny kódující enzymy biosyntézy šikimátu jsou v přírodě obecně vysoce konzervované. Na biosyntéze šikimátu se podílí osm reakcí a na biosyntéze fenylalaninu dvě reakce. Jak členové všech genových rodin, tak příslušné biosyntetické enzymy zapojené do těchto drah byly charakterizovány u modelových rostlin, jako je Arabidopsis (obr. 1A). Naproti tomu fenolické sekundární metabolity odvozené od fenylalaninu vykazují značně druhově specifickou distribuci, přičemž fenolické sekundární metabolity byly nalezeny v rostlinné říši, jako jsou deriváty kumarinu, monolignal, lignin, deriváty spermidinu, flavonoid, tanin, které jsou přítomny ve specifických rodinách v rámci zelené linie (obr. 1B). Tato rozmanitost vznikla působením různých evolučních strategií, například genové duplikace a cis-regulační evoluce, aby se přizpůsobily převládajícím podmínkám prostředí. Vzhledem k jejich druhově specifickému rozšíření jsou geny zapojené do rostlinného fenolického sekundárního metabolismu, jako je fenylamonia-lyáza (PAL), polyketidová syntáza (PKS), 2-oxoglutarát-dependentní deoxygenázy (2ODD) a UDP-glykosyltransferázy (UGT), často používány jako případové studie evoluce rostlin (Tohge et al., 2013). Navzdory skutečnosti, že geny pro biosyntézu šikimátu a fenylalaninu jsou dobře konzervovány u všech druhů včetně druhů řas, ortologní geny související s fenolickým sekundárním metabolismem nebyly zjištěny u všech druhů řas (tabulka 2, Tohge et al., 2013). Tento výsledek naznačuje podstatně starší původ šikimát-fenylalaninových drah. V dalších částech se budeme zabývat evolucí šikimát-fenylalaninových drah se zaměřením na mezidruhové srovnání jednotlivých genů kódujících jeden ze složkových enzymů obou drah.
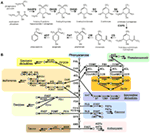
Obrázek 1. Šikimát-fenylalaninové dráhy. Biosyntéza sekundárních metabolitů odvozených od šikimátu a fenylalaninu v rostlinách. (A) Biosyntéza šikimátu vycházející z fosfoenolpyruvátu (PEP) a D-erytrozo-4-fosfátu je popsána s charakterizovanými geny a uváděnými meziprodukty. (B) biosyntéza hlavních fenolických sekundárních mebolitů odvozených od fenylalaninu v zelené linii. Šipka označuje enzymatickou reakci, kroužek označuje metabolit. Zkratka: DAHPS, 3-deoxy-D-arabino-heptulosonát 7-fosfát syntáza; DQS, 3-dehydrochinát syntáza; DHQD/SD, 3-dehydrochinát dehydratáza; SK, šikimát kináza; ESPS, 3-fosfoshikimát 1-karboxyvinyltransferáza; CS, chorismát syntáza; CM, chorismát mutáza; PAT, prefenát aminotransferáza; ADT, arogenát dehydratáza. PAL, fenylalanin ammonia-lyasa; C4H, cinnamate-4-hydroxylasa; 4CL, 4-coumarate CoA ligase; CAD, cinnamoyl-alcohol dehydrogenase; F5H, ferulate 5-hydroxylasa; C3H, coumarate 3-hydroxylasa; ALDH, aldehyd dehydrogenase; CCR, cinnamoyl-CoA reduktasa; HCT, hydroxycinnamoyl-Coenzyme A shikimate/quinate hydroxycinnamoyltransferasa; CCoAOMT, caffeoyl/CoA-3-O-metheltransferasa; CHS, chalcone synthese; CHI, chalcone isomerase; F3H, flavanone 3-hydroxylase; F3′H, flavonoid-3′-hydroxylasa; F3GT, flavonoid-3-O-glykosyltransferasa; FS, flavon synthasa; FOMT, flavonoid O-methyltransferasa; FCGT, flavon-C-glykosyltransferasa; FLS, flavonol synthese; F3GT, flavonoid-3-O-glykosyltransferasa; DFR, dihydroflavonol reduktasa; ANS, antokyanidin synthese; AGT, flavonoid-O-glykosyltransferasa; AAT, antokyanin acyltransferasa; BAN, oxidoreduktasa|dihydroflavonol reduktasa jako; LAC, lakasa.

Tabulka 2. Geny pro biosyntézu šikimátu a fenylalaninu a jejich homology u jednotlivých druhů s/bez tandemově duplikovaných genů.
3-Deoxy-D-arabino-heptulosonát 7-fosfát syntáza
První enzymatický krok šikimátové dráhy, 3-deoxy-D-arabino-heptulosonát 7-fosfát syntáza (DAHPS), katalyzuje aldolovou kondenzaci fosfoenolpyruvátu (PEP) a D-erythros-4-fosfátu (E4P) za vzniku 3-deoxy-D-arabino-heptulosonát 7-fosfátu (DAHP) (obr. 1). Podle struktury proteinů lze DAHPS rozdělit do dvou odlišných homologických tříd. DAHPS odvozené od mikrobů třídy I obsahují bifunkční chorismát mutázové (CM)-DAHPS domény, z tohoto důvodu jsou mikrobiální DAHPS, například E. coli (AroF, G a H) a S. cerevisiae (Aro3 a 4), klasifikovány jako DAHPS I. třídy. Naproti tomu DAHPS třídy II byly dříve považovány za přítomné pouze u rostlinných druhů, ale následně byly zaznamenány u některých mikrobů, například Streptomyces coelicolor, Streptomyces rimosus a Neurospora crassa (Bentley, 1990; Maeda a Dudareva, 2012). Aktivity DAHPS (AroA) a CM (AroQ) DAHPS B. subtilis jsou však odděleny zkrácením domén. Podrobná analýza sekvenční struktury bakteriálních rodin AroA a AroQ, enzymatické studie s proteiny plné délky a zkrácenými doménami AroA a AroQ B. subtilis a srovnání s fúzními proteiny Porphyromonas gingivalis, u nichž byla doména AroQ sloučena s C-koncem AroA, naznačují, že „zpětnovazební regulace“ může být skutečně evolučním pojítkem mezi těmito dvěma třídami, které se vyvinuly z primitivního neregulovaného člena třídy II DAHPS (Wu a Woodard, 2006). Rostlinné DAHPS třídy II byly popsány z kořenů mrkve (Suzich et al., 1985) a buněčné kultury brambor (Pinto et al., 1986; Herrmann a Weaver, 1999). DAHPS je v genomu Arabidopsis kódován třemi geny (AtDAHPS1, AT4G39980; AtDAHPS2, At4g33510; AtDAHPS3, At1g22410). Vyhledávání ortologických genů pomocí DAHPS z Arabidopsis odhalilo jediný gen u druhů řas (Chlamydomonas reinhardtii, Volvox carteri, Micromonas sp. a Ostreococcus tauri) a Lotus japonica, ale dvě až osm izoforem u ostatních druhů vyšších rostlin (tabulka 2). Geny typu AtDAHPS1 a AtDAHPS2 vykazují rozdílnou expresi u Arabidopsis thaliana, Solanum lycopersicum a Solanum tuberosum (Maeda a Dudareva, 2012). Geny typu AtDAHPS1, které navíc podléhají redoxní regulaci pomocí ferredoxin-thioredoxinového systému, vykazují významnou indukci při poranění a infekci patogeny (Keith et al., 1991; Gorlach et al., 1995; Maeda a Dudareva, 2012), zatímco geny typu AtDAHPS2 vykazují konstitutivní expresi (Gorlach et al., 1995). Fylogenetická analýza genů DAHPS odhalila čtyři hlavní kladi, (i) klad mikrofyta, (ii) duplikační klad mechorostů, (iii) klad jednoděložných a dvouděložných dřevin, (iv) klad AtDAHPSs (obr. 2Aa). Hlavní klad iv má navíc čtyři podskupiny, (iv-a) skupinu AtDAHPS2, (iv-b) monokot, (iv-c) skupinu AtDAHPS1 a (iv-d) skupinu AtDAHP3. Tento výsledek naznačuje, že konstitutivně exprimované geny typu AtDAHPS1 a stresově citlivé geny typu AtDAHPS 3 vykazují dobře konzervovanou sekvenci mezi druhy (clade iv-c a iv-d), zatímco druhé konstitutivně exprimované geny typu AtDAHPS2 jsou jasně odděleny mezi druhy monocot a dicot (clade iv-a).

Figure 2. Analýza fylogenetického stromu biosyntetických genů pro šikimát a fenylalanin u 25 druhů. Fylogenetické stromy sekvencí aminokyselin (A) šikimátové dráhy: (a), DAHPS, (b) DHS, (c) DHQD/SD, (d) SK, (e) ESPS a (f) CS, (B) genů souvisejících s fenylalaninem, (a) CM a (b) PAT. Aminokyselinové sekvence genů pro biosyntézu šikimátu jsou získány z databáze Plaza (http://bioinformatics.psb.ugent.be/plaza/). Vztahy mezi uvažovanými druhy jsou uvedeny na internetových stránkách Plaza. Fylogenetický strom byl sestrojen na základě zarovnaných proteinových sekvencí pomocí programu MEGA (verze 5.10; http://www.megasoftware.net/; Kumar et al., 2004) s použitím metody sousedského spojování s následujícími parametry: Poissonova korekce, úplné vyřazení a bootstrap (1000 replikátů, náhodný seed). Proteinové sekvence byly zarovnány metodou Plaza. Hodnoty na větvích označují bootstrapovou podporu v procentech.
3-dehydrochinát syntáza
Druhý krok šikimátové dráhy katalyzuje 3-dehydrochinát syntáza (DHQS), enzym, který podporuje intramolekulární výměnu kyslíku kruhu DAHP s uhlíkem 7 za účelem přeměny DAHP na 3-dehydrochinát. Na rozdíl od výše popsané situace u hub je rostlinný gen DHQS monofunkční a nachází se pouze v jedné kopii u všech druhů s výjimkou Glycine max, který ve svém genomu ukrývá dva geny (obrázek 2Ab). Fylogenetická analýza genů DHQS odhalila tři hlavní klany sestávající z (i) mikrofyta, (ii) mechorostů, (iii) jednoděložných rostlin, (iv) brukvovitých rostlin a (v) dvouděložných druhů. Zajímavé je, že na rozdíl od ostatních biosyntetických genů pro šikimáty není genová exprese genu DHQS dobře korelována s produkcí fenylpropanoidů v Arabidopsis (Hamberger et al., 2006).
3-dehydrochinát dehydratasa/šikimát dehydrogenasa
3-Deoxy-D-arabino-heptulosonát 7-fosfát je přeměňován na 3-dehydrochinát bifunkčním enzymem 3-dehydrochinát dehydratasa/šikimát dehydrogenasa (DHQD/SD), která katalyzuje nejprve dehydrataci DAHP na 3-dehydroshikimát a následně reverzibilní redukci tohoto meziproduktu na shikimát za použití NADPH jako kofaktoru. DHQD/SD existuje ve třech formách: bakteriální specifické šikimátdehydrogenázy třídy I (typ AroE), šikimát/chinátdehydrogenázy třídy II (typ YdiB) a šikimátdehydrogenáze podobné třídy III (typ SHD-L) (Michel et al., 2003; Singh et al., 2005). U rostlin třídy IV je enzymatická aktivita DHQD desetkrát vyšší než aktivita SD, což naznačuje, že množství 3-dehydroshikimátu bude více než dostatečné pro podporu toku šikimátovou cestou (Fiedler a Schultz, 1985). Tento bifunkční enzym hraje důležitou roli v regulaci metabolismu několika fenolových sekundárních metabolických drah (Bentley, 1990; Ding et al., 2007). Obecně obsahují semenné rostliny ve svém genomu jediný gen DHQD/SD, který obsahuje sekvenci kódující plastický tranzitní peptid (Maeda et al., 2011, tab. 2). Výjimkou z tohoto tvrzení je však Nicotiana tabacum, která ve svém genomu obsahuje dva geny. Je zajímavé, že umlčení NtDHD/SHD-1 má za následek silnou inhibici růstu a snížení hladiny aromatických aminokyselin, kyseliny chlorogenové a obsahu ligninu (Ding et al., 2007), nicméně druhá cytosolová izoforma dokáže kompenzovat produkci šikimátu, ale ne na fenotypové úrovni. Na obecnějším základě fylogenetická analýza ukazuje, že mikrofyty také obsahují nízký počet DHQD/SD genů (mezi jedním a dvěma), zatímco bylo možné pozorovat jasné oddělení (i) kladů mikrofytů, (ii) kladů mechorostů, (iii) kladů jednoděložných rostlin, (iv) kladů tandemových genových duplikací specifických pro dřeviny a (v) kladů dvouděložných rostlin (obr. 2Ac; tab. 2). Zajímavé je, že pozorování tandemové duplikace genů specifické pro dřeviny naznačuje, že se tyto druhy vyvinuly po duplikaci genů DHQD/SD. Cytosolická lokalizace NtDHD/SHD-2 je zajímavá, protože byla zaznamenána přítomnost DAHP syntázy, ESPS syntázy a CM izoforem postrádajících N-terminální plastidové cílové sekvence (d’Amato, 1984; Mousdale a Coggins, 1985; Ganson a kol., 1986). Kromě toho zjištění, že jak ESPS syntáza, tak šikimátkináza (SK) jsou aktivní, i když si zachovávají své cílové sekvence (Dellacioppa et al., 1986; Schmid et al., 1992), naznačuje, že by potenciálně mohly být také složkami cytosolické dráhy. A konečně experimenty, při nichž byla izolovaným a vysoce čistým mitochondriím dodávána glukóza značená 13C, aby se zkoumala vazba cytosolických izoforem glykolýzy (Giege et al., 2003) rovněž odhalily obohacení 13C v šikimátu (Sweetlove a Fernie, 2013), což naznačuje, že i u tohoto druhu je pravděpodobná úplná cytosolická dráha.
Šikimátkináza
Pátou reakci šikimátové dráhy katalyzuje SK, která katalyzuje ATP-dependentní fosforylaci šikimátu na šikimát-3-fosfát (S3P). E. coli má dvě SK, jednu třídy I (typ AroL) a druhou třídy II (typ AroK), které mají pouze 30% sekvenční identitu (Griffin a Gasson, 1995; Whipp a Pittard, 1995; Herrmann a Weaver, 1999). U rostlin se u několika druhů vyskytuje různý počet izoforem SK; pouze jedna u zelených řas, lýkožroutů a mechorostů, ale jedna až tři u jednoděložných a dvouděložných rostlin (tab. 2). Fylogenetická analýza SK genů představuje pět hlavních kladů, které se skládají z (i) mikrofytů, (ii) mechorostů, (iii) kladů specifických pro dvouděložné dřeviny, (iv) kladů monokotů a (v) kladů dvouděložných druhů (obr. 2Ad). Analýza SK proteinu Spinacia olerancea ukázala, že je modulován energetickým stavem, a je tedy podobný bakteriálnímu SK proteinu a dalším enzymům využívajícím ATP (Pacold a Anderson, 1973; Huang et al., 1975; Schmidt et al., 1990). Z tohoto důvodu byla nedávno vyslovena domněnka, že SK může propojovat energeticky náročnou šikimátovou dráhu s energetickou bilancí buňky (Maeda a Dudareva, 2012), nicméně přímá experimentální podpora této hypotézy v současné době chybí. U Arabidopsis bylo prokázáno, že homologní geny s názvy SKL1 a SKL2, které jsou funkčně potřebné pro biogenezi chloroplastů, vznikly duplikací genů SK (Fucile et al., 2008). Ortologové SKL1 a SKL2 byli nalezeni u několika druhů semenných rostlin, ale ne u zelených řas (tabulka 2).
5-enolypyruvylšikimát 3-fosfát syntáza
Syntáza 5-enolypyruvylšikimát 3-fosfátu (EPSPS, 3-fosfosfošikimát 1-karboxyvintransferáza) je šestým krokem a dochází zde ke kondenzaci druhého PEP s S3P za vzniku 5-enolpyruvylšikimát 3-fosfátu (EPSP). Protože EPSPS je jediným známým cílem pro herbicid glyfosát (Steinrucken a Amrhein, 1980), jsou izoformy tohoto enzymu často klasifikovány podle citlivosti na glyfosát, EPSPS třídy I citlivá na glyfosát je přítomna u bakterií a rostlinných druhů, zatímco EPSPS třídy II necitlivá na glyfosát, která byla zaznamenána u některých bakterií, jako je Agrobacterium (Fucile et al., 2011). U rostlin se u několika druhů vyskytuje různý počet izoforem EPSPS; u zelených řas, lýkožroutů a mechorostů pouze jedna izoforma, ale u jednoděložných a dvouděložných druhů se vyskytuje buď jedna, nebo dvě (tabulka 2). Fylogenetická analýza genů EPSPS odhalila, netypicky pro geny spojené s metabolismem šikimátu, že lze pozorovat pět hlavních skupin: (i) mikrofyty, (ii) mechorosty, (iii) specifický klad Brassicaceae, (iv) monokotní druhy a (v) klad dikotních druhů (obr. 2Ae). Existují jasné náznaky, že duplikované geny EPSPS u Arabidopsis, jabloně, vinné révy, sóji a topolu jsou výsledkem nezávislých duplikačních událostí v rámci jejich linií, přičemž obě kopie se zachovaly v Arabidopsis (Hamberger et al., 2006), nicméně důvod unikátní divergence tohoto genu dráhy je v současné době nejasný.
Chorismate Synthase
Chorismate, konečný produkt šikimátové dráhy, je následně tvořen chorismate synthase (CS), která katalyzuje trans-1,4 eliminaci fosfátu z EPSP. CS jsou řazeny do jedné ze dvou funkčních skupin (i) bifunkční CS houbového typu, které jsou spojeny s NADPH-dependentní flavinreduktázou, nebo (ii) monofunkční CS bakteriálního a rostlinného typu (Schaller et al., 1991; Maeda a Dudareva, 2012). Reakce katalyzovaná CS vyžaduje flavin mononukleotid (FMN) a její celková reakce je redoxně neutrální (Ramjee et al., 1991; Macheroux et al., 1999; Maclean a Ali, 2003). FMN představuje donor elektronů pro EPSP, který usnadňuje štěpení fosfátu. Prvním klonovaným rostlinným genem CS byl gen z C. sempervirens (Schaller et al., 1991), který ve svém genomu obsahuje jediný CS. Vzhledem k tomu, že tento gen má 5′ signální sekvenci pro import do plastidu, naznačují tyto výsledky, že u tohoto druhu nemusí existovat CS mimo plastid. Průzkum dalších druhů ukázal, že jeden až dva geny CS jsou přítomny u zelených řas, lýkožroutů a mechorostů a také u dvouděložných druhů, ale jeden až tři jsou přítomny v genomech jabloní a luštěnin (tabulka 2). Fylogenetická analýza genů CS ukazuje tři hlavní kladie tvořené (i) mikrofyty, (ii) jednoděložnými, (iii) dvouděložnými druhy (obr. 2Af).
Chorismate Mutase
Chorismate mutase katalyzuje první krok biosyntézy fenylalaninu a tyrosinu a navíc představuje klíčový krok směrem k rozdělení větve biosyntézy tryptofanu. CM katalyzuje přeměnu chorismátu na prefenát pomocí Claisenova přeskupení. Bakteriální minoritní CM proteiny (typ AroQ, CM třídy I) vykazují monofunkční enzymatickou aktivitu, zatímco u hub a bakterií bylo navíc nalezeno několik bifunkčních CM, jako jsou CM-PDT, CM-PDH a CM-DAHP (CM třídy II, Euverink et al., 1995; Romero et al., 1995; Chen et al., 2003; Baez-Viveros et al., 2004). Přestože v genomech řas a lýkožroutů je přítomen pouze jeden gen CM, u mechorostů, stejně jako u jednoděložných a dvouděložných druhů, se vyskytuje více kopií genu (dvě až pět) (tab. 2). U semenných rostlin nese CM1 předpokládaný plastidový tranzitní peptid, ale CM2 nikoliv a navíc je obvykle necitlivý na alosterickou regulaci aromatickými aminokyselinami (Benesova a Bode, 1992; Eberhard a kol., 1996; Maeda a Dudareva, 2012). Některé rostlinné druhy, zejména dvouděložné rostliny, mají další gen rodiny CM3, který vykazuje vysokou sekvenční podobnost s CM2, avšak nese předpokládaný plastidový tranzitní peptid. Například Arabidopsis má tři izozymy pojmenované AtCM1 (At3g29200), AtCM2 (At5g10870) a AtCM3 (At1g69370) (Mobley et al., 1999; Tzin a Galili, 2010). Fylogenetická analýza genů CS ukazuje tři hlavní kladi tvořené (i) kladem AtCM2, (ii) kladem mikrofyta a mechorostů a (iii) kladem AtCM2 (obr. 2Ba). Klade iii navíc vykazuje dvě podskupiny, (iii-a) podskupinu AtCM3 a (iii-b) podskupinu AtCM1 (obr. 2Ba) (Eberhard et al., 1996). Přestože podskupina CM2 obsahuje všechny druhy semenných rostlin, jednoděložné druhy nejsou v podskupině AtCM3 obsaženy. V poslední době byl význam CM rozšířen i mimo intracelulární metabolismus, U Zea mays je faktorem virulence chorismát mutáza Cmu1 vylučovaná Ustilago maydis, rozšířeným patogenem, který se vyznačuje vznikem velkých rostlinných nádorů a je obecně známý jako smutnice. Příjem proteinu Ustilago CMu1 rostlinnými buňkami umožňuje přesměrování metabolismu rostlin a mění metabolický stav těchto buněk prostřednictvím metabolického primingu (Djamei et al., 2011). Nyní se ukazuje, že vylučované CM se vyskytují u mnoha mikrobů příbuzných rostlinám a tato forma manipulace s hostitelem se zdá být obecnou zbraní v arzenálu rostlinných patogenů.
Prefenát aminotransferáza a arogenát dehydratáza
Prefenát aminotransferáza (PAT) a arogenát dehydratáza (ADT) katalyzují konečné kroky pro výrobu fenylalaninu. Zatímco ADT byla poprvé klonována v roce 2007 (Cho et al., 2007; Huang et al., 2010), PAT byla klonována teprve nedávno. V pracích publikovaných v roce 2011 byl PAT identifikován u hybridní Petunie, Arabidopsis thaliana a Solanum lycopersicum (Dal Cin et al., 2011; Maeda et al., 2011) a bylo zjištěno, že řídí tok uhlíku z prefenátu na arogenát, ale také že je silně a koordinovaně regulován s geny primárního metabolismu a aromatickými látkami odvozenými od fenylalaninu. U rostlinných druhů byl zjištěn různý počet izoforem PAT. Ačkoli zelené řasy obsahují pouze jednotlivé geny PAT a ADT, jednoděložné druhy mají jeden až dva PAT a dva až čtyři ADT, zatímco genomy dvouděložných rostlin obsahují stejný počet PAT, ale dva až osm ADT (tabulka 2). Fylogenetická analýza genů PAT ukazuje tři hlavní klany (i) mikrofytních, (ii) monokotních a (iii) dikotních druhů (obrázek 2Bb).
Geny zapojené do fenolického sekundárního metabolismu rostlin
Fenolický sekundární metabolismus vykazuje obrovskou chemickou rozmanitost díky evoluci enzymatických genů, které se podílejí na různých biosyntetických a dekorativních drahách. Tato variabilita je způsobena rozmanitostí a redundancí několika klíčových genů fenolického sekundárního metabolismu, jako jsou PKS, cytochromy P450 (CYP), Fe2+/2-oxoglutarát-dependentní dioxygenázy (2ODD) a UDP-glykosyltransferázy (UGT). Na druhé straně existují další obecné biosyntetické geny související s fenylpropanoidy, fenylalanin amoniak-lyáza (PAL), skořicová 4-hydroxyláza (C4H) a 4-kumarát:koenzym A ligáza (4CL), které jsou potřebné pro rozlišení různých tříd fenolického sekundárního metabolismu. Všechny tyto základní geny kódují důležité enzymy, které aktivují řadu hydroxycinamových kyselin a poskytují tak prekurzory pro biosyntézu ligninů, monolignalů a vlastně všech ostatních hlavních fenolických sekundárních metabolitů vyšších rostlin (Lozoya et al., 1988; Allina et al., 1998; Hu et al., 1998; Ehlting et al., 1999; Lindermayr et al., 2002; Hamberger a Hahlbrock, 2004). Protože fenolický sekundární metabolismus vykazuje značnou druhovou specifičnost, je zkoumání genů kódujících odpovědné biosyntetické enzymy často využíváno jako příklad chemotaxonomie pro pochopení evoluce rostlin. Nicméně, vzhledem k tomu, že evoluce těchto genů v izolaci je spíše omezující, hlubší pochopení poskytuje kombinace se zkoumáním evoluce genů pro biosyntézu šikimátu a fenylalaninu v zelené linii.
Závěr
Během dlouhého evolučního období, které zahrnuje období od vodních řas až po suchozemské rostliny, se rostliny přizpůsobily environmentálním nikám pomocí evolučních strategií, jako je genová duplikace a konvergentní evoluce filtrací přírodního výběru. Geny rostlinné biosyntézy šikimátů se vyvíjely odpovídajícím způsobem (obr. 3). V tomto přehledu jsme ukázali, že biosyntetické geny primárního metabolismu aromatických aminokyselin jsou dobře konzervovány mezi řasami a všemi suchozemskými rostlinami. Na rozdíl od druhů řas, které ve svých genomech nemají ani izoformy, ani duplikované geny, však všechny suchozemské rostliny obsahují genové duplikace včetně tandemových genových duplikací, které jsou zvláště výrazné v případě DAHPS, DHQD/SD, CS, CM a ADT (obr. 3A; tab. 2). Naše fylogenetická analýza odhalila jasné oddělení řas, jednoděložných, dvouděložných, dřevin a luštěnin. Analýza přítomnosti a počtu kopií klíčových genů napříč těmito druhy poskytuje několik vodítek, jak zlepšit naše chápání lešení, z něhož se tyto geny vyvinuly. Přesné evoluční tlaky na geny biosyntézy šikimátů včetně jedinečného výskytu komplexu Arom však budou vyžadovat značné další studie. Přesto je zajímavé srovnávat a porovnávat biosyntetické geny těch, které se nacházejí za nimi v produkci rostlinných fenolických látek (obr. 3B). Je zajímavé, že geny šikimátové dráhy jsou všudypřítomné napříč zelenou linií, zatímco to nelze říci o všech navazujících genech biosyntézy fenylpropanoidů. Navíc v rámci biosyntézy fenylpropanoidů dochází k mnohem větší duplikaci genů než v případě biosyntézy šikimátů (obr. 3A; tab. 2). Tato skutečnost se také odráží v úrovni chemické diverzity příslušných drah, přičemž esencialita šikimátové dráhy brání velké diverzitě, ale fenylpropanoidní druhy jsou často vzájemně funkčně nadbytečné. Zdá se pravděpodobné, že fenylpropanoidní dráha původně vznikla prostřednictvím mutací hromadících se v genech šikimátové dráhy. Avšak zatímco tyto byly potenciálně prospěšné u suchozemských rostlin z důvodů, které diskutujeme v našem nedávném přehledu těchto sloučenin (Tohge et al., 2013), nezdá se, že by sdílely esenciálnost šikimátu v celé zelené linii.
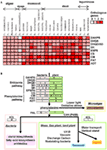
Obrázek 3. Teplotní mapa izoforem genů pro biosyntézu shikimátu a fenylalaninu v genomech rostlin a hypotetické schéma evoluce fenylalaninem odvozeného sekundárního metabolismu fenylu. (A) Přehled heatmap počtu izoforem shikimát-fenylalanin biosyntetických genů u 25 druhů. (B) Hypotetický schematický obrázek pro biosyntetické geny šikimát-fenylalaninu a jejich evoluci fenolického sekundárního metabolismu.
Prohlášení o střetu zájmů
Autoři prohlašují, že výzkum byl prováděn bez jakýchkoli komerčních nebo finančních vztahů, které by mohly být chápány jako potenciální střet zájmů.
Poděkování
Výzkumná činnost Takayuki Tohge je podporována Nadací Alexandra von Humboldta. Za finanční podporu děkujeme Společnosti Maxe Plancka (Takayuki Tohge, Mutsumi Watanabe, Rainer Hoefgen, Alisdair R. Fernie).
Benesova, M., and Bode, R. (1992). Chorismate mutase isoforms from seeds and seedlings of Papaver somniferum [Izoformy chorismát mutázy ze semen a semenáčků Papaver somniferum]. Phytochemistry 31, 2983-2987.
CrossRef Full Text
Fiedler, E., and Schultz, G. (1985). Lokalizace, purifikace a charakterizace šikimát oxidoreduktázy-dehydrochinát hydrolázy ze stromatu špenátových chloroplastů. Plant Physiol. 79, 212-218.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Hamberger, B., Ehlting, J., Barbazuk, B., and Douglas, C. J. (2006). Srovnávací genomika šikimátové dráhy u Arabidopsis, Populus trichocarpa a Oryza sativa: struktura rodiny genů šikimátové dráhy a identifikace kandidátů na chybějící články v biosyntéze fenylalaninu. Recent Adv. Phytochem. 40, 85-113.
CrossRef Full Text
Maclean, J., and Ali, S. (2003). Struktura chorismát syntázy odhaluje novou vazbu flavinu na jedinečnou chemickou reakci. Structure 11, 1499-1511.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Schmid, J., Schaller, A., Leibinger, U., Boll, W., and Amrhein, N. (1992). Prekurzor šikimátkinázy z rajčat syntetizovaný in vitro je enzymaticky aktivní a je importován a zpracován chloroplasty na zralý enzym. Plant J. 2, 375-383.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tzin, V., and Galili, G. (2010). Nové poznatky o cestách biosyntézy šikimátu a aromatických aminokyselin v rostlinách. Mol. Plant 3, 956-972.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
.