Introducere
Calea shikimatului este strâns legată de cea a aminoacizilor aromatici (L-triptofan, L-fenilalanină și L-tirozină) și la plantele terestre suportă fluxuri foarte mari, estimările privind cantitatea de carbon fixat care trece prin această cale variind între 20 și 50% (Weiss, 1986; Corea et al., 2012; Maeda și Dudareva, 2012). O atenție considerabilă a fost acordată cercetării acestei căi, deoarece aminoacizii aromatici nu sunt produși de oameni și de animalele monogastrice și, prin urmare, reprezintă o componentă dietetică importantă (Tzin și Galili, 2010). Mai mult decât atât, una dintre enzimele acestei căi – 5-enolpyruvalshikimate-3-fosfat sintetaza (EPSP) – este unul dintre cele mai utilizate situsuri țintă ale erbicidelor (a se vedea Duke și Powles, 2008). În plus, după cum am descris recent, metaboliții secundari fenolici ai plantelor și precursorii acestora sunt sintetizați prin intermediul căii de biosinteză a șikimatului și a numeroaselor ramificații ale acesteia (Tohge et al., 2013). Calea shikimatului este foarte bine conservată, fiind întâlnită la ciuperci, bacterii și specii de plante, unde operează în biosinteza nu doar a celor trei aminoacizi aromatici descriși mai sus, ci și a nenumăraților metaboliți secundari aromatici, cum ar fi alcaloizii, flavonoidele, ligninele și antibioticele aromatice. Mulți dintre acești compuși sunt bioactivi și joacă, de asemenea, roluri importante în apărarea plantelor împotriva stresului biotic și abiotic și a interacțiunilor de mediu (Hamberger et al., 2006; Maeda și Dudareva, 2012) și, ca atare, sunt foarte importanți din punct de vedere fiziologic. Se estimează că, în condiții normale, până la 20 % din totalul carbonului fixat trece prin calea shikimatului (Ni et al., 1996), cu un flux mai mare de carbon prin această cale în perioadele de stres sau de creștere rapidă a plantelor (Corea et al., 2012). Având în vedere importanța sa, poate că nu este surprinzător faptul că toți membrii genelor biosintetice și enzimele corespunzătoare implicate în calea shikimatului au fost caracterizați la plante model, cum ar fi Arabidopsis. Compararea între specii a enzimelor biosintetice de shikimat a arătat că acestea au o similaritate de secvență, o evoluție divergentă și o comunitate în mecanismele de reacție (Dosselaere și Vanderleyden, 2001). Cu toate acestea, toate celelalte specii diferă considerabil de ciuperci, care au evoluat un sistem complex cu o singură polipeptidă pentafuncțională cunoscută sub numele de complexul AroM, care realizează cinci reacții consecutive (Lumsden și Coggins, 1977; Duncan et al., 1987). În această trecere în revistă vom rezuma cunoștințele actuale cu privire la natura genetică a acestei căi, concentrându-ne pe comparațiile interspecifice care fac legătura între o gamă largă de specii, inclusiv alge (Chlamydomonas reinhardtii, Volvox carteri, Micromonas sp, Ostreococcus tauri, Ostreococcus lucimarinus), mușchi (Selaginella moellendorffii, Physcomitrella patens), monocotiledonate (Sorghum bicolor, Zea mays, Brachypodium distachyon, Oryza sativa ssp. japonica și Oryza sativa ssp. indica) și specii dicotiledonate (Vitis vinifera, Theobroma cacao, Carica papaya, Arabidopsis thaliana, Arabidopsis lyrata, Populus trichocarpa, Ricinus communis, Manihot esculenta, Malus domestica, Fragaria vesca, Glycine max, Lotus japonicus, Medicago truncatula) (tabelul 1). În cele din urmă, comparăm și contrastăm evoluția acestei căi cu cea a căilor mai specializate de biosinteză a fenilpropanoidelor.
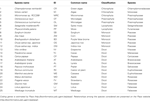
Tabel 1. Rezumat al speciilor utilizate în studiu.
Biosinteza shikimatului și metabolismul secundar derivat din fenilalanină la plante
Dat fiind faptul că metaboliții secundari fenolici care sunt derivați din fenilalanină prin biosinteza shikimatului sunt larg răspândiți în plante și alte eucariote, genele care codifică enzimele biosintetice ale shikimatului sunt, în general, foarte conservate în natură. Opt și două reacții sunt implicate în biosinteza shikimatului și, respectiv, a fenilalaninei. Atât membrii tuturor familiilor de gene, cât și enzimele biosintetice corespunzătoare implicate în aceste căi au fost caracterizate la plante model, cum ar fi Arabidopsis (figura 1A). În schimb, metaboliții secundari fenolici derivați din fenilalanină prezintă o distribuție specifică considerabilă a speciilor, metaboliții secundari fenolici au fost găsiți în regnul vegetal, cum ar fi derivații de cumarină, monolignal, lignină, derivați de spermidină, flavonoide, tanin fiind prezenți în familii specifice în cadrul liniei verzi (Figura 1B). Această diversitate a apărut prin acțiunea diverselor strategii evolutive, de exemplu duplicarea genelor și evoluția cis-regulatoare pentru a se adapta la condițiile de mediu predominante. Având în vedere distribuția lor specifică pentru fiecare specie, genele implicate în metabolismul secundar fenolic al plantelor, cum ar fi fenilamoniaza (PAL), sintetaza polichetidică (PKS), deoxigenazele dependente de 2-oxoglutarat (2ODD) și UDP-glicoziltransferazele (UGT), sunt utilizate frecvent ca studii de caz ale evoluției plantelor (Tohge et al., 2013). În ciuda faptului că genele de biosinteză shikimat-fenilalanină sunt bine conservate în toate speciile, inclusiv în speciile de alge, genele ortologe legate de metabolismul secundar fenolic nu au fost detectate în toate speciile de alge (Tabelul 2, Tohge et al., 2013). Acest rezultat sugerează o origine considerabil mai veche a căilor shikimat-fenilalanină. În secțiunile următoare, vom discuta evoluția căilor shikimat-fenilalanină, concentrându-ne pe comparațiile între specii pentru fiecare genă care codifică una dintre enzimele constitutive ale oricăreia dintre aceste căi.
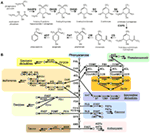
Figura 1. Biosinteza metaboliților secundari derivați de shikimat și fenilalanină la plante. (A) Biosinteza shikimatului pornind de la fosfoenolpiruvat (PEP) și D-eritroză 4-fosfat este descrisă cu gene caracterizate și metaboliți intermediari raportați. (B) biosinteza mebolitului secundar fenilalaninei derivate din fenilalanină, majoritar fenolică, în linia verde. Săgeata indică reacția enzimatică, cercul indică metabolitul. Abrevierea: DAHPS, 3-deoxy-D-arabino-heptulosonat 7-fosfat sintetază; DQS, 3-dehidrochinat sintetază; DHQD/SD, 3-dehidrochinat dehidratăză; SK, shikimat kinază; ESPS, 3-fosfosfozichimat 1-carboxiviniltransferază; CS, corismat sintetază; CM, corismat mutază; PAT, prefenat aminotransferază; ADT, arogenat dehidratăză. PAL, fenilalanină amoniac-liază; C4H, cinamat-4-hidroxilază; 4CL, 4-cumarat CoA ligază; CAD, cinnamil-alcool dehidrogenază; F5H, ferulate 5-hidroxilază; C3H, cumarat 3-hidroxilază; ALDH, aldehidă dehidrogenază; CCR, cinnamoil-CoA reductază; HCT, hidroxicinamoil-Coenzima A shikimat/quinat hidroxicinamoiltransferază; CCoAOMT, cafeoil/CoA-3-O-meteltransferază; CHS, chalcone sinteză; CHI, chalcone izomerază; F3H, flavanonă 3-hidroxilază; F3′H, flavonoid-3′-hidroxilază; F3GT, flavonoid-3-O-glicoziltransferază; FS, flavonoid sintetază; FOMT, flavonoid O-metiltransferază; FCGT, flavone-C-glicoziltransferază; FLS, flavonol sinteză; F3GT, flavonoid-3-O-glicoziltransferază; DFR, dihidroflavonol reductază; ANS, antocianidină sinteză; AGT, flavonoid-O-glicoziltransferază; AAT, antocianină aciltransferază; BAN, oxidoreductază|dihidroflavonol reductază asemănătoare; LAC, lactază.

Tabel 2. Genele biosintetice ale șikimatului și fenilalaninei și omologii din fiecare specie cu/fără gene duplicate în tandem.
3-deoxi-D-arabino-heptulosonat 7-fosfat sinteză
Prima etapă enzimatică a căii shikimatului, 3-deoxi-D-arabino-heptulosonat 7-fosfat sinteză (DAHPS), catalizează o condensare aldolică a fosfoenolpiruvatului (PEP) și a D-eritrozei 4-fosfat (E4P) pentru a produce 3-deoxi-D-arabino-heptulosonat 7-fosfat (DAHP) (figura 1). În funcție de structura lor proteică, DAHPS-urile pot fi grupate în două clase homologice distincte. DAHPS din clasa I, derivate din microbi, conțin un domeniu bifuncțional corismate mutază (CM)-DAHPS, motiv pentru care DAHPS microbiene, de exemplu, E. coli (AroF, G și H) și S. cerevisiae (Aro3 și 4), sunt clasificate ca DAHPS de clasa I. În schimb, se credea anterior că DAHPS de clasa II sunt prezente doar la speciile de plante, dar au fost raportate ulterior la anumiți microbi, cum ar fi Streptomyces coelicolor, Streptomyces rimosus și Neurospora crassa (Bentley, 1990; Maeda și Dudareva, 2012). Activitățile DAHPS (AroA) și CM (AroQ) ale DAHPS din B. subtilis DAHPS sunt, totuși, separate prin trunchierea domeniului. Analiza detaliată a structurii secvenței de structură a familiilor bacteriene AroA și AroQ, studiile enzimatice cu proteina de lungime completă și domeniile trunchiate ale AroA și AroQ de B. subtilis, și compararea cu proteinele de fuziune ale Porphyromonas gingivalis în care domeniul AroQ a fost fuzionat cu terminația C a AroA, sugerează că „reglarea prin feedback” poate fi într-adevăr legătura evolutivă dintre cele două clase care au evoluat de la un membru primitiv nereglementat al clasei II DAHPS (Wu și Woodard, 2006). DAHPS-urile vegetale din clasa II au fost raportate din rădăcinile de morcov (Suzich et al., 1985) și din cultura de celule de cartof (Pinto et al., 1986; Herrmann și Weaver, 1999). DAHPS este codificată de trei gene în genomul Arabidopsis (AtDAHPS1, AT4G39980; AtDAHPS2, At4g33510; AtDAHPS3, At1g22410). Interogările de căutare a genelor ortologe folosind DAHPS-urile din Arabidopsis au evidențiat o singură genă la speciile de alge (Chlamydomonas reinhardtii, Volvox carteri, Micromonas sp. și Ostreococcus tauri) și Lotus japonica, dar două până la opt izoforme la alte specii de plante superioare (tabelul 2). Genele de tip AtDAHPS1 și de tip AtDAHPS2 prezintă o expresie diferențiată în Arabidopsis thaliana, Solanum lycopersicum și Solanum tuberosum (Maeda și Dudareva, 2012). Genele de tip AtDAHPS1, care sunt supuse, în plus, reglementării redox prin sistemul ferredoxină-thioredoxină, prezintă o inducție semnificativă prin rănire și infecție cu agenți patogeni (Keith et al., 1991; Gorlach et al., 1995; Maeda și Dudareva, 2012), în timp ce genele de tip AtDAHPS2 prezintă o expresie constitutivă (Gorlach et al., 1995). O analiză filogenetică a genelor DAHPS relevă patru clade majore, (i) o cladă de microfite, (ii) o cladă de duplicare a briofitelor, (iii) o cladă de specii lemnoase monocotiledonate și dicotiledonate, (iv) o cladă AtDAHPSs (figura 2Aa). Mai mult, clada majoră iv are patru subgrupuri, (iv-a) grupul AtDAHPS2, (iv-b) monocotiledonate, (iv-c) grupul AtDAHPS1 și (iv-d) grupul AtDAHP3. Acest rezultat indică faptul că genele de tip AtDAHPS1 exprimate în mod constitutiv și genele de tip AtDAHPS 3 care răspund la stres prezintă o secvență bine conservată între specii (clada iv-c și iv-d), în timp ce a doua genă de tip AtDAHPS2 exprimată în mod constitutiv este clar separată între speciile monocotiledonate și dicotiledonate (clada iv-a).

Figura 2. Analiza arborelui filogenetic al genelor biosintetice de shikimat și fenilalanină la 25 de specii. Arbori filogenetici ai secvențelor de aminoacizi din (A) calea shikimatului: (a), DAHPS, (b) DHS, (c) DHQD/SD, (d) SK, (e) ESPS, și (f) CS, (B) genele legate de fenilalanină, (a) CM și (b) PAT. Secvențele de aminoacizi ale genelor biosintetice ale shikimatului sunt obținute din baza de date Plaza (http://bioinformatics.psb.ugent.be/plaza/). Relațiile dintre speciile luate în considerare sunt prezentate pe site-ul Plaza. Arborele filogenetic a fost construit cu secvențele de proteine aliniate cu ajutorul MEGA (versiunea 5.10; http://www.megasoftware.net/; Kumar et al., 2004) folosind metoda neighbor-joining cu următorii parametri: corecție Poisson, ștergere completă și bootstrap (1000 de replici, sămânță aleatorie). Secvențele de proteine au fost aliniate prin Plaza. Valorile de pe ramuri indică suportul bootstrap în procente.
3-dehidrochinat sintetază
Cea de-a doua etapă a căii shikimatului este catalizată de 3-dehidrochinat sintetaza (DHQS), o enzimă care promovează schimbul intramolecular al oxigenului inelului DAHP cu carbonul 7 pentru a transforma DAHP în 3-dehidrochinat. Spre deosebire de situația fungică detaliată mai sus, gena DHQS a plantelor este monofuncțională și se găsește într-o singură copie la toate speciile, cu excepția Glycine max, care adăpostește două gene în genomul său (figura 2Ab). Analiza filogenetică a genelor DHQS evidențiază trei clade majore formate din (i) microfite (ii) briofite, (iii) monocotiledonate, (iv) Brassicaceae și (v) specii de dicotiledonate. În mod curios, spre deosebire de alte gene de biosinteză a shikimatului, expresia genei DHQS nu este bine corelată cu producția de fenilpropanoide în Arabidopsis (Hamberger et al., 2006).
3-dehidrochinat dehidratază/chikimat dehidrogenază
3-deoxi-D-arabino-heptulosonat 7-fosfat este transformat în 3-dehidrochinat de către enzima bifuncțională 3-dehidrochinat dehidratază/chikimat dehidrogenază (DHQD/SD), care catalizează mai întâi deshidratarea DAHP în 3-dehidroshikimat și, în consecință, reducerea reversibilă a acestui intermediar în shikimat folosind NADPH ca și cofactor. DHQD/SD există sub trei forme: shikimat dehidrogenazele de clasa I specifice bacteriilor (tip AroE), shikimat/quinat dehidrogenazele de clasa II (tip YdiB) și shikimat dehidrogenazele de clasa III de tip shikimat (tip SHD-L) (Michel et al., 2003; Singh et al., 2005). La plantele din clasa IV, activitatea enzimatică a DHQD este de 10 ori mai mare decât activitatea SD, ceea ce indică faptul că cantitatea de 3-dehidroshikimat va fi mai mult decât suficientă pentru a susține fluxul prin calea shikimatului (Fiedler și Schultz, 1985). Această enzimă bifuncțională joacă un rol important în reglarea metabolismului din mai multe căi metabolice secundare fenolice (Bentley, 1990; Ding et al., 2007). În general, plantele cu semințe conțin în genomul lor o singură genă DHQD/SD care conține o secvență care codifică o peptidă de tranzit plastic (Maeda et al., 2011, tabelul 2). Cu toate acestea, o excepție de la această afirmație este Nicotiana tabacum, care conține două gene în genomul său. În mod intrigant, reducerea la tăcere a NtDHD/SHD-1 duce la o puternică inhibiție a creșterii și la reducerea nivelului de aminoacizi aromatici, a conținutului de acid clorogenic și de lignină (Ding et al., 2007), cu toate acestea, o a doua izoformă citosolică poate compensa producția de shikimat, dar nu la nivel fenotipic. Pe o bază mai generală, analiza filogenetică relevă faptul că microfitele conțin, de asemenea, un număr redus de gene DHQD/SD (între una și două), în timp ce s-a putut observa o separare clară între (i) clada microfitelor, (ii) clada briofitelor, (iii) clada monocotiledonatelor, (iv) clada de duplicare a genelor în tandem specifice speciilor lemnoase și (v) cladele dicotiledonatelor (figura 2Ac; tabelul 2). În mod interesant, observarea cladei de duplicare a genelor în tandem specifice speciilor lemnoase sugerează că aceste specii au evoluat după duplicarea genelor DHQD/SD. Localizarea citosolică a NtDHD/SHD-2 este intrigantă, deoarece a fost raportată prezența DAHP sintetazei, ESPS sintetazei și a izoformelor CM lipsite de secvențe de direcționare plastidică N-terminală (d’Amato, 1984; Mousdale și Coggins, 1985; Ganson et al., 1986). În plus, constatările conform cărora atât ESPS sintetaza, cât și shikimat kinaza (SK) sunt active chiar și atunci când își păstrează secvențele țintă (Dellacioppa et al., 1986; Schmid et al., 1992) sugerează că acestea ar putea fi, de asemenea, constituenți ai unei căi citosolice. În cele din urmă, experimentele în care mitocondriile izolate și foarte pure au fost alimentate cu glucoză marcată cu 13C pentru a investiga legarea izoformelor citosolice ale glicolizei (Giege et al., 2003) au evidențiat, de asemenea, o îmbogățire cu 13C în shikimat (Sweetlove și Fernie, 2013), ceea ce indică faptul că o cale citosolică completă este probabil și în această specie.
Shikimat kinaza
Cea de-a cincea reacție a căii shikimatului este catalizată de SK, care catalizează fosforilarea dependentă de ATP a shikimatului în shikimat 3-fosfat (S3P). E. coli are două SK, una de clasa I (tip AroL) și una de clasa a II-a (tip AroK) care au doar 30% identitate de secvență (Griffin și Gasson, 1995; Whipp și Pittard, 1995; Herrmann și Weaver, 1999). La plante, se găsesc numere diferite de izoforme SK la mai multe specii; doar una la algele verzi, licofite și briofite, dar între una și trei la plantele monocotiledonate și dicotiledonate (tabelul 2). O analiză filogenetică a genelor SK prezintă cinci clade majore formate din (i) microfite, (ii) briofite, (iii) clada specifică speciilor lemnoase dicotiledonate, (iv) clada monocotiledonatelor și (v) clada speciilor dicotiledonate (figura 2Ad). Analiza proteinei SK de la Spinacia olerancea a arătat că aceasta a fost modulată de starea energetică și, prin urmare, este similară cu proteina SK bacteriană și cu alte enzime care utilizează ATP (Pacold și Anderson, 1973; Huang et al., 1975; Schmidt et al., 1990). Din acest motiv, s-a postulat recent că SK poate face legătura cu calea shikimatului care necesită energie pentru echilibrul energetic celular (Maeda și Dudareva, 2012), însă, în prezent, lipsește un sprijin experimental direct pentru această ipoteză. La Arabidopsis, s-a demonstrat că genele omoloage denumite SKL1 și SKL2, care sunt necesare din punct de vedere funcțional pentru biogeneza cloroplastului, au apărut din duplicarea genei SK (Fucile et al., 2008). Ortologii SKL1 și SKL2 au fost găsiți în mai multe specii de plante cu semințe, dar nu și în algele verzi (tabelul 2).
Sintetaza 5-enolipiruvilshiukimat 3-fosfat
Sintetaza 5-enolipiruvilshiukimat 3-fosfat (EPSPS, 3-fosfosfikimat 1-carboxitransferaza) este a șasea etapă și aici un al doilea PEP este condensat cu S3P pentru a forma 5-enolipiruvilshiukimat 3-fosfat (EPSP). Deoarece EPSPS este singura țintă cunoscută pentru erbicidul glifosat (Steinrucken și Amrhein, 1980), izoformele acestei enzime sunt adesea clasificate în funcție de sensibilitatea lor la glifosat, EPSPS clasa I, sensibilă la glifosat, este prezentă în bacterii și specii de plante, în timp ce EPSPS clasa II, insensibilă la glifosat, care a fost raportată la anumite bacterii, cum ar fi Agrobacterium (Fucile et al., 2011). La plante, în mai multe specii se găsește un număr diferit de izoforme EPSPS; doar o singură izoformă în cazul algelor verzi, al licofitelor și al briofitelor, dar una sau două izoforme se găsesc la speciile monocotiledonate și dicotiledonate (tabelul 2). Analiza filogenetică a genelor EPSPS a arătat, în mod atipic pentru genele asociate cu metabolismul shikimatului, că au putut fi observate cinci grupuri majore: (i) microfite, (ii) briofite, (iii) clada specifică Brassicaceae, (iv) specii de monocotiledonate și (v) clada speciilor de dicotiledonate (figura 2Ae). Există indicii clare că genele EPSPS duplicate în Arabidopsis, măr, viță de vie, soia și plop sunt rezultatul unor evenimente de duplicare independente în cadrul liniilor lor, ambele copii fiind menținute în Arabidopsis (Hamberger et al., 2006), cu toate acestea, motivul pentru divergența unică în această genă a căii este în prezent neclar.
Corismat Sintetază
Corismat, produsul final al căii shikimatului, este format ulterior de către corismat sintetaza (CS) care catalizează eliminarea trans-1,4 a fosfatului din EPSP. CS-urile sunt clasificate în cadrul uneia dintre cele două grupe funcționale (i) CS bifuncționale de tip fungic care sunt asociate cu flavin reductaza dependentă de NADPH sau (ii) CS monofuncționale de tip bacterian și vegetal (Schaller et al., 1991; Maeda și Dudareva, 2012). Reacția catalizată de CS necesită mononucleotidă de flavină (FMN), iar reacția sa globală este neutră din punct de vedere redox (Ramjee et al., 1991; Macheroux et al., 1999; Maclean și Ali, 2003). FMN reprezintă furnizează un donor de electroni pentru EPSP care facilitează scindarea fosfatului. Prima genă CS de plantă clonată a fost cea de la C. sempervirens (Schaller et al., 1991), care conține o singură CS în genomul său. Având în vedere că această genă are o secvență semnal de import plastidic 5′, aceste rezultate indică faptul că este posibil să nu existe CS în afara plastidei acestei specii. Cercetarea altor specii a arătat că una până la două gene CS sunt prezente în algele verzi, licofite și briofite, precum și în speciile de dicotiledonate, dar că una până la trei sunt prezente în genomul mărului și al speciilor de leguminoase (tabelul 2). O analiză filogenetică a genelor CS relevă trei clade majore constituite din (i) specii de microfite, (ii) specii de monocotiledonate, (iii) specii de dicotiledonate (Figura 2Af).
Chorismate Mutaza
Chorismate Mutaza catalizează prima etapă a biosintezei fenilalaninei și tirozinei și, în plus, reprezintă o etapă cheie spre divizarea ramurii biosintezei triptofanului. CM catalizează transformarea corisatului în prefenat prin rearanjarea Claisen. Proteinele CM minore bacteriene (de tip AroQ, CM de clasa I) prezintă o activitate enzimatică monofuncțională, în timp ce mai multe CM bifuncționale, cum ar fi CM-PDT, CM-PDH și CM-DAHP, au fost găsite în ciuperci și bacterii (CM de clasa II, Euverink et al., 1995; Romero et al., 1995; Chen et al., 2003; Baez-Viveros et al., 2004). În ciuda faptului că doar o singură genă CM este prezentă în genomul algelor și al licofitelor, mai multe copii ale unei singure gene (două până la cinci) se găsesc în briofite, precum și în speciile monocotiledonate și dicotiledonate (tabelul 2). La plantele cu semințe, CM1 poartă o peptidă de tranzit plastidică putativă, dar CM2 nu și, în plus, este, de obicei, insensibilă la reglarea alosterică prin aminoacizi aromatici (Benesova și Bode, 1992; Eberhard et al., 1996; Maeda și Dudareva, 2012). Mai multe specii de plante, în special plantele dicotiledonate, au o genă suplimentară din familia CM3 care prezintă o mare similitudine de secvență cu CM2, dar care poartă o peptidă de tranzit plastidică putativă. De exemplu, Arabidopsis are trei izozime numite AtCM1 (At3g29200), AtCM2 (At5g10870) și AtCM3 (At1g69370) (Mobley et al., 1999; Tzin și Galili, 2010). Analiza filogenetică a genelor CS relevă trei clade majore constituite din (i) clada AtCM2, (ii) clada microfiților și briofitelor și (iii) clada AtCM2 (Figura 2Ba). În plus, clada iii prezintă două subgrupuri, (iii-a) subgrupul AtCM3 și (iii-b) subgrupul AtCM1 (figura 2Ba) (Eberhard et al., 1996). În ciuda faptului că subgrupul CM2 conține toate speciile de plante cu semințe, speciile de monocotiledonate nu sunt cuprinse în subgrupul AtCM3. Recent, importanța CM a fost extinsă dincolo de metabolismul intracelular, La Zea mays, corismate-mutaza Cmu1 secretată de Ustilago maydis, un agent patogen larg răspândit, caracterizat prin dezvoltarea de tumori mari ale plantelor și cunoscut sub numele de smut, este un factor de virulență. Absorbția proteinei Ustilago CMu1 de către celulele vegetale permite redirecționarea metabolismului vegetal și modifică starea metabolică a acestor celule prin intermediul amorsării metabolice (Djamei et al., 2011). Se pare acum că CM secretate se găsesc în mulți microbi legați de plante, iar această formă de manipulare a gazdei pare a fi o armă generală în arsenalul agenților patogeni ai plantelor.
Prefenat aminotransferaza și arogenat dehidrataza
Prefenat aminotransferaza (PAT) și arogenat dehidrataza (ADT) catalizează etapele finale de producere a fenilalaninei. În timp ce ADT a fost clonată pentru prima dată în 2007 (Cho et al., 2007; Huang et al., 2010), abia mai recent a fost clonată PAT. Lucrările publicate în 2011 au identificat PAT în Petunia hybrid, Arabidopsis thaliana și Solanum lycopersicum (Dal Cin et al., 2011; Maeda et al., 2011) și au stabilit că aceasta direcționează fluxul de carbon de la prefenat la arogenat, dar și că este puternic și coordonat cu genele metabolismului primar și cu genele volatile ale aromei derivate din fenilalanină. La speciile de plante, a fost descoperit un număr diferit de izoforme PAT. Deși algele verzi conțin doar o singură genă PAT și ADT, speciile monocotiledonate au între una și două PAT și între două și patru ADT, în timp ce genomurile plantelor dicotiledonate conțin același număr de PAT, dar între două și opt ADT (tabelul 2). Analiza filogenetică a genelor PAT arată trei clade majore de (i) specii de microfite, (ii) specii de monocotiledonate și (iii) specii de dicotiledonate (Figura 2Bb).
Gene implicate în metabolismul secundar fenolic al plantelor
Metabolismul secundar fenolic prezintă o imensă diversitate chimică datorită evoluției genelor enzimatice care sunt implicate în diferitele căi biosintetice și decorative. O astfel de variație este cauzată de diversitatea și redundanța mai multor gene-cheie ale metabolismului secundar fenolic, cum ar fi PKSs, citocromul P450s (CYPs), dioxigenazele dependente de Fe2+/2-oxoglutarat (2ODDs) și UDP-glicoziltransferazele (UGTs). Pe de altă parte, există și alte gene biosintetice generale legate de fenilpropanoizi, fenilalanină amoniac-liaza (PAL), cinamat 4-hidroxilaza (C4H) și 4-cumarat:coenzima A ligază (4CL), care sunt necesare pentru a diferenția diferitele clase de metabolism secundar fenolic. Toate aceste gene de bază codifică enzime importante care activează o serie de acizi hidroxicinamici pentru a furniza precursori pentru biosinteza ligninelor, a monolignelor și, într-adevăr, a tuturor celorlalți metaboliți secundari fenolici majori din plantele superioare (Lozoya et al., 1988; Allina et al., 1998; Hu et al., 1998; Ehlting et al., 1999; Lindermayr et al., 2002; Hamberger și Hahlbrock, 2004). Deoarece metabolismul secundar fenolic prezintă o specificitate considerabilă a speciilor, investigarea genelor care codifică enzimele biosintetice responsabile este frecvent utilizată ca exemplu de chimiotaxonomie pentru înțelegerea evoluției plantelor. Cu toate acestea, având în vedere că evoluția acestor gene în mod izolat este destul de restrictivă, o înțelegere mai profundă este oferită prin combinarea acesteia cu investigarea evoluției genelor biosintetizante de shikimat-fenilalanină în linia verde.
Concluzie
În timpul perioadei evolutive lungi acoperite de la algele acvatice la plantele terestre, plantele s-au adaptat la nișele de mediu cu ajutorul strategiilor evolutive precum duplicarea genelor și evoluția convergentă prin filtrarea selecției naturale. Genele de biosinteză a shikimatului din plante au evoluat în consecință (figura 3). În această analiză, am demonstrat că genele biosintetice ale metabolismului primar al aminoacizilor aromatici sunt bine conservate între alge și toate plantele terestre. Cu toate acestea, spre deosebire de speciile de alge care nu au nici izoforme, nici gene duplicate în genomurile lor, toate plantele terestre adăpostesc duplicații genetice, inclusiv duplicații genetice în tandem, care sunt deosebit de importante în cazul DAHPS, DHQD/SD, CS, CM și ADT (figura 3A; tabelul 2). Analiza noastră filogenetică a evidențiat o separare clară între alge, monocotiledonate, dicotiledonate, specii lemnoase și plante leguminoase. Analiza prezenței și a numărului de copii ale genelor cheie la aceste specii oferă mai multe indicii cu privire la modul în care putem îmbunătăți înțelegerea noastră a scheletului din care au evoluat aceste gene. Cu toate acestea, presiunile evolutive exacte asupra genelor de biosinteză a shikimatului, inclusiv apariția unică a complexului Arom, vor necesita studii suplimentare considerabile. Acestea fiind spuse, este intrigant să comparăm și să contrastăm genele de biosinteză ale celor din aval de acestea în producția de fenolici din plante (figura 3B). Este interesant faptul că genele căii shikimatului sunt omniprezente în toată linia verde, în timp ce acest lucru nu se poate spune despre toate genele din aval ale biosintezei fenilpropanoidelor. În plus, există o duplicare mult mai mare a genelor în cadrul biosintezei fenilpropanoidelor decât în cadrul biosintezei shikimatelor (figura 3A; tabelul 2). Acest fapt se reflectă, de asemenea, în nivelul de diversitate chimică a căilor respective, esențialitatea căii șikimatului împiedicând o mare diversitate, dar speciile de fenilpropanoide fiind adesea redundante în funcție una față de cealaltă. Ar părea probabil ca calea fenilpropanoidelor să fi apărut inițial prin intermediul mutațiilor care s-au acumulat în genele căii shikimatului. Cu toate acestea, în timp ce acestea au fost potențial benefice la plantele terestre din motive pe care le discutăm în recenta noastră analiză a acestor compuși (Tohge et al., 2013), ele nu par să împărtășească esențialitatea shikimatului la nivelul întregului neam verde.
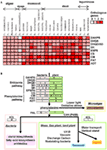
Figura 3. Harta termică pentru izoformele genelor de biosinteză shikimat-fenilalanină în genomurile plantelor și schema ipotetică pentru evoluția metabolismului secundar fenolic derivat de fenilalanină. (A) Privire de ansamblu a hărții heap a numărului de izoforme ale genelor biosintetice shikimat-fenilalanină în 25 de specii. (B) Figură schematică ipotetică pentru genele biosintetice shikimat-fenilalanină și evoluția metabolismului secundar fenolic al acestora.
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Recunoștințe
Activitatea de cercetare a lui Takayuki Tohge este susținută de Fundația Alexander von Humboldt. Finanțarea din partea Max-Planck-Society (pentru Takayuki Tohge, Mutsumi Watanabe, Rainer Hoefgen, Alisdair R. Fernie) este recunoscută cu recunoștință.
Benesova, M., și Bode, R. (1992). Izoformele corismate-mutazei din semințele și răsadurile de Papaver somniferum. Phytochemistry 31, 2983-2987.
CrossRef Full Text
Fiedler, E., și Schultz, G. (1985). Localizarea, purificarea și caracterizarea shikimat oxidoreductazei-dehidrochinat-hidrolază din stroma de spanac-cloroplaste. Plant Physiol. 79, 212-218.
Pubmed Abstract | Pubmed Full Text | Refef Full Text
Hamberger, B., Ehlting, J., Barbazuk, B., and Douglas, C. J. (2006). Comparative genomics of the shikimate pathway in Arabidopsis, Populus trichocarpa and Oryza sativa: shikimate pathway gene family structure and identification of candidates for missing links in phenylalanine biosynthesis. Recent Adv. Phytochem. 40, 85-113.
CrossRef Full Text
Maclean, J., și Ali, S. (2003). Structura corismate sintetazei dezvăluie o nouă flavină care se leagă de o reacție chimică unică. Structure 11, 1499-1511.
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text
Schmid, J., Schaller, A., Leibinger, U., Boll, W., și Amrhein, N. (1992). Precursorul shikimat kinazei de tomate sintetizat in vitro este activ din punct de vedere enzimatic și este importat și transformat în enzima matură de către cloroplaste. Plant J. 2, 375-383.
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text
Tzin, V., și Galili, G. (2010). Noi perspective asupra căilor de biosinteză a shikimatului și a aminoacizilor aromatici în plante. Mol. Plant 3, 956-972.
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text
.