はじめに
シキミテート経路は芳香族アミノ酸(L-tryptophan、L-phenylalanine、L-tyrosine)の経路と密接に結びついていて、陸生植物の場合は非常にフラックスが大きく、経路を通る固定炭素量は20~50%と推定されています(Weiss、1986年。 Corea et al., 2012; Maeda and Dudareva, 2012)。 芳香族アミノ酸は、ヒトや単胃家畜では生産されないため、重要な食事成分であることから、この経路にかなりの研究焦点が当てられている(Tzin and Galili, 2010)。 さらに、この経路の酵素の一つである 5-enolpyruvalshikimate-3-phosphate synthase (EPSP) は、最も広く用いられている除草剤の標的部位の一つである (Duke and Powles, 2008 参照)。 さらに、最近述べたように、植物フェノール性二次代謝物およびその前駆体は、シキミテート生合成の経路とその多数の分岐点を介して合成される(Tohge et al.) シキミメート経路は、菌類、細菌、植物に存在し、高度に保存されており、上記の3つの芳香族アミノ酸だけでなく、アルカロイド、フラボノイド、リグニン、芳香族抗生物質などの無数の芳香族二次代謝物の生合成に関与している。 これらの化合物の多くは生理活性を有するとともに、生物・生物ストレスや環境との相互作用に対する植物の防御に重要な役割を果たしており(Hambergerら、2006;前田・Dudareva、2012)、生理的重要性が高い。 通常の条件下では、全固定炭素の20%がシキミ酸経路を経由すると推定されており(Ni et al.、1996)、植物のストレスや急成長時には、より多くの炭素がこの経路を経由する(Corea et al.、2012)。 その重要性を考えると、シキミ酸経路に関わるすべての生合成遺伝子と対応する酵素が、シロイヌナズナのようなモデル植物で特性評価されていることは驚くべきことではないだろう。 シキミ酸生合成酵素の異種間比較により、配列の類似性、分岐進化、反応機構の共通性が明らかになった(Dosselaere and Vanderleyden, 2001)。 しかし、菌類はAroM複合体と呼ばれる単一の五機能ポリペプチドで5つの連続した反応を行う複雑なシステムを進化させてきた(Lumsden and Coggins, 1977; Duncan et al, 1987)。 この総説では、藻類(Chlamydomonas reinhardtii, Volvox carteri, Micromonas sp.)を含む広範な種にまたがる種間比較に焦点を当てて、この経路の遺伝的性質に関する現在の知見を要約する。 Ostreococcus tauri, Ostreococcus lucimarinus)、コケ(Selaginella moellendorffii, Physcomitrella patens)、単子葉植物(Sorghum bicolor, Zea mays, Brachypodium distachyon, Oryza sativa ssp. indica)、双子葉植物(Vitis vinifera, Theobroma cacao, Carica papaya, Arabidopsis thaliana, Arabidopsis lyrata, Populus trichocarpa, Ricinus communis, Manihot esculenta, Malus domestica, Fragaria vesca, Glycine max, Lotus japonicus, Medicago truncatula)種である(Table1)。 最後に、この経路の進化をフェニルプロパノイド生合成のより特殊な経路の進化と比較対照する。
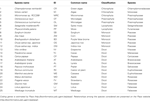
Table 1. 5891>
植物におけるシキミメート生合成とフェニルアラニン由来の二次代謝
フェニルアラニンからシキミメート生合成を経て得られるフェノール性二次代謝物は植物や他の真核生物に広く分布することから、シキミメート生合成酵素をコードする遺伝子は一般的に自然界で高度に保存されていると考えられています。 シキミテートとフェニルアラニンの生合成には、それぞれ8つ、2つの反応が関与している。 これらの経路に関与するすべての遺伝子ファミリーのメンバーおよび対応する生合成酵素は、シロイヌナズナなどのモデル植物で特性評価されている(図1A)。 一方、フェニルアラニン由来のフェノール性二次代謝産物は、植物界ではクマリン誘導体、モノリグナル、リグニン、スペルミジン誘導体、フラボノイド、タンニンなど、緑系統の特定のファミリーに存在し、かなりの種特異的分布を示す(図 1B)。 このような多様性は、環境条件に適応するために、遺伝子重複やシス制御進化などの多様な進化戦略の作用によって生じたものである。 植物の進化の事例として、フェニルアンモニア分解酵素(PAL)、ポリケチド合成酵素(PKS)、2-オキソグルタル酸依存性脱酸素酵素(2ODDs)、UDP-糖転移酵素(UGTs)など、フェノール二次代謝に関わる遺伝子は種特異的に分布することからよく用いられる(Tohge et al, 2013). シキミテート・フェニルアラニン生合成遺伝子は藻類を含むすべての種でよく保存されているにもかかわらず、フェノール二次代謝関連オーソログ遺伝子はすべての藻類で検出されなかった(表2、Tohge et al.) この結果は、シキミテート-フェニルアラニン経路の起源がかなり古いことを示唆している。 次節では、シキミ酸-フェニルアラニン経路の進化について、いずれかの経路の構成酵素をコードする各遺伝子の種間比較に焦点を当てて議論する。 植物におけるシキメイトとフェニルアラニン由来の二次代謝産物の生合成。 (A)ホスホエノールピルビン酸(PEP)とD-エリスロース4-リン酸から始まるシキミテート生合成について、特徴的な遺伝子と中間代謝物の報告とともに説明した。 (B) 緑色系統におけるフェニルアラニン由来の主要なフェノール性二次メボライトの生合成。 矢印は酵素反応、○は代謝物を示す。 略号は DAHPS, 3-deoxy-D-arabino-heptulosonate 7-phosphate synthase; DQS, 3-dehydroquinate synthase; DHQD/SD, 3-dehydroquinate dehydratase; SK, shikimate kinase; ESPS, 3-phosphoshikimate 1-carboxyvinyltransferase; CS, chorismate synthase; CM, chorismate mutase; PAT, prephenate aminotransferase; ADT, arogenate dehydratase.など。 PAL、フェニルアラニンアンモニアリアーゼ;C4H、シンナメート4-ヒドロキシラーゼ;4CL、4-クマレートCoAリガーゼ;CAD、シンナモイル-アルコールデヒドロゲナーゼ;F5H、フェルラート5-ヒドロキシラーゼ;C3H、クマレート3-ヒドロキシラーゼ;ALDH、アルデヒドデヒドロゲナーゼ。 CCR、シンナモイル-CoAレダクターゼ;HCT、ヒドロキシシンナモイル-コエンザイムAシキメイト/キナートヒドロキシシンナモイルトランスフェラーゼ;CCoAOMT、カフェオイル/コア-3-Oメチルトランスフェラーゼ;CHS、カルコンシンセ;CHI、カルコンイソメラーゼ;F3H、フラバノン3-ヒドロキシラーゼ。 F3′H、フラボノイド-3′-水酸化酵素;F3GT、フラボノイド-3-O-グリコシルトランスフェラーゼ;FS、フラボン合成酵素;FOMT、フラボノイドO-メチル転移酵素;FCGT、フラボンC-グリコシルトランスフェラーゼ;FLS、フラボノール合成;F3GT、フラボノイド-3-O-グリコシルトランスフェラーゼ。 DFR, ジヒドロフラボノール還元酵素; ANS, アントシアニジン合成酵素; AGT, フラボノイドO-グリコシルトランスフェラーゼ; AAT, アントシアニンアシルトランスフェラーゼ; BAN, 酸化還元酵素|ジヒドロフラボノール還元酵素様; LAC, ラッカーゼ;など。
表2

表2. タンデム重複遺伝子を持つ/持たない各生物種におけるシキミテートおよびフェニルアラニン生合成遺伝子とホモログ。
3-Deoxy-D-Arabino-Heptulosonate 7-Phosphate Synthase
シキメタ経路の最初の酵素ステップ、3-deoxy-D-アラビノ-ヘプトロソネート7-リン酸シンターゼ(DAHPS). は、ホスホエノールピルビン酸(PEP)とD-エリスロース4リン酸(E4P)のアルドール縮合を触媒し、3-デオキシ-D-アラビノ-ヘプチューン酸7-リン酸(DAHP)を生成します(図1)。 DAHPSは、そのタンパク質構造から、2つの異なる相同性クラスに分類される。 微生物由来のクラスI DAHPSは、2つの機能を持つコリスメートムターゼ(CM)-DAHPSドメインを含んでおり、そのため、例えば大腸菌(AroF、G、H)およびS. cerevisiae(Aro3、4)のような微生物DAHPSはクラスI DAHPSとして分類される。 一方、クラスII DAHPSは、以前は植物種にのみ存在すると考えられていたが、その後、Streptomyces coelicolor、Streptomyces rimosus、Neurospora crassaなどの特定の微生物にも報告されている(Bentley、1990;前田とDudareva、2012)。 しかし、枯草菌DAHPSのDAHPS(AroA)とCM(AroQ)活性は、ドメイン切断により分離されている。 AroAとAroQファミリーの詳細な配列解析、全長タンパク質とB. subtilisのAroAとAroQの切断ドメインを用いた酵素学的研究。 subtilisのAroAとAroQの全長ドメインと切断ドメインを用いた酵素学的研究、そしてPorphyromonas gingivalisのAroQドメインをAroAのC末端に融合させた融合タンパク質との比較から、「フィードバック制御」が、クラスII DAHPSの原始的な非制御メンバーから進化した2クラスの間の進化のリンクである可能性を示唆している (Wu and Woodard, 2006)。 クラスII植物DAHPSはニンジンの根 (Suzich et al., 1985) とジャガイモの細胞培養物から報告されている (Pinto et al., 1986; Herrmann and Weaver, 1999)。 DAHPSはシロイヌナズナゲノム中に3つの遺伝子(AtDAHPS1, AT4G39980; AtDAHPS2, At4g33510; AtDAHPS3, At1g22410)によりコードされている。 シロイヌナズナのDAHPSを用いたオルソログ遺伝子検索では、藻類(Chlamydomonas reinhardtii, Volvox carteri, Micromonas sp., Ostreococcus tauri)やハスでは単一遺伝子だが、その他の高等植物では2〜8種のアイソフォームを発見した(表2)。 AtDAHPS1型とAtDAHPS2型の遺伝子はArabidopsis thaliana, Solanum lycopersicum, Solanum tuberosumで発現が異なる(Maeda and Dudareva, 2012)。 AtDAHPS1型遺伝子はフェレドキシン-チオレドキシン系による酸化還元制御を受け、傷害や病原体感染によって顕著な発現誘導を示すが (Keith et al., 1991; Gorlach et al., 1995; Maeda and Dudareva, 2012), AtDAHPS2型遺伝子は構成的に発現する (Gorlach et al., 1995)。 DAHPS遺伝子の系統解析の結果、(i)微小植物クレード、(ii)蘚苔類重複クレード、(iii)単子葉および双子葉木本種クレード、(iv)AtDAHPSsクレードの4つの主要なクレードが存在する(図2Aa)。 さらに、主要なクレードivは、(iv-a) AtDAHPS2グループ、(iv-b) 単子葉植物、(iv-c) AtDAHPS1グループ、(iv-d) AtDAHP3グループの4つのサブグループを持っていることが判明した。 この結果は、構成的に発現するAtDAHPS1型とストレス応答性のAtDAHPS3型遺伝子は種間でよく保存された配列を示すが(クレードiv-cとiv-d)、第2の構成的に発現するAtDAHPS2型遺伝子は単子葉類と双子葉類の間で明確に分離している(クレードiv-a)ことを示している。

FigURE 2. 25種におけるシキメイトおよびフェニルアラニン生合成遺伝子の系統樹解析。 (A)シキミテート経路のアミノ酸配列系統樹。 (a), DAHPS, (b) DHS, (c) DHQD/SD, (d) SK, (e) ESPS, (f) CS, (B) フェニルアラニン関連遺伝子, (a) CM, (b) PAT.のアミノ酸配列系統樹。 シキミテート生合成遺伝子のアミノ酸配列はPlazaデータベース(http://bioinformatics.psb.ugent.be/plaza/)から取得した。 検討した種間の関係はPlazaのホームページで紹介されている。 整列したタンパク質配列を用いて、MEGA(version 5.10; http://www.megasoftware.net/; Kumar et al., 2004)により、以下のパラメータで近傍結合法を用いて系統樹を作成した。 ポアソン補正、完全削除、ブートストラップ(1000反復、ランダムシード)。 タンパク質配列はPlazaでアライメントした。 枝上の値はブートストラップサポート(%)を示す。
3-Dehydroquinate Synthase
シキメタ経路の第2段階は3-dehydroquinate synthase(DHQS)が触媒し、DAHP環酸素と炭素7の分子内交換を促進しDAHPを3-dehydroquinateに変換する酵素が働いている。 植物のDHQS遺伝子は、上記の真菌の場合とは異なり、単機能で、2つの遺伝子をゲノムに保有するGlycine maxを除くすべての種で1つのコピーとしてのみ見出されている(図2Ab)。 DHQS遺伝子の系統解析の結果、(i)微小植物、(ii)蘚苔類、(iii)単子葉植物、(iv)アブラナ科、(v)双子葉植物からなる3つの大きなクレードが存在することが判明した。 興味深いことに、他のシキミテート生合成遺伝子とは対照的に、DHQS遺伝子の発現はシロイヌナズナのフェニルプロパノイド生産とあまり相関がない(Hamberger et al, 2006).
3-Dehydroquinate Dehydratase/Shikimate Dehydrogenase
3-Deoxy-D-arabino-heptulosonate 7-phosphateは2機能性酵素3-dehydroquinate dehydratase/shikimate dehydrogenase(DHQD/SD)により3-dehydroquinateへ変化される。 は、NADPHを補酵素として、DAHPから3-デヒドロシキメートへの脱水反応と、この中間体のシキメートへの可逆的還元反応を触媒する。 DHQD/SDには、細菌特異的なクラスIシキメートデヒドロゲナーゼ(AroEタイプ)、クラスIIシキメート/キナートデヒドロゲナーゼ(YdiBタイプ)、クラスIIIシキメートデヒドロゲナーゼ様(SHD-Lタイプ)の3種類がある(Michel et al.、2003;Singh et al.、2005)。 植物クラスIVでは、DHQDの酵素活性はSD活性の10倍であり、3-デヒドロシキミ酸の量がシキミ酸経路を通るフラックスを支えるのに十分以上となることを示している(Fiedler and Schultz, 1985)。 この二重機能性酵素は、いくつかのフェノール性二次代謝経路の代謝を調節する重要な役割を担っている(Bentley, 1990; Ding et al.、2007)。 一般に、種子植物は、ゲノム中に可塑性トランジットペプチドをコードする配列を含む単一のDHQD/SD遺伝子を有している(Maeda et al.) しかし、例外的にニコチアナ・タバクイムは、ゲノム中に2つの遺伝子を含んでいる。 興味深いことに、NtDHD/SHD-1のサイレンシングは、強い成長阻害と芳香族アミノ酸、クロロゲン酸、リグニン含量の減少をもたらすが(Ding et al.、2007)、第2の細胞質アイソフォームはシキミートの生産を補うことができるが表現型レベルでは補えない。 系統解析の結果、微小植物にはDHQD/SD遺伝子の数が少なく(1〜2個)、(i)微小植物群、(ii)蘚苔類群、(iii)単子葉類群、(iv)木本類特異的タンデム遺伝子重複群、(v)双子葉類群に明確に分かれている(図 2Ac; 表 2)ことが明らかにされた。 興味深いことに、木本類に特異的なタンデム遺伝子重複クレードが観察されたことから、これらの種はDHQD/SD遺伝子重複の後に進化したことが示唆された。 NtDHD/SHD-2の細胞質局在は、DAHP合成酵素、ESPS合成酵素、N末端プラスミド標的配列を欠くCMアイソフォームの存在が報告されているので興味深い(d’Amato, 1984; Mousdale and Coggins, 1985; Ganson et al., 1986)。 さらに、ESPS合成酵素とシキミメートキナーゼ(SK)は、標的配列を保持していても活性があるという知見(Dellacioppaら, 1986; Schmidら, 1992)から、これらも細胞質経路の構成要素である可能性が示唆された。 最後に、解糖の細胞質アイソフォームの結合を調べるために、単離された高純度ミトコンドリアに13C標識グルコースを供給した実験(Giege et al, 2003)でもシキミテートに13Cが濃縮されていた(Sweetlove and Fernie, 2013)ことから、本種でも完全な細胞質経路が存在すると考えられる。
Shikimate Kinase
シキミテート経路の第5反応は、ATP依存性のリン酸化を行いシキミメート3-リン酸(S3P)とする触媒であるSKによって触媒されている。 大腸菌にはクラスI(AroL型)とクラスII(AroK型)の2種類のSKがあり、配列の相同性は30%しかない(Griffin and Gasson, 1995; Whipp and Pittard, 1995; Herrmann and Weaver, 1999)。 植物では、緑藻類、鱗翅目、蘚苔類では1種のみであるが、単子葉植物と双子葉植物では1〜3種と、異なる数のSKアイソフォームが見つかっている(表2)。 SK遺伝子の系統解析の結果、(i)微小植物、(ii)蘚苔類、(iii)双子葉植物木本類特異的クレード、(iv)単子葉植物クレード、(v)双子葉植物種クレードからなる5大クレードが示された(図2Ad)。 Spinacia oleranceaのSKタンパク質の解析により、SKタンパク質はエネルギー状態によって調節されること、したがって細菌のSKタンパク質や他のATP利用酵素に類似していることが明らかになった(Pacold and Anderson, 1973; Huang et al, 1975; Schmidt et al, 1990)。 このため、近年、SKはエネルギーを必要とするシキミ酸経路と連携して細胞のエネルギーバランスを調節しているのではないかと考えられている(Maeda and Dudareva, 2012)が、この仮説を直接裏付ける実験結果は得られていないのが現状である。 シロイヌナズナでは、葉緑体形成に必要なSKL1とSKL2という相同遺伝子が、SK遺伝子の重複から生じたことが明らかにされている(Fucile et al.、2008)。 SKL1とSKL2のオルソログは、いくつかの種子植物種で見つかっているが、緑藻類では見つかっていない(表2)。
5-enolypyruvylshikimate 3-Phosphate Synthase
5-enolypyruvylshikimate 3-phosphate synthase (EPSPS, 3-phosphoshikimate 1-carboxyvintltransferase) は第6工程で、ここで第2のPEPがS3Pと凝縮して5-enolpyruvylshiukimate 3-phosphate (EPSP) を生成している。 EPSPは除草剤グリホサートの唯一の標的として知られているため (Steinrucken and Amrhein, 1980) 、この酵素のアイソフォームはグリホサートに対する感受性によってしばしば分類される。グリホサート感受性EPSPSクラスIはバクテリアと植物種に存在し、グリホサート非感受性EPSPSクラスIIはアグロバクテリウムなど特定のバクテリアで報告されている (Fucile et al., 2011). 植物では、緑藻類、鱗翅目、蘚苔類では1種類であるが、単子葉類、双子葉類では1種類あるいは2種類と、異なる数のEPSPSアイソフォームが見つかっている(表2)。 EPSPS遺伝子の系統解析の結果、シキミ酸代謝関連遺伝子としては珍しく、(i)微小植物、(ii)蘚苔類、(iii)アブラナ科特異クレード、(iv)単子葉類、(v)双子葉類の5グループに大別できることがわかった(図2Ae)。 シロイヌナズナ、リンゴ、ブドウ、ダイズ、ポプラで重複するEPSPS遺伝子は、それらの系統内で独立した重複事象の結果であり、シロイヌナズナでは両方のコピーが維持されていることが明確に示されている(Hamberger et al,
コリスメート合成酵素
シキミ酸経路の最終産物であるコリスメート酸は、その後、コリスメート合成酵素(CS)によってEPSPからリン酸のトランス1,4脱離が触媒されて生成される。 CSは、NADPH依存性フラビン還元酵素を持つ真菌型二機能性CSと、細菌および植物型単機能性CSに分類される (Schaller et al., 1991; Maeda and Dudareva, 2012)。 CSが触媒する反応はフラビンモノヌクレオチド(FMN)を必要とし、その反応全体は酸化還元的に中性である(Ramjeeら、1991;Macherouxら、1999;MacleanとAli、2003)。 FMNはEPSPに電子供与体として供給され、リン酸の切断を促進させる。 植物のCS遺伝子は、C. sempervirens (Schaller et al., 1991)から初めてクローニングされ、そのゲノム中に唯一のCSが含まれている。 この遺伝子は5′プラスミド輸入シグナル配列を持つことから、この種のプラスティドの外にはCSが存在しない可能性が示された。 他の種を調査したところ、CS遺伝子は緑藻類、蘚苔類、双子葉植物には1〜2個存在するが、リンゴとマメ科のゲノムには1〜3個存在することが判明した(表2)。 CS遺伝子の系統解析の結果、(i)微小植物、(ii)単子葉植物、(iii)双子葉植物からなる3つの主要なクレードが存在する(図2Af)。
Chorismate Mutase
Chorismateムターゼはフェニルアラニン、チロシン合成の第一段階、さらにトリプトファン生合成の分岐の主要段階となる触媒であり、また、トリプトファンの生合成の分岐を触媒している。 CMは、コリスミン酸からプレフェン酸へのクレーゼン転位反応を触媒する。 細菌のマイナーCMタンパク質(AroQ型、クラスI CM)は単機能の酵素活性を示すが、菌類や細菌にはCM-PDT、CM-PDH、CM-DAHPなどの二重機能のCMが見つかっている(クラスII CM、Euverinkら, 1995; Romeroら, 1995; Chenら, 2003; Baez-Viveros ら, 2004)。 藻類や鱗翅目では1種類しか存在しないが、蘚苔類や単子葉・双子葉植物では2〜5種類と、より多くのCM遺伝子が見つかっている(表2)。 種子植物では、CM1は推定されるプラスティド通過ペプチドを持つが、CM2は持たず、さらに通常、芳香族アミノ酸によるアロステリック制御に鈍感である(Benesova and Bode, 1992; Eberhard et al, 1996; Maeda and Dudareva, 2012)。 植物種、特に双子葉植物は、CM2と高い配列類似性を示しながら、プラスティド通過ペプチドと推定されるCM3ファミリー遺伝子をさらに持っている。 例えば、シロイヌナズナには、AtCM1 (At3g29200), AtCM2 (At5g10870), AtCM3 (At1g69370) という3つのアイソザイムがある (Mobley et al., 1999; Tzin and Galili, 2010). CS遺伝子の系統解析の結果、(i)AtCM2クレード、(ii)微小植物と蘚苔類クレード、(iii)AtCM2クレードからなる3つの主要なクレードが存在することが明らかになった(図2Ba)。 さらに、クレードiiiは、(iii-a) AtCM3サブグループと(iii-b) AtCM1サブグループの2つのサブグループを示す(図2Ba)(Eberhard et al.、1996)。 CM2サブグループには種子植物の全種が含まれるにもかかわらず、単子葉植物の種はAtCM3サブグループには含まれない。 近年、CMの重要性は細胞内代謝以外にも拡大され、Zea maysでは、大型の植物腫瘍を形成することで知られるUstilago maydis(通称スマット)が分泌するコリスメートムターゼCmu1が病原因子であることが知られている。 Ustilago CMu1タンパク質が植物細胞に取り込まれると、植物の代謝の経路が変更され、代謝プライミングを介してこれらの細胞の代謝状態が変化する(Djamei et al.、2011年)。
Prephenate Aminotransferase and Arogenate Dehydratase
Prephenate aminotransferase (PAT) と arogenate dehydratase (ADT) はフェニルアラニンの生成の最終ステップを触媒する。 ADTは2007年に初めてクローニングされたが(Cho et al., 2007; Huang et al., 2010)、PATがクローニングされたのはごく最近である。 2011年に発表された論文では、Petunia hybrid, Arabidopsis thaliana, Solanum lycopersicumでPATが同定され (Dal Cin et al., 2011; Maeda et al., 2011) 、プレフェン酸からアロゲン酸への炭素フラックスを誘導すること、また一次代謝やフェニルアラニン由来の香味揮発性の遺伝子と強く協調的に発現上昇することが確立されている。 植物種では、異なる数のPATアイソフォームが見つかっている。 緑藻類は単一のPATとADT遺伝子しか持たないが、単子葉植物は1〜2個のPATと2〜4個のADTを持ち、双子葉植物ゲノムは同じ数のPATを持ちながら2〜8個のADTを持つ(Table 2)。 図2Bb)。
植物のフェノール性二次代謝に関わる遺伝子
フェノール性二次代謝は、様々な生合成経路や装飾経路に関わる酵素遺伝子の進化により、非常に大きな化学的多様性を示している。 このような多様性は、PKS、シトクロムP450(CYP)、Fe2+/2-オキソグルタル酸依存性ジオキシゲナーゼ(2ODDs)、UDP-グリコシルトランスフェラーゼ(UGTs)など、フェノール二次代謝の主要遺伝子が多様かつ冗長なために引き起こされています。 一方、フェニルプロパノイド関連の生合成遺伝子としては、フェニルアラニンアンモニアリアーゼ(PAL)、シンナメート4-ヒドロキシラーゼ(C4H)、4-クマル酸:コエンザイムAリガーゼ(4CL)があり、これらはフェノール二次代謝の各クラス分けに必要である。 これらのコア遺伝子はすべて、多くのヒドロキシ桂皮酸を活性化して、高等植物におけるリグニン、モノリグナル、さらに他のすべての主要なフェノール二次代謝物の生合成のための前駆体を提供する重要な酵素をコードしている(Lozoyaら、1988; Allinaら、1998;Huら、1998; Ehltingら、1999; Lindermayrら、2002; HambergerとHahlbrock、2004)。 フェノール二次代謝は種特異性が高いため、その生合成酵素をコードする遺伝子を調べることは、植物の進化を理解するための化学分類学の一例としてよく利用される。 しかし、これらの遺伝子の進化を単独で考えるのは限界があり、緑色系統のシキミート・フェニルアラニン生合成遺伝子の進化と組み合わせることで、より深い理解が得られると考えられる。 それに伴い、植物のシキミ酸塩生合成遺伝子も進化してきた(図3)。 本総説では、芳香族アミノ酸一次代謝の生合成遺伝子は、藻類と陸上植物の間でよく保存されていることを明らかにした。 しかし、藻類にはアイソフォームや重複遺伝子が存在しないのに対し、陸上植物にはDAHPS、DHQD/SD、CS、CM、ADTに特に顕著なタンデム遺伝子重複を含む遺伝子重複が存在している(図3A;表2)。 系統解析の結果、藻類、単子葉植物、双子葉植物、木本類、マメ科植物が明確に分離していることがわかった。 これらの種における主要遺伝子の存在とコピー数の解析は、これらの遺伝子が進化してきた足場についての理解を深めるためのいくつかのヒントを与えてくれる。 しかし、シキミ酸塩生合成遺伝子に対する正確な進化的圧力は、Arom複合体のユニークな発生を含めて、今後さらにかなりの研究が必要であろう。 とはいえ、植物フェノール類の生産において、その下流に位置する生合成遺伝子を比較対照することは興味深い(図3B)。 興味深いことに、シキミ酸経路の遺伝子は緑色系統全体に遍在しているが、フェニルプロパノイド生合成のすべての下流遺伝子についてはそうとは言い切れない。 さらに、フェニルプロパノイドの遺伝子はシキミテート生合成よりも重複が多い(図3A; 表2)。 この事実は、それぞれの経路の化学的多様性のレベルにも反映されており、シキミ酸塩経路の必須性が多様性を妨げているが、フェニルプロパノイド種はしばしば互いに冗長な機能をもっている。 フェニルプロパノイド経路は、当初はシキミ酸経路の遺伝子に変異が蓄積して生じたと考えられる。 しかし、これらの化合物に関する最近のレビュー(Tohge et al., 2013)で述べた理由により、陸上植物では潜在的に有益であったが、緑色系統全体ではシキメートの必須性を共有していないようだ。 植物ゲノムにおけるシキミート・フェニルアラニン生合成遺伝子のアイソフォームのヒートマップとフェニルアラニン由来のフェノール二次代謝の進化の仮説スキーム。 (A) 25種のシキミテート・フェニルアラニン生合成遺伝子アイソフォーム数のヒープマップの概要。 (B)シキミテート・フェニルアラニン生合成遺伝子とそのフェノール性二次代謝の進化に関する仮説的模式図。
利益相反声明
著者らは、本研究が利益相反の可能性があると解釈される商業的または金銭的関係のない状態で行われたことを宣言する。
謝辞
遠江貴之の研究活動はアレクサンダーフォンフンボルト財団によって支援されています。 また、マックス・プランク協会からの資金援助(Takayuki Tohge, Mutsumi Watanabe, Rainer Hoefgen, Alisdair R. Fernie)に感謝します。
Benesova, M., and Bode, R. (1992). を用いた。 Phytochemistry 31, 2983-2987.
CrossRef Full Text
Fiedler, E., and Schultz, G. (1985)(1998). ホウレンソウ葉緑体間質からのシキメート酸化還元酵素-デヒドロキナートヒドロラーゼの局在、精製、および特性評価。 また、このような研究成果をもとに、植物生理学の分野では、「シキミテート酸化還元酵素-デヒドロキナートヒドロラーゼ」、「シキミテート酸化還元酵素-デヒドロキナートヒドロラーゼ」、「シキミテート酸化還元酵素-デヒドロキナートヒドロラーゼ」、「シキミテート酸化還元酵素-デヒドロキナートヒドロラーゼ」、「シキミテート酸化還元酵素-デヒドロキナートヒドロラーゼ」、「植物生理学 79, 212-218.Pubmed Abstract | Pubmed Full Text |Ref Full Text
Hamberger,B. シロイヌナズナ、Populus trichocarpa、Oryza sativaにおけるシキミ酸経路の比較ゲノム科学:シキミ酸経路遺伝子ファミリー構造とフェニルアラニン生合成におけるミッシングリンクの候補の同定。 最近のAdv. Phytochem. 40, 85-113.
CrossRef Full Text
Maclean, J., and Ali, S. (2003)(2013). コリスメート合成酵素の構造から、ユニークな化学反応に結合する新しいフラビンが明らかになった。 Structure 11, 1499-1511.
Pubmed Abstract | Pubmed Full Text | Refresh Full Text
Schmid, J., Schaller, A., Leibinger, U., Boll, W., and Amrhein, N. (1992)(2012). 試験管内で合成されたトマトのシキミメートキナーゼ前駆体は酵素活性を持ち、葉緑体によって輸入され成熟酵素に加工される。 Plant J. 2, 375-383.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tzin, V., and Galili, G. (2010). 植物におけるシキミテートおよび芳香族アミノ酸の生合成経路に関する新たな知見。 Mol. Plant 3, 956-972.
Pubmed Abstract | Pubmed Full Text | RefRef Full Text