
Peste o treime din cei 7,25 miliarde de oameni de pe glob, inclusiv aproximativ 60 de milioane de persoane din Statele Unite, sunt infectați cronic cu protozoarul Toxoplasma gondii. Un sistem imunitar funcțional poate ține sub control parazitul, astfel încât doar o minoritate dintre cei infectați prezintă simptome semnificative. Dar atunci când o femeie neștiutoare se infectează în timpul sarcinii și transmite parazitul la copilul nenăscut, consecințele pot fi profunde.
Acestea includ leziuni devastatoare ale creierului, sistemului nervos și ochilor. Acum există din ce în ce mai multe dovezi că unii oameni, poate o mulțime de oameni, au simptome mai subtile declanșate de infecție. Poate că răspunsul imunitar, în timp ce ține sub control paraziții, provoacă daune colaterale în altă parte. Sau poate că paraziții, care produc neurotransmițătorul dopamină și interacționează cu celulele pe care le infectează, modifică comportamentul gazdei sale. i-am adresat o mare întrebare unei mari autorități în materie de Toxoplasma gondii și toxoplasmoză, Rima McLeod, MD, profesor de oftalmologie & știința vizuală și pediatrie și director medical al centrului de toxoplasmoză de la Universitatea din Chicago: Ce credem că se întâmplă când miliarde de oameni trec prin viață cu o infecție parazitară a creierului?
Pentru început, ce este Toxoplasma gondii?
Rima McLeod: Toxoplasma gondii este un parazit microscopic înrudit cu parazitul care provoacă malaria. Are mai multe etape ale ciclului de viață.
Este un parazit cu șanse egale. Infectează persoane din întreaga lume, fără a respecta locul, etnia sau statutul socio-economic, deși genetica gazdei joacă un rol important în manifestările infecției.
Și ce se întâmplă cu toxoplasmoza?
Toxoplasmoza se referă la bolile cauzate de acest parazit. Ar trebui să spun paraziți. Aflăm că paraziți diferiți din punct de vedere genetic diferă în ceea ce privește bolile pe care le provoacă, variind adesea în funcție de locația geografică. De exemplu, diferite tipuri genetice de paraziți sunt prezente în diferite regiuni climatice din SUA, provocând o severitate diferită a bolii.
Parazitul poate provoca boala în forma sa acută, activă, atunci când este dobândită de copii mai mari și adulți. Uneori afectează ochiul și, ocazional, inima sau creierul sau provoacă mărirea ganglionilor limfatici. Este cea mai frecventă cauză infecțioasă de distrugere a părții din spate a ochiului. Apoi devine latent, dar poate recruta în forma sa activă distructivă atunci când sistemul imunitar nu este normal, cum ar fi la persoanele cu tumori maligne sau SIDA sau în timpul unui tratament care suprimă sistemul imunitar. În acest caz, parazitul poate afecta creierul sau alte organe.
Când o femeie dobândește infecția pentru prima dată în timp ce este însărcinată și transferă parazitul la făt, aceasta provoacă o infecție parazitară congenitală. Aceasta poate fi o boală teribilă atunci când nu este tratată sau este depistată prea târziu. În acest context, poate provoca pierderea vederii, inflamații grave ale creierului și leziuni neurologice permanente.

Inclusiv atunci când nu există simptome severe la naștere, aceasta poate trece din faza latentă în cea activă și poate provoca noi leziuni la nivelul ochilor și al creierului. De aceea, depistarea infecției la femeile însărcinate este atât de importantă.
Cum contractează oamenii infecția?
Toxoplasma gondii poate infecta majoritatea animalelor cu sânge cald, inclusiv oamenii, dar gazda principală în care are loc schimbul genetic sunt pisicile. Oamenii pot dobândi infecția prin consumul de carne insuficient gătită sau prin ingerarea oochisturilor excretate de pisici, pe legume nespălate, de exemplu, sau din apa contaminată. Contactul nerecunoscut cu oochisturile poate avea loc cu ușurință, deoarece o pisică infectată acut poate excreta până la 500 de milioane de oochisturi Toxoplasma în două săptămâni. Chiar și un singur oochist este infecțios. Aceștia supraviețuiesc în solul cald și umed și în apă timp de un an. Un studiu al Universității Johns Hopkins a constatat că încărcătura anuală de oochisturi măsurată în anchetele comunitare este de trei până la 434 de oochisturi pe picior pătrat. Aceste cifre cresc foarte mult, adaugă ei, „în zonele în care pisicile defulează selectiv”. Acesta este motivul pentru care infecția este atât de frecventă.
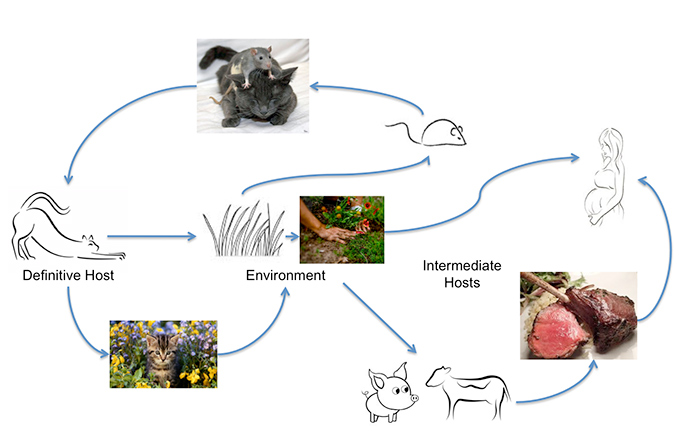
OK. Asta este deranjant. Ce se întâmplă când cineva ingerează câteva oochisturi?
T. gondii este un parazit obligatoriu intracelular. Asta înseamnă că trebuie să infecteze celulele gazdei pentru a supraviețui. Celulele în care preferă să trăiască, atunci când se află în stadiu latent, sunt în creier și în retină, în partea din spate a ochiului. Acesta infectează, apoi se ascunde și se replică lent în aceste celule. Aceasta este o infecție cronică, care durează toată viața.
Ce se întâmplă cu persoanele care sunt normale din punct de vedere imunologic și care nu au fost expuse înainte de naștere, dar care captează paraziți mai târziu?
Mulți medici au considerat aceste cazuri latente sau asimptomatice ca fiind nesemnificative din punct de vedere clinic. În grupul meu de cercetare și în laboratorul meu, ne-am concentrat asupra biologiei infecțiilor active, în special la copii, și asupra celei mai bune modalități de a le preveni sau trata. Cu toate acestea, de mai bine de un deceniu, au existat multiple studii privind modificările subtile, sau nu atât de subtile, ale comportamentelor animalelor asociate cu infecția latentă cu T. gondii. Șoarecii și șobolanii cu o infecție, de exemplu, își pierd aversiunea față de mirosul de pisici, în special față de urina de pisică. Această așa-numită atracție fatală a felinelor este periculoasă pentru orice rozătoare devenită neînfricată din cauza infecției; ea face ca pisicile să le prindă și să le mănânce mai ușor. Dar avantajează pisicile, care dobândesc o masă ușoară, și ajută paraziții, care capătă un nou rezervor.Am constatat că șoarecii infectați cronic au modificări comportamentale suplimentare, cum ar fi înghețarea în câmp deschis, îngrijirea mai puțin bună, pierderea echilibrului și scăderea forței de prindere. Aceste comportamente sunt tipice îmbătrânirii nesănătoase. Creierul șoarecilor infectați cronic este mai mic decât cel al martorilor normali. Am găsit paraziți în chisturi în interiorul neuronilor care au format sinapse. Observăm, de asemenea, un proces inflamator, în special în interiorul și lângă partea creierului asociată cu memoria.

Există un echivalent uman pentru astfel de schimbări de comportament?
Am avut îndoieli, dar nu mai sunt atât de sigur că această schimbare de comportament implică doar rozătoarele. Un studiu recent de la Stanford a arătat modificări ale moleculelor sistemului imunitar în sângele femeilor gravide infectate cronic și acut, modificări care nu au fost prezente la martorii neinfectați și asortați. Un grup de la Universitatea Johns Hopkins a descoperit deficite de memorie subtile, dar specifice, la tinerii profesioniști care aveau anticorpi împotriva parazitului, în comparație cu martorii potriviți. mai multe echipe de cercetare au căutat efecte asupra personalității sau comportamentului la om. Aceste grupuri au descoperit că pacienții cu schizofrenie sau tulburare obsesiv-compulsivă au o probabilitate statistic mai mare de a avea o infecție cu T. gondii. Bărbații infectați au timpi de reacție mai lenți și mai mult de două ori mai multe accidente de circulație. Există, de asemenea, asocieri ale faptului de a avea anticorpi împotriva parazitului cu boala bipolară, comportament suicidar, chiar și o dispoziție optimistă, posibil legată de efectele parazitului asupra dopaminei. O analiză din 2012 din Franța, unde se estimează că 43% dintre oameni sunt purtători de T. gondii, a concluzionat că bărbații cu o infecție latentă tind să fie „mai dogmatici, mai puțin încrezători, mai geloși, mai puțin impulsivi și mai ordonați decât bărbații neinfectați”. Femeile infectate păreau mai calde, mai conștiincioase, mai perseverente, mai nesigure și mai ipocrite.”
Cum se măsoară ipocrizia?
Nu știu ce să cred despre asta, sau despre numeroasele studii de asociere, pentru că este dificil de știut ce a apărut mai întâi: infecția sau trăsătura. Există un om de știință care crede că este un exemplu la prima persoană cu picioarele pe pământ. Cercetătorul ceh Jaroslav Flegr, profesor la Universitatea Charles din Praga, vorbește și scrie despre schimbările pe care le-a observat în propriul comportament după ce a contractat o infecție cu T. gondii. El a susținut că infecțiile latente cu Toxoplasma i-au făcut pe bărbați mai predispuși să se retragă, să devină ostili sau antisociali sau pur și simplu „cârcotași”. Femeile infectate, pe de altă parte, caută consolare prin legături sociale și prin hrănire. Ele sunt înclinate să îngrijească și să se împrietenească. Se știe că Flegr le-a comparat cu „pisicuțele sexuale”. Nu mă întrebați ce legătură are asta cu sfințenia. Acest tip de informații se află în literatura de specialitate, dar nu sunt dovedite definitiv ca fiind o cauză și un efect în prezent.
Din nou, comportamentul cârcotaș poate fi dificil de măsurat, da?
Exact, așa că laboratorul nostru preferă să se concentreze pe înțelegerea modului în care T. gondii își face pagubele, a genelor care inițiază acest proces, precum și a celor care protejează împotriva infecției cu Toxoplasma. Vrem să dezvoltăm medicamente pentru a o vindeca și să facem un vaccin pentru a o preveni. Scopul nostru pe termen lung a fost să înțelegem această boală pentru a îmbunătăți tratamentul și rezultatele. în procesul studiilor noastre genetice, însă, am dat peste multiple conexiuni între căile genetice care ajută la controlul infecției cu T. gondii și cele implicate în bolile neurocomportamentale și în neurodegenerare. Suspectez din ce în ce mai mult că acest parazit – prin intermediul răspunsului sistemului imunitar la el și al interacțiunilor directe ale paraziților cu celulele stem neuronale și diferențiate ale gazdei – influențează aceleași căi ca și cele asociate cu tulburările neurologice, inclusiv cu boala Alzheimer și, posibil, cu autismul. Și indică indicii despre modul în care parazitul ar putea contribui la aceste boli pentru unele persoane susceptibile din punct de vedere genetic expuse la ele.
Cum ați făcut legătura?
Ne-am uitat îndeaproape la genele implicate în protejarea unei gazde de acest parazit. Un studiu din 2006 din Franța a identificat o mică regiune pe cromozomul 10 al șobolanului, numită acum Toxo1. Această regiune conține aproximativ 30 de gene. Ei au descoperit că unele dintre aceste gene joacă un rol central în prevenirea proliferării și răspândirii parazitului în celulele de șobolan. În mod curios, genele care protejează împotriva Toxo proveneau de la șobolanii Lewis, un animal experimental standard, docil, crescut de generații în laborator. Genele care nu reușesc să prevină Toxo sunt comune la șobolanii norvegieni bruni, tipii duri, pe care mulți oameni îi numesc „șobolani de canalizare.” La acea vreme, colegii noștri din Franța, de la universitățile din Grenoble și Toulouse, aveau dificultăți în a determina ce gene din regiune ar putea fi cruciale în acest sens. Munca lor la șobolani ne-a determinat să căutăm similitudini în regiunea genei la oameni. Acest lucru a lansat studiile noastre de urmărire a unui set similar de gene, cu unele diferențe semnificative, pe cromozomul 17 uman.Deceniile noastre de muncă cu pacienții ne-au oferit un avans uriaș. Urmărim aproximativ 250 de familii – fiecare include o mamă, un tată și un copil infectat cu Toxoplasma in utero. În aproximativ 20 dintre aceste familii, avem seturi de gemeni care au fost expuși împreună. În unele cazuri, avem gemeni identici, ambii foarte bolnavi, cu aceleași manifestări ale infecției. În alte cazuri, simptomele sunt minime. În cazurile în care sunt implicați gemeni non-identici, uneori unul dintre cei doi este profund afectat, iar celălalt pare normal. Așadar, știm că moștenirea de la mamă și de la tată a unor variante de gene protectoare sau de susceptibilitate poate face diferența. Acum analizăm îndeaproape fiecare dintre aceste gene și gene suplimentare.
Ce fac aceste gene și ce ați învățat?Tocmai am publicat un articol despre ALOX12 în revista Infection and Immunity. Suntem la începutul procesului de studiere a tuturor genelor, dar rezultatele de până acum sunt fascinante. Am folosit o abordare bazată pe gene candidate. Primele două gene pe care le-am examinat, una de la fiecare capăt al regiunii Toxo1, au prezentat variații care se corelează la un nivel ridicat fie cu susceptibilitatea, fie cu rezistența. Anterior, găsisem acest lucru în gena din partea de jos a regiunii, cunoscută la vremea respectivă sub numele de omidă. În această lucrare actuală, am găsit-o într-o genă din partea de sus a regiunii, numită ALOX12. Aceasta este o genă de moarte celulară.
Tehnic, este o lipoxigenază care adaugă un oxigen toxic și instabil la al 12-lea carbon al acidului arahidonic – creând o moleculă dăunătoare din punct de vedere biologic. Alții găsiseră dovezi că ALOX12 influențează rezultatele în diabet, boli neurodegenerative și schizofrenie, dar nu se știa nimic despre rolul său în bolile infecțioase. când am testat variații ale acestei gene de la diferiți părinți și copii, am descoperit că anumite alele – variații particulare a patru părți ale genei – erau semnificativ diferite și că aceste diferențe erau asociate cu susceptibilitatea. Când am redus ALOX12, activitățile inflamatorii și de moarte celulară care protejează împotriva toxoplasmozei au scăzut. A devenit probabil ca anumite variante ale acestei gene să fie mai eficiente decât altele în declanșarea inflamației și în uciderea celulelor și paraziților infectați și din apropiere. Cu produsul enzimatic al acestei gene a existat un efect mai puternic în menținerea infecției conținute în celulele umane. Fără produsul acestei gene, aceleași celule au fost incapabile să limiteze infecția. Atunci când am testat aceste celule cu gena ALOX12 inactivată, paraziții au proliferat rapid.Cealaltă genă de la celălalt capăt al regiunii, cunoscută sub numele de caterpillar sau NALP1, a avut un efect similar. Am publicat acest lucru în 2011.
Există un dezavantaj al acestor gene antiparazitare agresive?
Acești factori de moarte celulară care se găsesc în acest grup critic de gene numit Toxo1 sunt importanți în limitarea acestei infecții. Dar acum bănuim că o activitate ridicată a acestor gene mai târziu în viață poate avea un efect dăunător, ucigând nu doar celulele gazdă ale paraziților, ci și trecătorii nevinovați. Aceasta este o presupunere, dar ar putea ajuta să explice de ce un polimorfism genetic care pare să joace un rol în apariția bolilor de îmbătrânire, ar putea fi totuși preferat de evoluție pentru capacitatea sa de a preveni sau controla o infecție comună la începutul vieții, în special până la vârsta fertilă.
De ce și-ar concentra aceste gene efectele asupra comportamentului sau a bolilor neurologice?
Toxoplasma infectează celulele nervoase. Anumite versiuni ale ALOX12 și NALP1 pot ajuta o persoană infectată să organizeze un răspuns imunitar puternic, timpuriu și protector, ucigând paraziții, celulele infectate, precum și celulele din apropiere. Dar știm, de asemenea, că ALOX12 este asociat cu boli legate de îmbătrânire și pierderea memoriei. Atunci când am utilizat descoperirile noastre despre ALOX12 cu programe de biologie sistemică, folosite pentru a cartografia căile, ne-am dat seama că multe dintre aceste căi erau, de asemenea, în joc în diverse boli neurodegenerative, cum ar fi Alzheimer și chiar schizofrenia. Unele pot contribui la ateroscleroză sau la diabet. Atunci când acest răspuns imunitar puternic rămâne la datorie, poate avea efecte care ar putea fi dăunătoare. medicamente mai eficiente sau un vaccin ar putea proteja împotriva bolilor devastatoare pe care le provoacă acest parazit. Această lucrare recentă ridică posibilitatea ca tratamente mai bune, prin controlul sau eliminarea rapidă a infecției, să reducă, de asemenea, bolile legate de vârstă pe care noi speculăm că le pot asocia cu toxoplasma pentru unii oameni.
Este un proiect mare. Se pare că aveți o mulțime de parteneri în acest efort, da?
Aceasta a fost o colaborare minunată cu colegi din Franța, Anglia și Canada și o echipă de la Universitatea din Kansas, împreună cu munca unui grup remarcabil de tineri oameni de știință din propriul meu laborator.

Acest lucru este încurajator. Cu cine lucrați pentru a duce mai departe această descoperire?
Lucrăm în cadrul propriilor programe de cercetare și al grupului nostru de laborator și cu colegii din New Haven, Institutul J Craig Ventner și Institutul pentru Biologie Sistemică din Seattle și cu o serie de alți colegi. Suntem foarte entuziasmați de perspectivele și potențialul de a avansa prevenirea și tratamentul pe care le oferă această lucrare.
.