
Près d’un tiers des 7,25 milliards d’habitants de la planète, dont environ 60 millions de personnes aux États-Unis, sont chroniquement infectés par le protozoaire Toxoplasma gondii. Un système immunitaire efficace permet de maîtriser le parasite, de sorte que seule une minorité des personnes infectées présente des symptômes importants. Mais lorsqu’une femme sans méfiance est infectée pendant la grossesse et transmet le parasite à son enfant à naître, les conséquences peuvent être profondes
Elles incluent des dommages dévastateurs au cerveau, au système nerveux et aux yeux. Aujourd’hui, il y a de plus en plus de preuves que certaines personnes, peut-être beaucoup de personnes, ont des symptômes plus subtils déclenchés par l’infection. Peut-être que la réponse immunitaire, tout en maintenant les parasites sous contrôle, provoque des dommages collatéraux ailleurs. Ou peut-être que les parasites, qui produisent le neurotransmetteur dopamine et interagissent avec les cellules qu’ils infectent, modifient le comportement de leur hôte.Nous avons posé une question importante à une autorité de premier plan sur Toxoplasma gondii et la toxoplasmose, Rima McLeod, MD, professeur d’ophtalmologie &science visuelle et de pédiatrie et directrice médicale du centre de toxoplasmose de l’Université de Chicago : Que pense-t-on qu’il se passe lorsque des milliards de personnes traversent la vie avec une infection parasitaire du cerveau ?
Pour commencer, qu’est-ce que le Toxoplasma gondii ?
Rima McLeod : Le Toxoplasma gondii est un parasite microscopique apparenté au parasite qui cause le paludisme. Il a plusieurs étapes de cycle de vie.
C’est un parasite à chances égales. Il infecte des personnes dans le monde entier, sans aucun respect pour le lieu, l’ethnie ou le statut socio-économique, bien que la génétique de l’hôte joue un rôle important dans les manifestations de l’infection.
Et qu’en est-il de la toxoplasmose ?
La toxoplasmose désigne les maladies causées par ce parasite. Je devrais dire les parasites. Nous apprenons que des parasites génétiquement différents diffèrent dans les maladies qu’ils provoquent, variant souvent en fonction de l’emplacement géographique. Par exemple, différents types génétiques de parasites sont présents dans différentes régions climatiques des États-Unis, provoquant une gravité différente de la maladie.
Le parasite peut provoquer une maladie dans sa forme aiguë et active lorsqu’il est acquis par des enfants plus âgés et des adultes. Il endommage parfois l’œil et occasionnellement le cœur ou le cerveau ou provoque une hypertrophie des ganglions lymphatiques. Il est la cause infectieuse la plus fréquente de la destruction du fond de l’œil. Le parasite devient ensuite dormant, mais peut reprendre sa forme active destructrice lorsque le système immunitaire n’est pas normal, par exemple chez les personnes atteintes de tumeurs malignes ou du SIDA ou pendant un traitement qui supprime le système immunitaire. Dans ce cas, le parasite peut endommager le cerveau ou d’autres organes.
Lorsqu’une femme acquiert l’infection pour la première fois alors qu’elle est enceinte et transmet le parasite à son fœtus, cela provoque une infection parasitaire congénitale. Cette maladie peut être terrible si elle n’est pas traitée ou si elle est détectée trop tard. Dans ce cadre, elle peut entraîner une perte de la vue, une inflammation cérébrale grave et des dommages neurologiques permanents.

Même lorsqu’il n’y a pas de symptômes graves à la naissance, il peut passer de la phase dormante à la phase active et causer de nouveaux dommages à l’œil et au cerveau. C’est pourquoi le dépistage de l’infection chez les femmes enceintes est si important.
Comment les gens contractent-ils l’infection ?
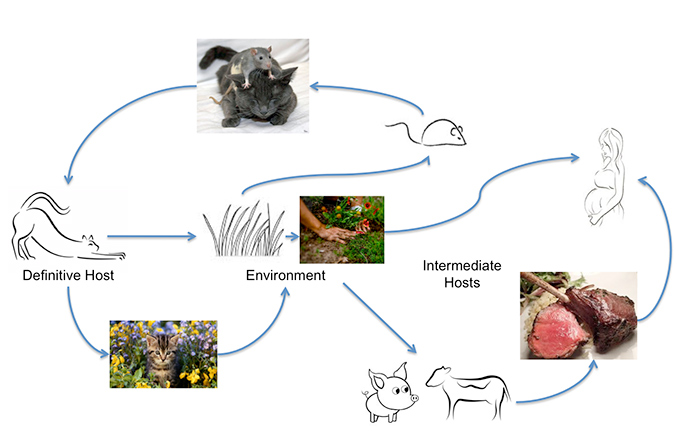
Toxoplasma gondii peut infecter la plupart des animaux à sang chaud, y compris les humains, mais le principal hôte chez qui des échanges génétiques ont lieu est le chat. L’homme peut contracter l’infection en mangeant de la viande mal cuite ou en ingérant des oocystes excrétés par les chats, sur des légumes non lavés, par exemple, ou dans de l’eau contaminée. Un contact non reconnu avec des oocystes peut se produire facilement, car un chat atteint d’une infection aiguë peut excréter jusqu’à 500 millions d’oocystes de Toxoplasma en deux semaines. Même un seul oocyste est infectieux. Ceux-ci survivent dans le sol humide et chaud et dans l’eau pendant un an. Une étude de l’université Johns Hopkins a révélé que la charge annuelle d’oocystes mesurée dans les enquêtes communautaires est de trois à 434 oocystes par pied carré. Ces chiffres augmentent considérablement, ajoutent-ils, « dans les zones où les chats défèquent de manière sélective ». C’est pourquoi l’infection est si courante.
OK. C’est troublant. Que se passe-t-il lorsque quelqu’un ingère quelques oocystes ?
T. gondii est un parasite obligatoirement intracellulaire. Cela signifie qu’il doit infecter les cellules de ses hôtes pour survivre. Les cellules dans lesquelles il préfère vivre, lorsqu’il est à l’état dormant, sont celles du cerveau et de la rétine, à l’arrière de l’œil. Il infecte, puis se cache et se réplique lentement dans ces cellules. C’est une infection chronique, à vie.
Que se passe-t-il pour les personnes immunologiquement normales et qui n’ont pas été exposées avant la naissance qui attrapent des parasites plus tard ?
De nombreux médecins ont considéré ces cas latents ou asymptomatiques comme cliniquement insignifiants. Dans mon groupe de recherche et mon laboratoire, nous nous sommes concentrés sur la biologie des infections actives, en particulier chez les enfants, et sur la meilleure façon de les prévenir ou de les traiter. Cependant, depuis plus d’une décennie, de nombreuses études ont été menées sur les changements subtils, ou pas si subtils, du comportement des animaux associés à une infection latente par T. gondii. Les souris et les rats infectés, par exemple, perdent leur aversion pour l’odeur des chats, en particulier pour l’urine de chat. Cette attirance fatale pour les félins est périlleuse pour tout rongeur rendu intrépide par l’infection ; elle permet aux chats de les attraper et de les manger plus facilement. Nous avons constaté que les souris infectées de façon chronique présentent d’autres changements comportementaux, comme le fait de se figer dans un champ ouvert, de moins bien se toiletter, de perdre l’équilibre et de diminuer la force de préhension. Ces comportements sont typiques d’un vieillissement malsain. Les cerveaux des souris infectées chroniquement sont plus petits que ceux des témoins normaux. Nous trouvons des parasites dans des kystes à l’intérieur des neurones qui avaient formé des synapses. Nous observons également un processus inflammatoire, en particulier à l’intérieur et à côté de la partie du cerveau associée à la mémoire.

Y a-t-il un équivalent humain à de tels changements de comportement ?
J’avais des doutes, mais je ne suis plus aussi certain que ce changement de comportement ne concerne que les rongeurs. Une étude récente de Stanford a montré des changements dans les molécules du système immunitaire dans le sang de femmes enceintes infectées de façon chronique et aiguë, qui n’étaient pas présents chez les témoins appariés non infectés. Un groupe de l’université Johns Hopkins a constaté des déficits de mémoire subtils mais spécifiques chez de jeunes professionnels qui avaient des anticorps contre le parasite, par rapport à des témoins appariés.Plusieurs équipes de recherche ont recherché des effets sur la personnalité ou le comportement chez l’homme. Ces groupes ont constaté que les patients atteints de schizophrénie ou de troubles obsessionnels compulsifs sont statistiquement plus susceptibles d’avoir une infection par T. gondii. Les hommes infectés ont des temps de réaction plus lents, et ont plus de deux fois plus d’accidents de la route. Il existe également des associations entre le fait de posséder des anticorps contre le parasite et la maladie bipolaire, le comportement suicidaire, voire une disposition optimiste, peut-être liée aux effets du parasite sur la dopamine. Une analyse réalisée en 2012 en France, où l’on estime que 43 % des personnes sont porteuses de T. gondii, a conclu que les hommes présentant une infection latente ont tendance à être « plus dogmatiques, moins confiants, plus jaloux, moins impulsifs et plus ordonnés que les hommes non infectés ». Les femmes infectées semblaient plus chaleureuses, plus consciencieuses, plus persistantes, plus peu sûres d’elles et plus moralisatrices. »
Comment mesure-t-on la moralisatrice ?
Je ne sais pas quoi penser de cela, ni des nombreuses études d’association, car il est difficile de savoir ce qui est venu en premier : l’infection ou le trait de caractère. Il y a un scientifique qui pense être un exemple concret à la première personne. Le chercheur tchèque Jaroslav Flegr, professeur à l’université Charles de Prague, parle et écrit sur les changements qu’il a remarqués dans son propre comportement après avoir contracté une infection à T. gondii. Il a affirmé que les infections latentes à Toxoplasma rendaient les hommes plus susceptibles de se replier sur eux-mêmes, de devenir hostiles ou antisociaux, ou carrément « grincheux ». Les femmes infectées, en revanche, recherchent le réconfort dans les liens sociaux et l’éducation. Elles sont enclines à s’occuper d’elles et à se lier d’amitié. Flegr est connu pour les comparer à des « chatons sexuels ». Ne me demandez pas quel est le rapport avec la sainteté. Ce type d’information est dans la littérature mais n’est pas définitivement prouvé comme une cause et un effet à l’heure actuelle.
Encore, le comportement bougon peut être difficile à mesurer, oui ?
Exactement, donc notre laboratoire préfère se concentrer sur la compréhension de la façon dont T. gondii fait ses dégâts, les gènes qui initient ce processus, ainsi que ceux qui protègent contre l’infection par le Toxoplasme. Nous voulons développer des médicaments pour la guérir, et fabriquer un vaccin pour la prévenir. Notre objectif à long terme est de comprendre cette maladie afin d’en améliorer le traitement et les résultats. Cependant, au cours de nos études génétiques, nous avons découvert de multiples connexions entre les voies génétiques qui contribuent à contrôler l’infection par T. gondii et celles qui sont impliquées dans les maladies neurocomportementales et la neurodégénérescence. Je soupçonne de plus en plus que ce parasite – par le biais de la réponse du système immunitaire et des interactions directes des parasites avec les cellules souches et différenciées des neurones de l’hôte – influence les mêmes voies que celles associées aux troubles neurologiques, y compris la maladie d’Alzheimer et peut-être l’autisme. Et cela donne des indices sur la façon dont le parasite pourrait contribuer à ces maladies pour certaines personnes génétiquement sensibles qui y sont exposées.
Comment avez-vous fait le lien ?
Nous avons examiné de près les gènes impliqués dans la protection d’un hôte contre ce parasite. Une étude française de 2006 a identifié une petite région sur le chromosome 10 du rat, désormais appelée Toxo1. Cette région contient environ 30 gènes. Ils ont découvert que certains de ces gènes jouent un rôle central dans la prévention de la prolifération et de la propagation du parasite dans les cellules de rat. Curieusement, les gènes qui protègent contre Toxo proviennent de rats Lewis, un animal standard, docile et expérimental élevé depuis des générations en laboratoire. Les gènes qui ne parviennent pas à prévenir Toxo sont courants chez les rats bruns de Norvège, les durs à cuire, que beaucoup de gens appellent des « rats d’égout ». À l’époque, nos collègues français des universités de Grenoble et de Toulouse avaient du mal à déterminer quels gènes de la région pouvaient jouer un rôle crucial. Leurs travaux sur les rats nous ont amenés à rechercher des similitudes dans la région génétique chez l’homme. C’est ainsi qu’ont été lancées nos études visant à retrouver un ensemble de gènes similaires, avec quelques différences significatives, sur le chromosome 17 humain.Nos décennies de travail avec les patients nous ont donné une avance considérable. Nous suivons environ 250 familles – chacune comprend une mère, un père et un enfant infecté par le toxoplasme in utero. Dans environ 20 de ces familles, nous avons des paires de jumeaux qui ont été exposés ensemble. Dans certains cas, nous avons des jumeaux identiques, tous deux très malades, avec les mêmes manifestations de l’infection. Dans d’autres cas, les symptômes sont minimes. Dans les cas impliquant des jumeaux non identiques, il arrive que l’un des deux soit profondément atteint et que l’autre paraisse normal. Nous savons donc que le fait d’hériter de variantes de gènes de protection ou de susceptibilité de la part de la mère et du père peut faire la différence. Nous examinons maintenant de près chacun de ces gènes et d’autres encore.
Que font ces gènes et qu’avez-vous appris ? Nous venons de publier un article sur ALOX12 dans la revue Infection and Immunity. Nous n’en sommes qu’au début du processus d’étude de tous les gènes, mais les résultats obtenus jusqu’à présent sont fascinants. Nous avons utilisé une approche par gènes candidats. Les deux premiers gènes que nous avons examinés, un à chaque extrémité de la région Toxo1, présentaient des variations qui présentent une corrélation élevée avec la sensibilité ou la résistance. Auparavant, nous avions trouvé cela dans le gène situé au bas de la région, appelé à l’époque « chenille ». Dans cet article, nous l’avons trouvé dans un gène situé en haut de la région, appelé ALOX12. C’est un gène de mort cellulaire.
Techniquement, c’est une lipoxygénase qui ajoute un oxygène toxique et instable au 12ème carbone de l’acide arachidonique – créant une molécule biologiquement nocive. Lorsque nous avons testé des variations de ce gène provenant de différents parents et enfants, nous avons constaté que certains allèles – des variations particulières de quatre parties du gène – étaient significativement différents, et que ces différences étaient associées à la susceptibilité. Lorsque nous avons réduit ALOX12, les activités inflammatoires et de mort cellulaire qui protègent contre la toxoplasmose ont diminué. Il est devenu probable que certaines variantes de ce gène étaient plus efficaces que d’autres pour déclencher l’inflammation et tuer les cellules et les parasites infectés et proches. Avec le produit enzymatique de ce gène, il y avait un effet plus fort pour garder l’infection contenue dans les cellules humaines. Sans le produit de ce gène, les mêmes cellules étaient incapables de contenir l’infection. Lorsque nous avons testé ces cellules avec le gène ALOX12 rendu inactif, les parasites ont proliféré rapidement.L’autre gène à l’autre extrémité de la région, connu sous le nom de caterpillar ou NALP1, a eu un effet similaire. Nous avons publié cela en 2011.
Y a-t-il un inconvénient à ces gènes anti-parasites agressifs ?
Ces facteurs de mort cellulaire que l’on trouve dans ce groupe critique de gènes appelé Toxo1 sont importants pour limiter cette infection. Mais nous soupçonnons maintenant qu’une activité élevée de ces gènes plus tard dans la vie pourrait avoir un effet néfaste, en tuant non seulement les cellules hôtes des parasites mais aussi des passants innocents. Il s’agit d’une conjecture, mais elle pourrait contribuer à expliquer pourquoi un polymorphisme génétique qui semble jouer un rôle dans l’apparition des maladies du vieillissement, pourrait encore être préféré par l’évolution pour sa capacité à prévenir ou à contrôler une infection courante au début de la vie, en particulier jusqu’à l’âge de la procréation.
Pourquoi ces gènes concentreraient-ils leurs effets sur le comportement ou les maladies neurologiques ?
Le toxoplasme infecte les cellules nerveuses. Certaines versions d’ALOX12 et de NALP1 peuvent aider une personne infectée à mettre en place une réponse immunitaire forte, précoce et protectrice, tuant les parasites, les cellules infectées ainsi que les cellules voisines. Mais nous savons aussi qu’ALOX12 est associé à des maladies liées au vieillissement et à la perte de mémoire. Lorsque nous avons utilisé nos découvertes sur ALOX12 avec des programmes de biologie systémique, utilisés pour cartographier les voies, nous avons réalisé que nombre de ces voies étaient également en jeu dans diverses maladies neurodégénératives, comme la maladie d’Alzheimer et même la schizophrénie. Certaines peuvent contribuer à l’athérosclérose ou au diabète. Lorsque cette puissante réponse immunitaire reste à l’œuvre, elle peut avoir des effets néfastes : des médicaments plus efficaces ou un vaccin pourraient protéger contre les maladies dévastatrices causées par ce parasite. Ces travaux récents soulèvent la possibilité que de meilleurs traitements, en contrôlant ou en éliminant rapidement l’infection, puissent également réduire les maladies liées à l’âge que nous spéculons associer à la toxoplasmose pour certaines personnes.
C’est un grand projet. Vous semblez avoir beaucoup de partenaires dans cet effort, oui ?
Ce fut une merveilleuse collaboration avec des collègues en France, en Angleterre et au Canada et une équipe de l’Université du Kansas, ainsi que le travail d’un groupe remarquable de jeunes scientifiques dans mon propre laboratoire.

C’est encourageant. Avec qui travaillez-vous pour faire avancer cette découverte ?
Nous travaillons dans le cadre de nos propres programmes de recherche et de notre groupe de laboratoire, ainsi qu’avec des collègues de New Haven, de l’Institut J Craig Ventner et de l’Institut de biologie des systèmes de Seattle, et un certain nombre d’autres collègues. Nous sommes très enthousiastes quant aux perspectives et au potentiel de progrès en matière de prévention et de traitement que ces travaux apportent.