
Quasi un terzo dei 7,25 miliardi di persone sulla terra, tra cui circa 60 milioni di persone negli Stati Uniti, sono cronicamente infettati dal protozoo Toxoplasma gondii. Un sistema immunitario funzionante può tenere il parassita sotto controllo, quindi solo una minoranza di quelli infettati ha sintomi significativi. Ma quando una donna ignara viene infettata durante la gravidanza e passa il parassita al suo bambino non ancora nato, le conseguenze possono essere profonde. Ora c’è una crescente evidenza che alcune persone, forse molte persone, hanno sintomi più sottili innescati dall’infezione. Forse la risposta immunitaria, mentre tiene sotto controllo i parassiti, causa danni collaterali altrove. O forse i parassiti, che producono il neurotrasmettitore dopamina e interagiscono con le cellule che infetta, modifica il comportamento del suo ospite.Abbiamo chiesto una grande autorità su Toxoplasma gondii e toxoplasmosi, Rima McLeod, MD, professore di oftalmologia & scienza visiva e pediatria e direttore medico del centro toxoplasmosi presso l’Università di Chicago, una grande domanda: Cosa pensiamo succeda quando miliardi di persone attraversano la vita con un’infezione parassitaria del cervello?
Per cominciare, cos’è il Toxoplasma gondii?
Rima McLeod: Toxoplasma gondii è un parassita microscopico legato al parassita che causa la malaria. Ha diversi stadi del ciclo di vita.
Questo è un parassita di pari opportunità. Infetta persone in tutto il mondo, senza alcun rispetto per il luogo, l’etnia o lo status socioeconomico, anche se la genetica dell’ospite gioca un ruolo importante nelle manifestazioni dell’infezione.
E che dire della toxoplasmosi?
La toxoplasmosi si riferisce alle malattie causate da questo parassita. Dovrei dire parassiti. Stiamo imparando che parassiti geneticamente diversi differiscono nelle malattie che causano, spesso variando in base alla posizione geografica. Per esempio, diversi tipi genetici di parassiti sono presenti in diverse regioni climatiche degli Stati Uniti, causando una diversa gravità della malattia.
Il parassita può causare malattie nella sua forma acuta e attiva quando viene acquisito da bambini più grandi e adulti. A volte danneggia l’occhio e occasionalmente il cuore o il cervello o causa l’ingrossamento dei linfonodi. È la causa infettiva più comune della distruzione della parte posteriore dell’occhio. Poi diventa dormiente ma può recrudere nella sua forma distruttiva attiva quando il sistema immunitario non è normale, come nelle persone con tumori maligni o AIDS o durante il trattamento che sopprime il sistema immunitario. In questo caso il parassita può danneggiare il cervello o altri organi.
Quando una donna acquisisce l’infezione per la prima volta mentre è incinta e trasferisce il parassita al suo feto, questo causa un’infezione parassitaria congenita. Può essere una malattia terribile se non trattata o presa troppo tardi. In questo caso, può causare la perdita della vista, una grave infiammazione del cervello e danni neurologici permanenti.

Anche quando non ci sono sintomi gravi alla nascita, può passare dalla fase dormiente a quella attiva e causare nuovi danni all’occhio e al cervello. Ecco perché lo screening per l’infezione nelle donne incinte è così importante.
Come le persone contraggono l’infezione?
Il Texoplasma gondii può infettare la maggior parte degli animali a sangue caldo, compresi gli uomini, ma l’ospite principale in cui avviene lo scambio genetico sono i gatti. Gli esseri umani possono acquisire l’infezione mangiando carne poco cotta o ingerendo oocisti escrete dai gatti, su verdure non lavate, per esempio, o da acqua contaminata. Il contatto non riconosciuto con le oocisti può avvenire facilmente poiché un gatto acutamente infetto può espellere fino a 500 milioni di oocisti di Toxoplasma in due settimane. Anche una sola oocisti è infettiva. Queste sopravvivono nel terreno caldo e umido e nell’acqua per un anno. Uno studio della Johns Hopkins University ha scoperto che il carico annuale di oocisti misurato nelle indagini comunitarie è da tre a 434 oocisti per piede quadrato. Questi numeri salgono, aggiungono, “nelle aree dove i gatti defecano selettivamente”. Ecco perché l’infezione è così comune.
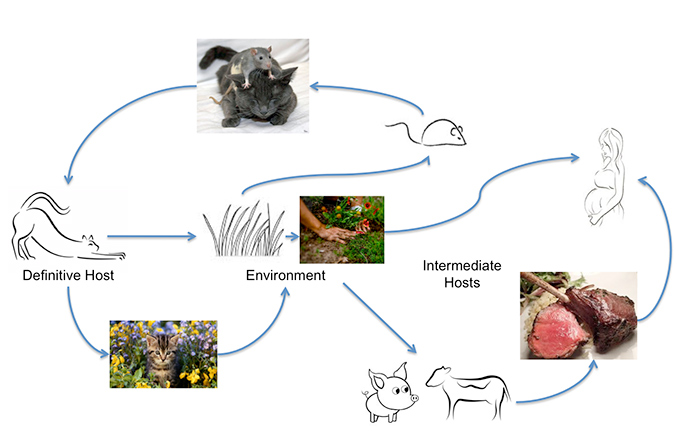
OK. Questo è inquietante. Cosa succede quando qualcuno ingerisce alcune oocisti?
T. gondii è un parassita obbligatoriamente intracellulare. Ciò significa che deve infettare le cellule dell’ospite per sopravvivere. Le cellule in cui preferisce vivere, quando è in fase dormiente, sono il cervello e la retina, nella parte posteriore dell’occhio. Infetta e poi si nasconde e si replica lentamente in quelle cellule. Si tratta di un’infezione cronica, che dura tutta la vita.
Cosa succede alle persone che sono immunologicamente normali e non sono state esposte prima della nascita, ma che in seguito prendono i parassiti?
Molti medici hanno considerato tali casi latenti o asintomatici clinicamente insignificanti. Nel mio gruppo di ricerca e nel mio laboratorio, ci siamo concentrati sulla biologia delle infezioni attive, soprattutto nei bambini, e sul modo migliore per prevenirle o trattarle. Per più di un decennio, tuttavia, ci sono stati molteplici studi di cambiamenti sottili, o non così sottili, nei comportamenti degli animali associati all’infezione latente da T. gondii. Topi e ratti con un’infezione, per esempio, perdono la loro avversione per l’odore dei gatti, specialmente per l’urina di gatto. Questa cosiddetta attrazione fatale felina è pericolosa per qualsiasi roditore reso impavido dall’infezione; rende più facile per i gatti catturarli e mangiarli. Abbiamo scoperto che i topi infettati cronicamente hanno ulteriori cambiamenti comportamentali, come il congelamento in un campo aperto, si puliscono meno bene, perdita di equilibrio e diminuzione della forza di presa. Questi comportamenti sono tipici dell’invecchiamento malsano. I cervelli dei topi infettati cronicamente sono più piccoli di quelli dei controlli normali. Troviamo parassiti in cisti all’interno di neuroni che avevano formato sinapsi. Vediamo anche un processo infiammatorio, specialmente all’interno e vicino alla parte del cervello associata alla memoria.

C’è un equivalente umano a questi cambiamenti di comportamento?
Avevo i miei dubbi, ma non sono più così sicuro che questo cambiamento comportamentale coinvolga solo i roditori. Un recente studio di Stanford ha mostrato cambiamenti nelle molecole del sistema immunitario nel sangue di donne incinte infettate cronicamente e acutamente che non erano presenti nei controlli corrispondenti non infetti. Un gruppo della Johns Hopkins University ha trovato deficit di memoria sottili ma specifici in giovani professionisti che avevano anticorpi contro il parassita, rispetto ai controlli corrispondenti.diversi gruppi di ricerca hanno cercato effetti sulla personalità o sul comportamento negli esseri umani. Questi gruppi hanno scoperto che i pazienti con schizofrenia o disturbo ossessivo-compulsivo sono statisticamente più probabilità di avere un’infezione da T. gondii. Gli uomini infetti hanno tempi di reazione più lenti, e più del doppio degli incidenti stradali. Ci sono anche associazioni di avere anticorpi al parassita con la malattia bipolare, comportamento suicida, anche una disposizione ottimista, possibilmente legati agli effetti del parassita sulla dopamina. Un’analisi del 2012 dalla Francia, dove si stima che il 43 per cento delle persone portano il T. gondii, ha concluso che gli uomini con un’infezione latente tendono ad essere “più dogmatico, meno fiducioso, più geloso, meno impulsivo e più ordinato di uomini non infetti. Le donne infette sembravano più calde, più coscienziose, più persistenti, più insicure e più bigotte”
Come si misura la bigiotteria?
Non so cosa fare di questo, o dei molti studi di associazione, perché è difficile sapere cosa è venuto prima: l’infezione o il tratto. C’è uno scienziato che crede di essere un esempio in prima persona. Il ricercatore ceco Jaroslav Flegr, professore alla Charles University di Praga, parla e scrive dei cambiamenti che ha notato nel suo comportamento dopo aver acquisito un’infezione da T. gondii. Egli ha sostenuto che le infezioni latenti di Toxoplasma hanno reso gli uomini più propensi a ritirarsi, a diventare ostili o antisociali, o del tutto ‘bisbetici’. Le donne infette, d’altra parte, cercano conforto attraverso il legame sociale e il nutrimento. Sono inclini a curare e fare amicizia. Flegr è stato conosciuto per paragonarle a “gattini del sesso”. Non chiedetemi come questo si colleghi alla santificazione. Questo tipo di informazione è in letteratura, ma non definitivamente provato come causa ed effetto al momento.
Ancora una volta, il comportamento bisbetico può essere difficile da misurare, vero?
Esattamente, così il nostro laboratorio preferisce concentrarsi sulla comprensione di come il T. gondii fa i suoi danni, i geni che iniziano questo processo, così come quelli che proteggono dall’infezione da Toxoplasma. Vogliamo sviluppare medicine per curarla e fare un vaccino per prevenirla. Il nostro obiettivo a lungo termine è stato quello di capire questa malattia al fine di migliorare il trattamento e gli esiti. Nel processo dei nostri studi genetici, tuttavia, ci siamo imbattuti in connessioni multiple tra i percorsi genetici che aiutano a controllare l’infezione da T. gondii e quelli implicati in malattie neurocomportamentali e neurodegenerazione. Ho sempre più il sospetto che questo parassita, attraverso la risposta del sistema immunitario ad esso e le interazioni dirette dei parassiti con le cellule staminali e differenziate neuronali dell’ospite, stia influenzando gli stessi percorsi di quelli associati ai disturbi neurologici, tra cui il morbo di Alzheimer e forse l’autismo. E indica indizi su come il parassita potrebbe contribuire a queste malattie per alcune persone geneticamente suscettibili esposte ad esse.
Come avete fatto il collegamento?
Abbiamo guardato da vicino i geni coinvolti nella protezione di un ospite da questo parassita. Uno studio francese del 2006 ha identificato una piccola regione sul cromosoma 10 del ratto, ora chiamata Toxo1. Questa regione contiene circa 30 geni. Hanno scoperto che alcuni di questi geni giocano un ruolo centrale nel prevenire la proliferazione e la diffusione del parassita nelle cellule di ratto. Curiosamente, i geni che proteggono dal Toxo provenivano dai ratti Lewis, un animale standard, docile e sperimentale allevato per generazioni in laboratorio. I geni che non riescono a prevenire la Toxo sono comuni nei ratti norvegesi marroni, i tipi duri, quelli che molte persone chiamano “ratti di fogna”. A quel tempo i nostri colleghi in Francia, alle Università di Grenoble e Tolosa, avevano difficoltà a determinare quali geni all’interno della regione potrebbero essere cruciali in questo. Il loro lavoro sui ratti ci ha portato a cercare somiglianze nella regione genica negli esseri umani. Questo ha lanciato i nostri studi per rintracciare una serie simile di geni, con alcune differenze significative, al cromosoma umano 17. I nostri decenni di lavoro con i pazienti ci hanno dato un enorme vantaggio. Seguiamo circa 250 famiglie – ognuna comprende una madre, un padre e un bambino infettato dal Toxoplasma nell’utero. In circa 20 di queste famiglie, abbiamo serie di gemelli che sono stati esposti insieme. In alcuni casi abbiamo gemelli identici, entrambi molto malati, con le stesse manifestazioni di infezione. In altri casi, i sintomi sono minimi. Nei casi che coinvolgono gemelli non identici, a volte uno dei due è profondamente colpito e l’altro appare normale. Quindi sappiamo che l’eredità di varianti genetiche protettive o di suscettibilità da mamma e papà può fare la differenza. Ora stiamo esaminando da vicino ognuno di questi e altri geni.
Cosa fanno questi geni e cosa avete imparato? Abbiamo appena pubblicato un articolo su ALOX12 nella rivista Infection and Immunity. Siamo all’inizio del processo di studio di tutti i geni, ma i risultati finora sono affascinanti. Abbiamo usato un approccio di geni candidati. I primi due geni che abbiamo esaminato, uno da entrambe le estremità della regione Toxo1, avevano variazioni che si correlano ad alto livello con la suscettibilità o la resistenza. In precedenza, avevamo trovato questo nel gene in fondo alla regione, noto come caterpillar all’epoca. In questo documento attuale, lo abbiamo trovato in un gene nella parte superiore della regione, chiamato ALOX12. Questo è un gene di morte cellulare.
Tecnicamente, è una lipossigenasi che aggiunge un ossigeno tossico e instabile al 12° carbonio dell’acido arachidonico, creando una molecola biologicamente dannosa. Altri avevano trovato prove dell’influenza di ALOX12 nel diabete, nelle malattie neurodegenerative e nella schizofrenia, ma non si sapeva nulla del suo ruolo nelle malattie infettive. Quando abbiamo testato le variazioni di questo gene da diversi genitori e bambini, abbiamo scoperto che alcuni alleli – variazioni particolari di quattro parti del gene – erano significativamente diversi, e che queste differenze erano associate alla suscettibilità. Quando abbiamo ridotto ALOX12, le attività infiammatorie e di morte cellulare che proteggono dalla toxoplasmosi sono diminuite. È diventato probabile che alcune varianti di questo gene fossero più efficaci di altre nell’innescare l’infiammazione e uccidere le cellule infette e vicine e i parassiti. Con il prodotto enzimatico di questo gene c’era un effetto più forte nel mantenere l’infezione contenuta nelle cellule umane. Senza il prodotto di questo gene le stesse cellule non erano in grado di contenere l’infezione. Quando abbiamo testato queste cellule con il gene ALOX12 reso inattivo, i parassiti proliferavano rapidamente. L’altro gene all’altra estremità della regione, noto come caterpillar o NALP1, aveva un effetto simile. Abbiamo pubblicato questo nel 2011.
C’è un lato negativo in questi geni aggressivi anti-parassiti?
Questi fattori di morte cellulare trovati in questo gruppo critico di geni chiamato Toxo1 sono importanti nel limitare questa infezione. Ma ora sospettiamo che l’alta attività di questi geni più tardi nella vita possa avere un effetto dannoso, uccidendo non solo le cellule ospiti dei parassiti ma anche innocenti astanti. Questa è una congettura, ma potrebbe aiutare a spiegare perché un polimorfismo genico che sembra giocare un ruolo nell’insorgenza delle malattie dell’invecchiamento, potrebbe ancora essere preferito dall’evoluzione per la sua capacità di prevenire o controllare un’infezione comune all’inizio della vita, soprattutto fino all’età fertile.
Perché questi geni dovrebbero concentrare i loro effetti sul comportamento o sulle malattie neurologiche? Alcune versioni di ALOX12 e NALP1 possono aiutare una persona infetta a montare una forte risposta immunitaria precoce e protettiva, uccidendo i parassiti, le cellule infette e le cellule vicine. Ma sappiamo anche che ALOX12 è associato a malattie legate all’invecchiamento e alla perdita di memoria. Quando abbiamo utilizzato le nostre scoperte su ALOX12 con programmi di biologia dei sistemi, utilizzati per mappare i percorsi, ci siamo resi conto che molti di questi percorsi erano anche in gioco in varie malattie neurodegenerative, come l’Alzheimer e anche la schizofrenia. Alcuni possono contribuire all’aterosclerosi o al diabete. Quando questa potente risposta immunitaria rimane sul posto di lavoro può avere effetti che potrebbero essere dannosi. medicine più efficaci o un vaccino potrebbero proteggere contro le malattie devastanti che questo parassita causa. Questo recente lavoro solleva la possibilità che trattamenti migliori, controllando o eliminando rapidamente l’infezione, potrebbero anche ridurre le malattie legate all’età che ipotizziamo possano associarsi al toxoplasma per alcune persone.
Questo è un grande progetto. Sembra che lei abbia molti partner in questo sforzo, vero?
Questa è stata una meravigliosa collaborazione con colleghi in Francia, Inghilterra e Canada e un team all’Università del Kansas, insieme al lavoro di un notevole gruppo di giovani scienziati nel mio laboratorio.

Questo è incoraggiante. Con chi state lavorando per portare avanti questa scoperta?
Stiamo lavorando nei nostri programmi di ricerca e nel nostro gruppo di laboratorio e con i colleghi di New Haven, del J Craig Ventner Institute, dell’Institute for Systems Biology di Seattle e di molti altri colleghi. Siamo molto entusiasti delle intuizioni e del potenziale per far progredire la prevenzione e il trattamento che questo lavoro sta fornendo.