Definition of 1p/19q co-deletion
第1染色体の短腕(1p)と第19染色体の長腕(19q)の両方の完全な欠失(1p/19q共欠失)は、成人のびまん性グリオーマ全体のおよそ10~15%を占める原発性脳腫瘍の亜型、オリゴデングリオーマの分子的特徴です1、2。 ハイブリッド染色体の1本が失われると、1pと19qのヘテロ接合性喪失(LOH)となる3。 この分子変化は、1番染色体と19番染色体の間のアンバランスな全腕転座の結果であり3、誘導体t(1p;19q)が失われ、乏突起膠腫の病態の初期に発生するものである。 1994年に初めて報告されたが、1p/19q重複欠失の生物学的効果はまだ不明である。 1p/19q重複欠失は、乏突起膠腫の診断、予後、予測に有用なバイオマーカーである
1p/19q codeletion as a diagnostic biomarker in glioma
1p/19q codeletion is a pathognomonic biomarker that defining a distinct glioma entity 5 and is characterized of oligodendrogliomas 6,7. 事実上、すべての1p/19q欠失性乏突起膠腫は、イソクエン酸脱水素酵素1(IDH1)のアルギニン132(R132)またはIDH2の類似のアルギニン172(R172)残基に変異がある7,8。 1p/19q重複欠失と同時に起こるその他の一般的な分子変化には、テロメラーゼ逆転写酵素(TERT)遺伝子プロモーターの変異、ショウジョウバエのホモログ(CIC)およびfar upstream element binding protein(FUBP1)の変異9、メチルグアニンメチルトランスフェラーゼ(MGMT)遺伝子のプロモーターメチル化8、7が含まれます。 ごく少数の例外を除き、1p/19q重複欠失は、ともに星細胞系のグリア腫瘍を特徴づけるTP53およびATRXの変異とは相互に排他的である
したがって、1p/19q重複欠失の評価は、IDH変異の状態および他の分子マーカー(例えば 2046>
臨床的観点から、1p/19q-co-deleted乏突起膠腫は主に成人期の腫瘍であり、4~60歳代に発生率がピークとなる。 これらの腫瘍は痙攣を呈する傾向があり、典型的には前頭葉に発生し、一部の腫瘍は脳画像で検出可能な石灰化を伴う。
グリオーマの予後バイオマーカーとしての1p/19q共欠失
1p/19q共欠失の存在は、びまん性低悪性度腫瘍と退形成腫瘍の両方において生存率の改善と関連する強力な独立予後バイオマーカーである 3,7,10,11,12.
すべてのびまん性グリオーマの中で、1p/19q-共欠失が見られる患者は最も好ましい予後である 13,7,14.14. The Cancer Genome Atlas Research Network(TCGA)が行った大規模なマルチオミクスと臨床のレトロスペクティブ解析では、IDH変異と1p/19q-co-deletionを有するグレードⅡ/Ⅲのグリオーマの患者の全生存期間の中央値は8.0年であり、それに対して、6.0年であった。IDH変異があり1p/19q-co-deletionがない患者では6.3年、野生型IDH 7の患者では1.7年であった
1p/19q co-deletion as a predictive biomarker in glioma
1p/19q co-deletion has predictive value for response to chemotherapy in anaplastic oligodendrogliomas.Oncol. プロカルバジン/ロムスチン/ビンクリスチン(PCV)化学療法と放射線療法の併用と放射線療法単独を比較した2つの大規模ランダム化比較試験の延長フォローアップでは、1p/19q-co欠失の乏突起膠腫では初回化学療法の生存優位性が示された15,16。 368人の患者を放射線療法または放射線療法後にPCVを行う群に無作為に割り付けたEORTC 26951試験の長期解析では、1p/19q-co欠失性腫瘍患者の全生存期間中央値は放射線療法単独群では9.3年だったが、放射線療法とPCVを併用した群ではまだ達していなかった15. 289人の患者が放射線治療またはPCVの後に放射線治療を受けたRTOG 9402試験の同様の解析では、PCVと放射線治療を受けた1p/19q-co-deleted腫瘍の患者の全生存期間中央値は7.3年から14.7年に倍増している16。
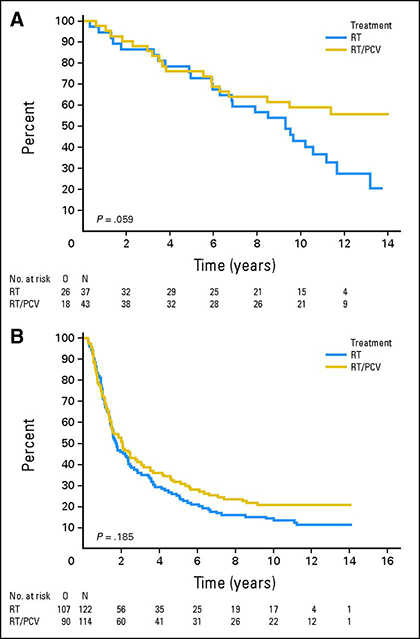
1p/19q欠失腫瘍(A)または非欠失腫瘍(B)の患者における放射線治療(RT、青曲線)または放射線治療+PCV(RT/PCV、黄色曲線)による患者の全生存期間15.
同様に、無作為化第III相試験RTOG 9802において、「高リスク」グレードII乏突起膠腫患者(すなわち、亜全切除または生検を受けた40歳未満の患者、または40歳以上の患者)で放射線治療とPCVを受けた患者は、放射線治療のみを受けた患者と比較して全生存期間が長い 17.
グリオーマにおける1p/19q共欠失検査
2016年世界保健機関(WHO)中枢神経系腫瘍分類によると、グレードIIおよびグレードIII(退形成)オリゴデングリオーマの確定診断には、IDH遺伝子ファミリー変異と1p/19q共欠失6の両方を証明することが必要であるとされています。 蛍光in situハイブリダイゼーション(FISH)は、ホルマリン固定パラフィン包埋(FFPE)組織切片の最小量の腫瘍細胞で異常を検出することができる、信頼性と費用対効果の高い方法である。 二重蛍光標識DNAプローブを用いて、非染色スライドに転写されたFFPE組織切片から個々の神経膠腫細胞の間期核内の1pおよび19q遺伝子座を検出する。 コントロールと比較した1pおよび19qプローブ信号の変化は、1p/19q-co-deletionの存在を決定するために使用される。 1番染色体および19番染色体の状態は、別々のスライドで、50〜100個の重ならない間期核におけるテストプローブおよびコントロールプローブの分布を分析することにより評価される18。 FISHの結果は、欠失シグナルを持つ腫瘍細胞の割合、あるいは各染色体のテストプローブとコントロールプローブの比率として表現することができる18。 1pと19qの両方が欠失した場合、1p/19q共欠失が報告される。
現在入手可能な1pおよび19q FISHプローブとそれらが対象とする染色体座位の間にはばらつきが存在する。 ある検査室では市販のFISHプローブを使用し、他の施設では独自に社内で製造している18。 さらに、18番染色体欠失を判定するための定義やカットオフ値にもばらつきがある。 染色体欠失のカットオフ値に近いボーダーラインの結果は、再検査や追加技術による解明が必要かもしれません。 1p/19q co-deletionの状態が臨床的に重要であることを考えると、検査室内および検査室間で再現性のある評価を保証するために、FISHプロトコルを標準化することが重要である。 欧州神経病理学会(Euro-CNS)の研究委員会は、FISHによる1p/19qの状態解析を支援する実用的な勧告を発表している19。
FISHは、1p/19q欠失性乏突起膠腫に特徴的なcentromeric breakpointを伴う染色体アーム全体の欠失と、より小さな局所的欠失を区別することができない。 この区別は、乏突起膠腫のサブタイプにおいて、1p/19q全腕共欠失が生存率の改善および化学療法への反応と関連していることから、重要であると考えられる。 Array comparative genomic hybridisation(aCGH)およびsingle nucleotide polymorphism(SNP)アレイは、1pまたは19qの全腕の欠損を高い信頼性で同定できるため、可能な場合はFISHよりも優先して使用されることがある。 しかし、FISHと比較して、これらの技術はより労力がかかる傾向があり、より高い割合の腫瘍細胞を必要とする18.
aCGH は高解像度レベルでゲノムコピー数の変化を検出する技術である。 検査試料と対照試料から抽出したDNAを異なる蛍光色素で標識し、混合して数千のプローブとハイブリダイズさせる。 デジタル画像処理システムを用いて、各プローブとハイブリダイズした標識DNAの蛍光強度を定量する。 ゲノム上の異なる位置でのテストとコントロールのハイブリダイゼーション信号の蛍光比が決定され、正常ゲノムと比較したテストゲノム中の配列の相対的コピー数に関する情報が得られる。 この方法により、アレイ上にプロットされた任意の遺伝子座の染色体異数性、欠失、重複、増幅を同時に検出することができる。
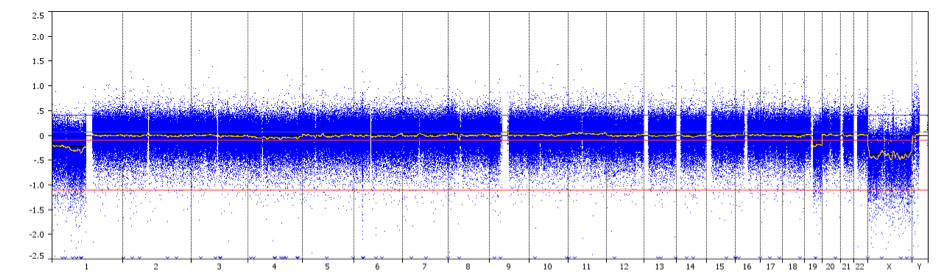
aCGH profile showing 1p/19q whole-arm codeletion with centromeric breakpoints (arrow) in a grade II oligodendroglioma.
Credit: Professor Marc Sanson.(英語)
最後に、ポリメラーゼ連鎖反応ベースのマイクロサテライト解析-選択した遺伝子座におけるLOHの検出が可能-、次世代シーケンス-NGSベースの手法も1p/19q状態の評価に使用可能である。
患者選択
欧州のガイドラインでは、乏突起膠腫の診断を裏付けるため、またこれらの患者の化学感受性と予後を予測するために1p/19q-co欠失を評価することが推奨されている5,20。 EORTC 26951とRTOG 9402試験の結果に基づき、1p/19q-co-deleted未分化乏突起膠腫の患者は放射線治療単独ではなく、放射線治療とともに早期アルキル化化学療法を受けるべきである 20. また、グレードⅡの乏突起膠腫患者のサブセットにおいても同様のアプローチを検討すべきである。
内科的治療を開始する必要がある場合、放射線治療とPCVの併用による治療効果の大きさはかなりのものであるが、毒性効果は併用した患者の方が大きい。 標準的な放射線治療+PCVと比較して、先行化学療法単独または放射線治療+テモゾロミド併用療法の価値を評価する臨床試験が進行中である」
主要文献
- Ostrom QT, Bauchet L, Davis FG, et al. The epidemiology of glioma in adults: a “state of the science” review.成人の神経膠腫の疫学:「科学の現状」レビュー。 Neuro Oncol 2014; 16(7):896-913.
- Ibdaih A, Marie Y, Pierron G, et al. 2 types of chromosome 1p losses with opposite significance in gliomas.グリオーマにおける2種類の1p染色体欠損。
- Jenkins R, Blair H, Ballman K, et al. t(1;19)(q10;p10) は1pと19qの複合欠失を仲介して、乏突起膠腫患者の予後を予測する。 Cancer Res 2006; 66: 9852-61.
- Reifenberger J, Reifenberger G, Liu L, et al. Molecular genetic analysis of oligodendroglial tumors shows preferential allelic deletions on 19q and 1p.All Rights Reserved.乏突起膠腫の分子遺伝学的解析は19qと1pに優先的に欠失があることを示す。 5487>
- Stupp R, Brada M, van den Bent M, et al.高悪性度グリオーマ。 診断、治療、フォローアップのためのESMO臨床実践ガイドライン。 Ann Oncol 2014;25 (Suppl 3): iii93-101.
- Louis D, Perry A, Reifenberger G. et al. 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary.「中枢神経系腫瘍の2016年世界保健機関分類:概要」(日本評論社). Acta Neuropathologica 2016; 131: 803-20.
- がんゲノムアトラス研究ネットワーク、Brat D、Verhaak R、他、びまん性下級グリオーマの包括的、統合的ゲノム解析。 N Engl J Med 2015; 372: 2481-98.
- サンソンM、マリーY、パリS、他、イソクエン酸脱水素酵素1コドン132変異はグリオーマにおける重要な予後バイオマーカーである。 J Clin Oncol 2009; 27: 4150-54.
- Bettegowda C, Agrawal N, Jiao Y, et al. CICとFUBP1における変異はヒト乏突起膠腫に寄与しています。 Science 2011; 333(6048): 1453-5.
- Zhao J, Ma W, Zhao H. Loss of heterozygosity 1p/19q and survival in glioma: a meta-analysis.The loss of heterozygosity 1p/19q in the glioma. Neuro-Oncology 2014; 16: 103-112.
- van den Bent M, Carpentier A, Brandes A, et al. Adjuvant procarbazine, lomustine, and vincristine improve progression-free survival but not overall survival in newly diagnosed anaplastic oligodendrogliomas and oligoastrocytomas: a randomized European Organisation for Research and Treatment of Cancer phase III trial.副次的に、副次的には無増悪生存期間を改善するプロカルバジン、ロムスチン、ビンクリスチンの投与が、新規診断乏突起膠腫と乏突起星細胞腫における全生存期間を改善する。 J Clin Oncol 2006; 24: 2715-22
- Cairncross G, Berkey B, Shaw E, et al. 純粋および混合未分化乏突起膠腫に対する化学療法+放射線療法と放射線療法単独の比較第III相試験。 Intergroup Radiation Therapy Oncology Group Trial 9402。 J Clin Oncol 2006; 24: 2707-14.
- Wiestler B, Capper D, Sill M, et al. Integrated DNA methylation and copy-number profiling identify three clinically and biologically relevant groups of anaplastic glioma.(統合DNAメチル化およびコピー数プロファイリングにより、未分化グリオーマの3つの臨床的および生物学的に関連するグループを特定。 Acta Neuropathologica 2014; 128:561-71.
- Ceccarelli M, Barthel FP, Malta TM, et al. Molecular Profiling Reveals Biologically Discrete Subsets and Pathways of Progression in Diffuse Glioma.「分子プロファイリングは、びまん性グリオーマの進行に関する生物学的に個別のサブセットと経路を明らかにする」。 Cell 2016; 164(3): 550-63.
- van den Bent M, Brandes A, Taphoorn M, et al. 新規診断の退形成性乏突起膠腫におけるプロカルバジン、ロムスチン、ビンクリスチン補助化学療法:EORTC脳腫瘍グループ研究26951の長期フォローアップ.EORTC脳腫瘍グループ研究26951. J Clin Oncol 2013; 31:344-50.
- Cairncross G, Wang M, Shaw E, et al. 貧乳性乏突起膠腫に対する化学放射線療法の第III相試験: RTOG 9402の長期結果.J Clin Oncol 2013; 31:344-50.
- Cairncross G, Wang M, Shaw E, et al. J Clin Oncol 2013; 31: 337-43.
- Buckner JC, Shaw EG, Pugh SL, et al. Radiation plus Procarbazine, CCNU, and Vincristine in Low-Grade Glioma.(放射線とプロカルバジン、CCNU、ビンクリスチンの併用療法、低悪性度グリオーマ). N Engl J Med 2016; 374: 1344-1355.
- Woehrer A, Sander P, Baberler C, et al. FISH-based detection of 1p 19q codeletion in oligodendroglial tumors: procedures and protocols for neuropathological practice – a publication under auspices of the Research Committee of the European Confederation of Neuropathological Societies(Euro-CNS).The FISH-based detection of 19q codeletion in oligodendroglial tumors. このような状況下において、「神経病理学的アプローチ」の重要性を再認識した。 蛍光in situハイブリダイゼーションを用いた神経膠腫の1p19q解析について、すべての臨床医が知っておくべきこと。 Clinical Oncology 2015; 27: 445-53.
- Weller M, van den Bent M, Hopkins K, et al. EANO guideline for the diagnosis and treatment of anaplastic gliomas and glioblastoma.(未分化グリオーマと膠芽腫の診断と治療に関するEANOガイドライン). Lancet Oncol 2014; 15: 395-403.
.