Definição de codeleção 1p/19q
Deleção completa tanto do braço curto do cromossomo 1 (1p) quanto do braço longo do cromossomo 19 (19q) (codeleção 1p/19q) é a assinatura genética molecular dos oligodendrogliomas, um subtipo de tumores cerebrais primários que representam aproximadamente dez a quinze por cento de todos os gliomas difusos em adultos 1,2. A perda de um cromossoma híbrido resulta em 1p e 19q de perda de heterozigosidade (LOH) 3. Esta alteração molecular é o resultado de uma translocação desequilibrada de todo o braço entre os cromossomos 1 e 19 3 com a perda da derivada t(1p;19q), que ocorre precocemente na patogênese dos oligodendrogliomas. Inicialmente descrito em 1994 4, o efeito biológico da co-deleção 1p/19q permanece pouco claro. A codeleção 1p/19q é um valioso biomarcador diagnóstico, prognóstico e preditivo para o manejo de tumores oligodendrogliomas.
1p/19q codeleção como biomarcador diagnóstico no glioma
1p/19q codeleção é um biomarcador patognomônico que define uma entidade gliomática distinta 5 e é característica dos oligodendrogliomas 6,7. Praticamente todos os oligodendrogliomas 1p/19q co-deletos têm mutação em isocitrato desidrogenase 1 (IDH1) em arginina 132 (R132) ou o resíduo análogo arginina 172 em IDH2 (R172) 7,8. Outras alterações moleculares comuns que co-ocorreram com a co-deleção 1p/19q incluem mutações no promotor do gene da transcriptase reversa da telomerase (TERT), mutações no homólogo de Drosophila capicua (CIC) e proteína de ligação de elementos a montante (FUBP1) 9, e a metilação promotora do gene da metiltransferase de metilguanina (MGMT) 8,7. Com poucas exceções, a co-deleção 1p/19q é mutuamente exclusiva com a mutação TP53 e ATRX, que caracterizam ambos tumores gliais de linhagem astrocítica.
Aqui, avaliação da co-deleção 1p/19q, juntamente com o estado de mutação IDH e outros marcadores moleculares (por exemplo ATRX e TP53), podem ajudar a distinguir oligodendrogliomas que são mutantes IDH e codificados 1p/19q, de tumores de linhagem astrocítica que são 1p/19q-não co-deletados 6,5.
De uma perspectiva clínica, os oligodendrogliomas 1p/19q-coletados são predominantemente tumores da idade adulta, com um pico de incidência entre a quarta e a sexta décadas de vida. Eles tendem a apresentar convulsões, e tipicamente envolvem o lobo frontal com alguns tumores contendo calcificações que são detectáveis em imagens cerebrais.
1p/19q co-deleção como marcador prognóstico no glioma
A presença de 1p/19q co-deleção é um forte marcador prognóstico independente associado à melhora da sobrevida tanto em tumores difusos de baixo grau quanto em anaplásicos 3,7,10,11,12.
Entre todos os gliomas difusos, os pacientes com 1p/19q-coleção têm o prognóstico mais favorável 13,7,14. Em uma grande análise multi e retrospectiva clínica realizada pela The Cancer Genome Atlas Research Network (TCGA), os pacientes com gliomas de grau II/III com mutação IDH e 1p/19q-co-deleção tiveram uma sobrevida total mediana de 8,0 anos, em comparação com 6.3 anos em pacientes com mutação IDH e sem 1p/19q-co-deleção e 1,7 anos em pacientes com IDH tipo selvagem 7,
1p/19q-co-deleção como biomarcador preditivo em glioma
1p/19q-co-deleção tem valor preditivo para resposta à quimioterapia em oligodendrogliomas anaplásicos. O seguimento prolongado de dois grandes ensaios randomizados controlados que compararam a quimioterapia procarbazina/lomustina/vincristina (PCV) em combinação com a radioterapia à radioterapia isolada demonstrou uma vantagem de sobrevivência da quimioterapia de primeira linha em oligodendroliomas de 1p/19q-co-deleção 15,16. A análise a longo prazo do estudo EORTC 26951 que randomizou 368 pacientes para radioterapia ou radioterapia seguida de PCV demonstrou que a mediana de sobrevida global para pacientes com tumores 1p/19q-co-deleted foi de 9,3 anos para aqueles tratados apenas com radioterapia, mas ainda não foi alcançada naqueles que receberam radioterapia mais PCV 15. Em uma análise semelhante do estudo RTOG 9402, no qual 289 pacientes receberam radioterapia ou PCV seguida de radioterapia, a mediana de sobrevida global dobrou de 7,3 para 14,7 anos em pacientes com tumores 1p/19q-co-deleted que receberam PCV e radioterapia 16.
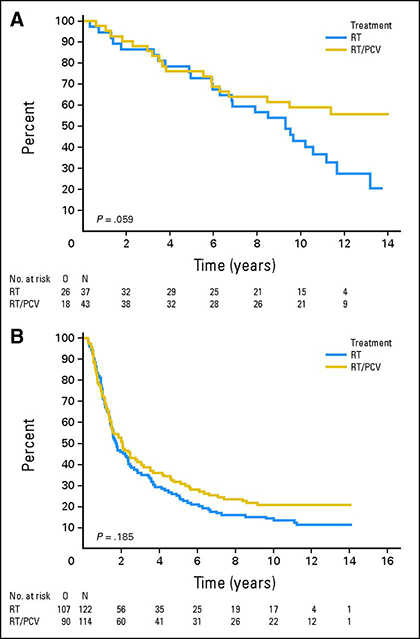
Sobrevida global para pacientes tratados com radioterapia (RT, curvas azuis) ou radioterapia mais PCV (RT/PCV, curvas amarelas) em pacientes com tumores 1p/19q co-deletados (A) ou não co-deletados (B) 15.
Simplesmente, pacientes com oligodendroglioma de “alto risco” grau II (ou seja, pacientes com menos de 40 anos de idade que foram submetidos a ressecção ou biópsia subtotal ou pacientes com 40 anos de idade ou mais) que receberam radioterapia mais PCV tiveram maior sobrevida global em comparação com pacientes tratados com radioterapia apenas na fase aleatória III do ensaio RTOG 9802 17.
1p/19q teste de co-deleção em glioma
Segundo a Classificação de Tumores do Sistema Nervoso Central da Organização Mundial de Saúde (OMS) de 2016, o diagnóstico definitivo de oligodendrolioma grau II e grau III (anaplásico) requer a demonstração tanto de uma mutação da família do gene IDH quanto de 1p/19q-co-deleção 6. Existem vários métodos diferentes que têm sido usados para identificar pacientes cujos tumores abrigam 1p/19q-co-deleção e ainda há pouco consenso claro sobre como os testes devem ser abordados.
Hibridização in situ fluorescente (FISH) é um método confiável, econômico e capaz de detectar a anormalidade em quantidades mínimas de células tumorais em seções de tecido fixadas em formol e incluídas em parafina (FFPE). Sondas de DNA com dupla marcação fluorescente são utilizadas para detectar 1p e 19q loci dentro dos núcleos interfásicos de células de glioma individuais de secções de tecido FFPE transcritas em lâminas não manchadas. As mudanças nos sinais das sondas 1p e 19q em comparação com os controles são usadas para determinar a presença de 1p/19q-co-deleção. Os estados dos cromossomas 1 e 19 são avaliados, em lâminas separadas, através da análise da distribuição das sondas de teste e controlo em 50-100 núcleos interfásicos não sobrepostos 18. Os resultados FISH podem ser expressos como uma percentagem de células tumorais com um sinal eliminado ou como uma proporção de sondas teste/controle para cada cromossoma 18. São usados cut-offs pré-especificados para determinar se uma eliminação cromossómica está ou não presente, e se ambos 1p e 19q forem eliminados, é reportada a co-delecção 1p/19q.
Variável existe entre as sondas FISH actualmente disponíveis 1p e 19q e os loci cromossómicos alvo. Alguns laboratórios utilizam sondas FISH disponíveis comercialmente, enquanto outros centros fabricam as suas próprias sondas internas 18. Além disso, há variações nas definições e cut-offs utilizados para determinar a eliminação dos cromossomas 18. Os resultados limite que se aproximam de um corte pré-definido para a eliminação de cromossomas podem requerer um novo teste ou esclarecimento com uma técnica adicional. Dado o significado clínico do estado de 1p/19q-co-deleção, é importante que os protocolos FISH sejam padronizados para garantir que a avaliação reprodutível dentro e entre laboratórios seja feita. O Comité de Investigação da Confederação Europeia de Sociedades Neuropatológicas (Euro-CNS) publicou recomendações práticas para auxiliar a análise baseada em FISH do estado 1p/19q 19.
FISH é incapaz de diferenciar entre as supressões de todo o braço cromossómico com pontos de ruptura centrómicos característicos dos oligodendrógliomas co-deletados 1p/19q, a partir de supressões focais menores. Esta distinção é importante dada a associação da co-deleção 1p/19q de todo o braço com melhor sobrevivência e resposta à quimioterapia no subtipo do tumor oligodendróglioma. A hibridização genômica comparativa (aCGH) e o polimorfismo de nucleotídeo único (SNP) são capazes de identificar a perda de todo o braço de 1p ou 19q com maior confiabilidade e podem ser usados em preferência ao FISH quando viável. Entretanto, em comparação com o FISH, estas técnicas tendem a ser mais trabalhosas e requerem uma proporção maior de células neoplásicas 18,
aCGH é uma técnica para detectar variações no número de cópias genômicas em alto nível de resolução. O DNA – extraído de uma amostra de teste e amostra de controle – é rotulado usando diferentes corantes fluorescentes, misturados e hibridizados a vários milhares de sondas. Os sistemas de imagem digital são usados para quantificar as intensidades de fluorescência das sondas de ADN etiquetadas que foram hibridizadas para cada sonda. A relação de fluorescência dos sinais de teste e controlo de hibridação é determinada em diferentes posições ao longo do genoma, fornecendo informação sobre o número relativo de cópias de sequências no genoma de teste, em comparação com um genoma normal. Este método permite a detecção simultânea de aneuploidias cromossômicas, deleções, duplicações e/ou amplificações de qualquer locus plotado em um array.
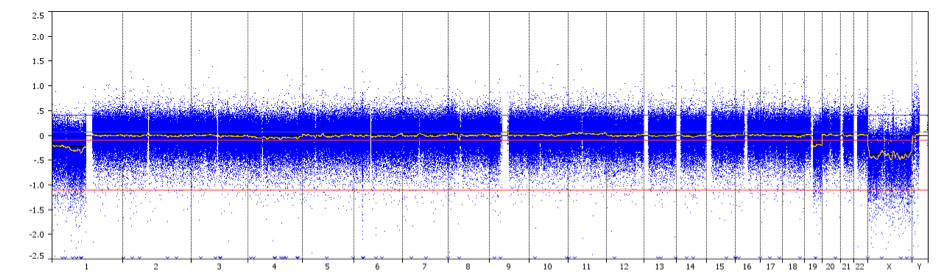
aCGH perfil mostrando a co-deleção de 1p/19q com pontos de ruptura centrômeros (seta) em um paciente com oligodendroglioma grau II.
Crédito: Prof. Marc Sanson.
Finalmente, análise por microsatélite baseada na reação em cadeia da polimerase – que permite a detecção de LOH em loci selecionado, e sequenciamento de próxima geração – métodos baseados em NGS também podem ser usados para avaliar o status 1p/19q.
Seleção da paciente
Orientações européias recomendam que1p/19q-co-deleção deve ser avaliada para apoiar o diagnóstico de oligodendroglioma e para prever a quimiossensibilidade e o prognóstico desses pacientes 5,20. Com base nos achados dos ensaios EORTC 26951 e RTOG 9402, os pacientes com tumores oligodendróglios anaplásicos depredados 1p/19q não devem ser tratados apenas com radioterapia, mas receber quimioterapia alquilante precoce com radioterapia 20. Uma abordagem semelhante deve ser considerada em um subconjunto de pacientes com oligodendroglioma grau II.
Quando o tratamento médico precisa ser iniciado, a magnitude do benefício do tratamento com radioterapia combinada mais PCV é substancial, mas os efeitos tóxicos são maiores nos pacientes que recebem a combinação. Ensaios clínicos estão em andamento para avaliar o valor da quimioterapia inicial, isolada ou combinada mais temozolomida, em comparação à radioterapia padrão mais PCV.
Referências-chave
- Ostrom QT, Bauchet L, Davis FG, et al. A epidemiologia do glioma em adultos: uma revisão do “estado da ciência”. Neuro Oncol 2014; 16(7):896-913.
- Ibdaih A, Marie Y, Pierron G, et al. Dois tipos de perdas do cromossoma 1p com significância oposta nos gliomas. Ann Neurol 2005; 58(3):483-7.
- Jenkins R, Blair H, Ballman K, et al. A t(1;19)(q10;p10) medeia as deleções combinadas de 1p e 19q e prevê um melhor prognóstico dos pacientes com oligodendroglioma. Cancer Res 2006; 66: 9852-61.
- Reifenberger J, Reifenberger G, Liu L, et al. A análise genética molecular de tumores oligodendrógicos mostra deleções alélicas preferenciais em 19q e 1p. Am J Pathol 1994; 145:1175-90.
- Stupp R, Brada M, van den Bent M, et al. glioma de alto grau: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2014;25 (Suppl 3): iii93-101.
- Louis D, Perry A, Reifenberger G. et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathologica 2016; 131: 803-20.
- Cancer Genome Genome Research Network, Brat D, Verhaak R, et al. Análise genômica compreensiva e integradora de gliomas difusos de grau inferior. N Engl J Med 2015; 372: 2481-98.
- Sanson M, Marie Y, Paris S, et al. A mutação do códão Isocitrate desidrogenase 1 132 é um importante biomarcador de prognóstico nos gliomas. J Clin Oncol 2009; 27: 4150-54.
- Bettegowda C, Agrawal N, Jiao Y, et al. As mutações no CIC e FUBP1 contribuem para o oligodendrolioma humano. Ciência 2011; 333(6048): 1453-5.
- Zhao J, Ma W, Zhao H. Perda de heterozigosidade 1p/19q e sobrevivência no glioma: uma meta-análise. Neuro-Oncologia 2014; 16: 103-112.
- van den Bent M, Carpentier A, Brandes A, et al. Adjuvant procarbazine, lomustine, and vincristine improves progression-free survival but not overall survival in newly diagnosticed anaplastic oligodendrogliomas and oligoastrocytomas: a randomized European Organisation for Research and Treatment of Cancer phase III trial. J Clin Oncol 2006; 24: 2715-22
- Cairncross G, Berkey B, Shaw E, et al. Ensaio Fase III de quimioterapia mais radioterapia comparado com radioterapia apenas para oligodendroglioma anaplásico puro e misto: Ensaio do Grupo Intergrupal de Radioterapia Oncológica 9402. J Clin Oncol 2006; 24: 2707-14.
- Wiestler B, Capper D, Sill M, et al. A metilação integrada do DNA e o perfil do número de cópias identificam três grupos de glioma anaplásico clínica e biologicamente relevantes. Acta Neuropathologica 2014; 128:561-71.
- Ceccarelli M, Barthel FP, Malta TM, et al. O Perfil Molecular Revela Subconjuntos Biologicamente Discretos e Caminhos de Progressão no Glioma Difuso. Cell 2016; 164(3): 550-63.
- van den Bent M, Brandes A, Taphoorn M, et al. Adjuvant procarbazine, lomustine, and vincristine quimotherapy in newly diagnosticed anaplastic oligodendroglioma: long-term follow-up of EORTC brain tumor group study 26951. J Clin Oncol 2013; 31:344-50.
- Cairncross G, Wang M, Shaw E, et al. Estudo Fase III da quimioterapia para oligodendroglioma anaplásico: resultados a longo prazo do RTOG 9402. J Clin Oncol 2013; 31: 337-43.
- Buckner JC, Shaw EG, Pugh SL, et al. Radiação mais Procarbazine, CCNU, e Vincristine em Glioma de Baixo Grau. N Engl J Med 2016; 374: 1344-1355.
- Woehrer A, Sander P, Baberler C, et al. FISH-based detection of 1p 19q codeletion in oligodendroglial tumors: procedures and protocols for neuropathological practice – a publication under the auspices of the Research Committee of the European Confederation of Neuropathological Societies (Euro-CNS). Neuropatologia Clínica 2011; 30: 47-55.
- Pinkham M, Telford N, Whitfield G, et al. Dicas para a Pescaria: O que Todo Clínico Deve Saber Sobre Análise 1p19q em Gliomas Usando Fluorescência Hibridização in situ. Clinical Oncology 2015; 27: 445-53.
- Weller M, van den Bent M, Hopkins K, et al. Diretriz EANO para o diagnóstico e tratamento de gliomas anaplásicos e glioblastoma. Lancet Oncol 2014; 15: 395-403.