Definición de la codeleción 1p/19q
La deleción completa tanto del brazo corto del cromosoma 1 (1p) como del brazo largo del cromosoma 19 (19q) (codeleción 1p/19q) es la firma genética molecular de los oligodendrogliomas, un subtipo de tumores cerebrales primarios que representan aproximadamente del diez al quince por ciento de todos los gliomas difusos en adultos 1,2. La pérdida de un cromosoma híbrido da lugar a la pérdida de heterocigosidad (LOH) 1p y 19q 3. Esta alteración molecular es el resultado de una translocación desequilibrada de todo el brazo entre los cromosomas 1 y 19 3 con la pérdida del derivado t(1p;19q), que se produce al principio de la patogénesis de los oligodendrogliomas. Descrita inicialmente en 1994 4, el efecto biológico de la codeleción 1p/19q sigue sin estar claro. La codeleción de 1p/19q es un valioso biomarcador de diagnóstico, pronóstico y predicción para el tratamiento de los tumores oligodendrogliales.
La codeleción de 1p/19q como biomarcador de diagnóstico en el glioma
La codeleción de 1p/19q es un biomarcador patognomónico que define una entidad de glioma distinta 5 y es característica de los oligodendrogliomas 6,7. Prácticamente, todos los oligodendrogliomas con codelección 1p/19q presentan una mutación en la isocitrato deshidrogenasa 1 (IDH1) en la arginina 132 (R132) o en el residuo análogo arginina 172 en IDH2 (R172) 7,8. Otras alteraciones moleculares comunes que coinciden con la codeleción de 1p/19q incluyen mutaciones en el promotor del gen de la transcriptasa inversa de la telomerasa (TERT), mutaciones en el homólogo de la capicua de Drosophila (CIC) y en la proteína de unión al elemento lejano aguas arriba (FUBP1) 9, y la metilación del promotor del gen de la metil-guanina metil-transferasa (MGMT) 8,7. Con muy pocas excepciones, la codeleción 1p/19q es mutuamente excluyente con la mutación TP53 y ATRX, que caracterizan a los tumores gliales de linaje astrocítico.
Por lo tanto, la evaluación de la codeleción 1p/19q, junto con el estado de la mutación IDH y otros marcadores moleculares (por ejemplo ATRX y TP53), puede ayudar a distinguir los oligodendrogliomas con mutación IDH y codelección 1p/19q, de los tumores de linaje astrocítico con codelección 1p/19q 6,5.
Desde el punto de vista clínico, los oligodendrogliomas con codelección 1p/19q son predominantemente tumores de la edad adulta, con una incidencia máxima entre la cuarta y la sexta década de la vida. Suelen presentarse con convulsiones y suelen afectar al lóbulo frontal, con algunos tumores que contienen calcificaciones detectables en las imágenes cerebrales.
La codeleción 1p/19q como biomarcador pronóstico en el glioma
La presencia de la codeleción 1p/19q es un fuerte biomarcador pronóstico independiente asociado a una mejor supervivencia tanto en los tumores difusos de bajo grado como en los anaplásicos 3,7,10,11,12.
Entre todos los gliomas difusos, los pacientes con codeleción 1p/19q tienen el pronóstico más favorable 13,7,14. En un gran análisis retrospectivo multiómico y clínico realizado por la Red de Investigación del Atlas del Genoma del Cáncer (TCGA), los pacientes con gliomas de grado II/III con una mutación de IDH y una codeleción de 1p/19q tuvieron una mediana de supervivencia global de 8,0 años, en comparación con 6.3 años en pacientes con una mutación IDH y sin codeleción 1p/19q y 1,7 años en pacientes con IDH de tipo salvaje 7.
La codeleción 1p/19q como biomarcador predictivo en el glioma
La codeleción 1p/19q tiene valor predictivo para la respuesta a la quimioterapia en los oligodendrogliomas anaplásicos. El seguimiento ampliado de dos grandes ensayos controlados aleatorios que compararon la quimioterapia con procarbazina/lomustina/vincristina (PCV) en combinación con radioterapia con la radioterapia sola demostró una ventaja de supervivencia de la quimioterapia de primera línea en los oligodendrogliomas con deleción de 1p/19q-co 15,16. El análisis a largo plazo del estudio EORTC 26951, que aleatorizó a 368 pacientes a radioterapia o a radioterapia seguida de PCV, demostró que la mediana de supervivencia global de los pacientes con tumores con deleción de 1p/19q era de 9,3 años para los tratados con radioterapia sola, pero no se alcanzó en los que recibieron radioterapia más PCV 15. En un análisis similar del ensayo RTOG 9402 en el que 289 pacientes recibieron radioterapia o PCV seguida de radioterapia, la mediana de supervivencia global se duplicó de 7,3 a 14,7 años en los pacientes con tumores con deleción de 1p/19q que recibieron PCV y radioterapia 16.
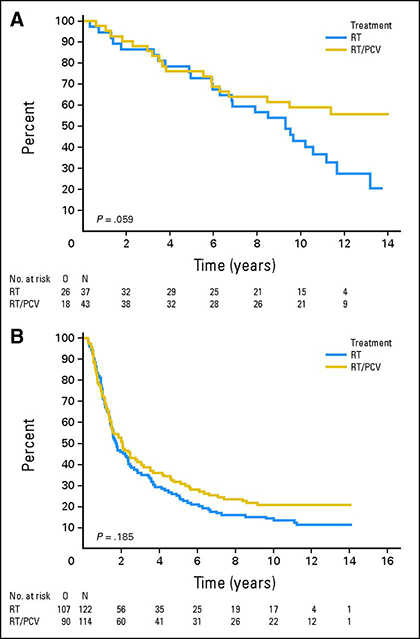
Supervivencia global de los pacientes tratados con radioterapia (RT, curvas azules) o radioterapia más PCV (RT/PCV, curvas amarillas) en pacientes con tumores 1p/19q codelegados (A) o no codelegados (B) 15.
De forma similar, los pacientes con oligodendroglioma de grado II de «alto riesgo» (es decir, pacientes menores de 40 años que habían sido sometidos a una resección subtotal o a una biopsia o pacientes de 40 años o más) que recibieron radioterapia más PCV tuvieron una mayor supervivencia global en comparación con los pacientes tratados sólo con radioterapia en el ensayo aleatorizado de fase III RTOG 9802 17.
Las pruebas de codeleción 1p/19q en el glioma
Según la Clasificación de tumores del sistema nervioso central de la Organización Mundial de la Salud (OMS) de 2016, el diagnóstico definitivo del oligodendroglioma de grado II y grado III (anaplásico) requiere la demostración tanto de una mutación de la familia del gen IDH como de la codeleción 1p/19q 6. Hay varios métodos diferentes que se han utilizado para identificar a los pacientes cuyos tumores albergan la co-deleción 1p/19q y todavía no hay un consenso claro sobre cómo deben abordarse las pruebas.
La hibridación fluorescente in situ (FISH) es un método fiable y rentable que es capaz de detectar la anomalía en cantidades mínimas de células tumorales en secciones de tejido fijadas en formol e incluidas en parafina (FFPE). Se utilizan sondas de ADN dobles marcadas con fluorescencia para detectar los loci 1p y 19q dentro de los núcleos interfásicos de células de glioma individuales de secciones de tejido FFPE transcritas en portaobjetos sin teñir. Los cambios en las señales de las sondas 1p y 19q en comparación con los controles se utilizan para determinar la presencia de la codeleción 1p/19q. Los estados del cromosoma 1 y del cromosoma 19 se evalúan, en portaobjetos separados, analizando la distribución de las sondas de prueba y de control en 50-100 núcleos interfásicos no superpuestos 18. Los resultados de FISH pueden expresarse como un porcentaje de células tumorales con una señal de deleción o como una proporción de sondas de prueba y de control para cada cromosoma 18. Se utilizan puntos de corte preestablecidos para determinar si hay una deleción cromosómica o no, y si tanto 1p como 19q están borrados, se informa de la codeleción 1p/19q.
Existe variabilidad entre las sondas FISH 1p y 19q actualmente disponibles y los loci cromosómicos a los que se dirigen. Algunos laboratorios utilizan sondas FISH disponibles en el mercado, mientras que otros centros fabrican sus propias 18. Además, hay variaciones en las definiciones y los puntos de corte utilizados para determinar la deleción cromosómica 18. Los resultados dudosos que se acercan a un punto de corte predefinido para la deleción cromosómica pueden requerir una nueva prueba o una aclaración con una técnica adicional. Dada la importancia clínica del estado de codeleción 1p/19q, es importante que los protocolos de FISH estén estandarizados para garantizar una evaluación reproducible dentro de los laboratorios y entre ellos. El Comité de Investigación de la Confederación Europea de Sociedades de Neuropatología (Euro-CNS) ha publicado recomendaciones prácticas para ayudar al análisis basado en FISH del estado 1p/19q 19.
FISH no es capaz de diferenciar entre las deleciones de todo el brazo cromosómico con puntos de rotura centroméricos característicos de los oligodendrogliomas con deleción 1p/19q, de las deleciones focales más pequeñas. Esta distinción es importante dada la asociación de la codelección del brazo completo 1p/19q con una mayor supervivencia y respuesta a la quimioterapia en el subtipo de tumor oligodendroglial. La hibridación genómica comparativa (aCGH) y la matriz de polimorfismo de un solo nucleótido (SNP) son capaces de identificar la pérdida de todo el brazo de 1p o 19q con mayor fiabilidad y pueden utilizarse con preferencia a la FISH cuando sea factible. Sin embargo, en comparación con FISH, estas técnicas tienden a ser más intensivas en mano de obra y requieren una mayor proporción de células neoplásicas 18.
aCGH es una técnica para detectar variaciones del número de copias genómicas a un nivel de alta resolución. El ADN -extraído de una muestra de prueba y de una muestra de control- se marca con diferentes tintes fluorescentes, se mezcla y se hibrida con varios miles de sondas. Se utilizan sistemas de imagen digital para cuantificar las intensidades de fluorescencia de las sondas de ADN marcadas que se han hibridado con cada sonda. La relación de fluorescencia de las señales de hibridación de prueba y de control se determina en diferentes posiciones a lo largo del genoma, proporcionando información sobre el número de copias relativo de las secuencias en el genoma de prueba en comparación con un genoma normal. Este método permite la detección simultánea de aneuploidías cromosómicas, deleciones, duplicaciones y/o amplificaciones de cualquier locus trazado en un array.
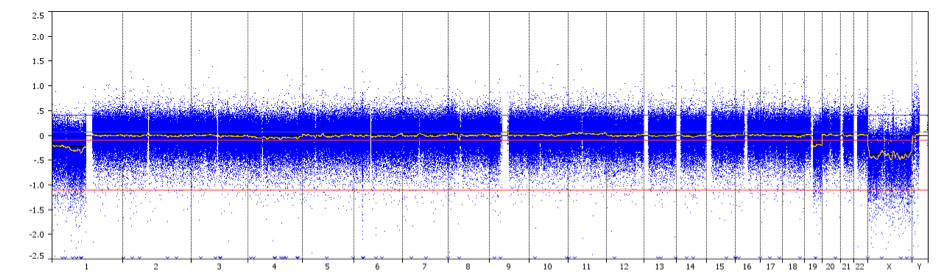
Un perfil de CGH que muestra una codeleción de todo el brazo 1p/19q con puntos de rotura centromérica (flecha) en un paciente con oligodendroglioma de grado II.
Crédito: Prof. Marc Sanson.
Por último, el análisis de microsatélites basado en la reacción en cadena de la polimerasa – que permite la detección de LOH en loci seleccionados, y la secuenciación de próxima generación – los métodos basados en NGS también pueden utilizarse para evaluar el estado de 1p/19q.
Selección de pacientes
Las directrices europeas recomiendan que se evalúe la codeleción de 1p/19q para apoyar el diagnóstico de oligodendroglioma y para predecir la quimiosensibilidad y el pronóstico de estos pacientes 5,20. Sobre la base de los resultados de los ensayos EORTC 26951 y RTOG 9402, los pacientes con tumores oligodendrogliales anaplásicos con deleción de 1p/19q no deberían ser tratados sólo con radioterapia, sino que deberían recibir quimioterapia alquilante temprana con radioterapia 20. Debe considerarse un enfoque similar en un subconjunto de pacientes con oligodendroglioma de grado II.
Cuando es necesario iniciar el tratamiento médico, la magnitud del beneficio del tratamiento de la radioterapia combinada más PCV es sustancial, pero los efectos tóxicos son mayores en los pacientes que reciben la combinación. Se están realizando ensayos clínicos para evaluar el valor de la quimioterapia por adelantado sola o de la radioterapia combinada más temozolomida en comparación con la radioterapia estándar más PCV.
Referencias clave
- Ostrom QT, Bauchet L, Davis FG, et al. The epidemiology of glioma in adults: a «state of the science» review. Neuro Oncol 2014; 16(7):896-913.
- Ibdaih A, Marie Y, Pierron G, et al. Dos tipos de pérdidas del cromosoma 1p con significado opuesto en los gliomas. Ann Neurol 2005; 58(3):483-7.
- Jenkins R, Blair H, Ballman K, et al. Una t(1;19)(q10;p10) media las deleciones combinadas de 1p y 19q y predice un mejor pronóstico de los pacientes con oligodendroglioma. Cancer Res 2006; 66: 9852-61.
- Reifenberger J, Reifenberger G, Liu L, et al. Molecular genetic analysis of oligodendroglial tumors shows preferential allelic deletions on 19q and 1p. Am J Pathol 1994; 145:1175-90.
- Stupp R, Brada M, van den Bent M, et al. High-grade glioma: Guía de práctica clínica de la ESMO para el diagnóstico, el tratamiento y el seguimiento. Ann Oncol 2014;25 (Suppl 3): iii93-101.
- Louis D, Perry A, Reifenberger G. et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathologica 2016; 131: 803-20.
- Cancer Genome Atlas Research Network, Brat D, Verhaak R, et al. Comprehensive, integrative genomic analysis of diffuse lower-grade gliomas. N Engl J Med 2015; 372: 2481-98.
- Sanson M, Marie Y, Paris S, et al. La mutación del codón 132 de la isocitrato deshidrogenasa 1 es un importante biomarcador pronóstico en los gliomas. J Clin Oncol 2009; 27: 4150-54.
- Bettegowda C, Agrawal N, Jiao Y, et al. Mutaciones en CIC y FUBP1 contribuyen al oligodendroglioma humano. Science 2011; 333(6048): 1453-5.
- Zhao J, Ma W, Zhao H. Pérdida de heterocigosidad 1p/19q y supervivencia en el glioma: un meta-análisis. Neuro-Oncology 2014; 16: 103-112.
- van den Bent M, Carpentier A, Brandes A, et al. La procarbazina, la lomustina y la vincristina adyuvantes mejoran la supervivencia libre de progresión pero no la supervivencia global en oligodendrogliomas y oligoastrocitomas anaplásicos recién diagnosticados: un ensayo aleatorizado de fase III de la Organización Europea para la Investigación y el Tratamiento del Cáncer. J Clin Oncol 2006; 24: 2715-22
- Cairncross G, Berkey B, Shaw E, et al. Phase III trial of chemotherapy plus radiotherapy compared with radiotherapy alone for pure and mixed anaplastic oligodendroglioma: Intergroup Radiation Therapy Oncology Group Trial 9402. J Clin Oncol 2006; 24: 2707-14.
- Wiestler B, Capper D, Sill M, et al. La metilación integrada del ADN y el perfil del número de copias identifican tres grupos clínica y biológicamente relevantes de glioma anaplásico. Acta Neuropathologica 2014; 128:561-71.
- Ceccarelli M, Barthel FP, Malta TM, et al. Molecular Profiling Reveals Biologically Discrete Subsets and Pathways of Progression in Diffuse Glioma. Cell 2016; 164(3): 550-63.
- van den Bent M, Brandes A, Taphoorn M, et al. Quimioterapia adyuvante con procarbazina, lomustina y vincristina en oligodendroglioma anaplásico recién diagnosticado: seguimiento a largo plazo del estudio 26951 del grupo de tumores cerebrales EORTC. J Clin Oncol 2013; 31:344-50.
- Cairncross G, Wang M, Shaw E, et al. Ensayo de fase III de quimiorradioterapia para el oligodendroglioma anaplásico: resultados a largo plazo del RTOG 9402. J Clin Oncol 2013; 31: 337-43.
- Buckner JC, Shaw EG, Pugh SL, et al. Radiación más procarbazina, CCNU y vincristina en glioma de bajo grado. N Engl J Med 2016; 374: 1344-1355.
- Woehrer A, Sander P, Baberler C, et al. Detección basada en FISH de la codeleción 1p 19q en tumores oligodendrogliales: procedimientos y protocolos para la práctica neuropatológica – una publicación bajo los auspicios del Comité de Investigación de la Confederación Europea de Sociedades de Neuropatología (Euro-CNS). Clinical Neuropathology 2011; 30: 47-55.
- Pinkham M, Telford N, Whitfield G, et al. FISHing Tips: Lo que todo clínico debe saber sobre el análisis de 1p19q en gliomas mediante hibridación in situ de fluorescencia. Clinical Oncology 2015; 27: 445-53.
- Weller M, van den Bent M, Hopkins K, et al. Guía de la EANO para el diagnóstico y tratamiento de gliomas anaplásicos y glioblastoma. Lancet Oncol 2014; 15: 395-403.