Definizione della co-delezione 1p/19q
La delezione completa del braccio corto del cromosoma 1 (1p) e del braccio lungo del cromosoma 19 (19q) (co-delezione 1p/19q) è la firma genetica molecolare degli oligodendrogliomi, un sottotipo di tumore cerebrale primario che rappresenta circa il 10-15% di tutti i gliomi diffusi negli adulti 1,2. La perdita di un cromosoma ibrido porta alla perdita di eterozigosi (LOH) 1p e 19q 3. Questa alterazione molecolare è il risultato di una traslocazione sbilanciata a braccio intero tra i cromosomi 1 e 19 3 con la perdita del derivato t(1p;19q), che si verifica all’inizio della patogenesi degli oligodendrogliomi. Inizialmente descritto nel 1994 4, l’effetto biologico della co-delezione 1p/19q rimane poco chiaro. La co-delezione 1p/19q è un prezioso biomarcatore diagnostico, prognostico e predittivo per la gestione dei tumori oligodendrogliali.
La co-delezione 1p/19q come biomarcatore diagnostico nel glioma
La co-delezione 1p/19q è un biomarcatore patognomonico che definisce un’entità glioma distinta 5 ed è caratteristica degli oligodendrogliomi 6,7. Praticamente, tutti gli oligodendrogliomi 1p/19q co-deleti hanno mutazioni nell’isocitrato deidrogenasi 1 (IDH1) all’arginina 132 (R132) o all’analogo residuo arginina 172 in IDH2 (R172) 7,8. Altre alterazioni molecolari comuni che si verificano con la co-delezione 1p/19q includono mutazioni nel promotore del gene della trascrittasi inversa della telomerasi (TERT), mutazioni nell’omologo di Drosophila capicua (CIC) e nella proteina legante l’elemento a monte lontano (FUBP1) 9, e metilazione del promotore del gene della metil-guanina metil transferasi (MGMT) 8,7. Con pochissime eccezioni, la co-delezione 1p/19q è mutuamente esclusiva con la mutazione TP53 e ATRX, che caratterizzano entrambi i tumori gliali di discendenza astrocitaria.
Pertanto, la valutazione della co-delezione 1p/19q, insieme allo stato di mutazione IDH e altri marcatori molecolari (ad es. ATRX e TP53), può aiutare a distinguere gli oligodendrogliomi che sono IDH-mutanti e 1p/19q codificati, dai tumori di discendenza astrocitaria che sono 1p/19q-non codificati 6,5.
Da una prospettiva clinica, gli oligodendrogliomi 1p/19q codificati sono prevalentemente tumori dell’età adulta, con un picco di incidenza tra la quarta e la sesta decade di vita. Tendono a presentarsi con convulsioni, e tipicamente coinvolgono il lobo frontale con alcuni tumori contenenti calcificazioni che sono rilevabili all’imaging cerebrale.
La co-delezione 1p/19q come biomarcatore prognostico nel glioma
La presenza della co-delezione 1p/19q è un forte biomarcatore prognostico indipendente associato a una migliore sopravvivenza sia nei tumori diffusi di basso grado che in quelli anaplastici 3,7,10,11,12.
Tra tutti i gliomi diffusi, i pazienti con co-delezione 1p/19q hanno la prognosi più favorevole 13,7,14. In una grande analisi retrospettiva multiomica e clinica eseguita da The Cancer Genome Atlas Research Network (TCGA), i pazienti con gliomi di grado II/III con una mutazione IDH e 1p/19q-co-deletion avevano una sopravvivenza globale mediana di 8,0 anni, rispetto a 6.3 anni in pazienti con una mutazione IDH e nessuna 1p/19q-co-delezione e 1,7 anni in pazienti con IDH wildtype 7.
1p/19q co-delezione come biomarcatore predittivo nel glioma
1p/19q-co-delezione ha valore predittivo per la risposta alla chemioterapia negli oligodendrogliomi anaplastici. Il follow-up esteso di due grandi studi randomizzati controllati che hanno confrontato la chemioterapia con procarbazina/lomustina/vincristina (PCV) in combinazione con la radioterapia con la sola radioterapia ha dimostrato un vantaggio di sopravvivenza della chemioterapia di prima linea negli oligodendrogliomi con 1p/19q-co-deleti 15,16. L’analisi a lungo termine dello studio EORTC 26951 che ha randomizzato 368 pazienti alla radioterapia o alla radioterapia seguita da PCV ha dimostrato che la sopravvivenza globale mediana dei pazienti con tumori 1p/19q-co-deleti era di 9,3 anni per quelli trattati con la sola radioterapia ma non era ancora stata raggiunta in quelli che avevano ricevuto la radioterapia più PCV 15. In un’analisi simile dello studio RTOG 9402 in cui 289 pazienti hanno ricevuto radioterapia o PCV seguita da radioterapia, la sopravvivenza globale mediana è raddoppiata da 7,3 a 14,7 anni nei pazienti con tumori 1p/19q-co-deleted che hanno ricevuto PCV e radioterapia 16.
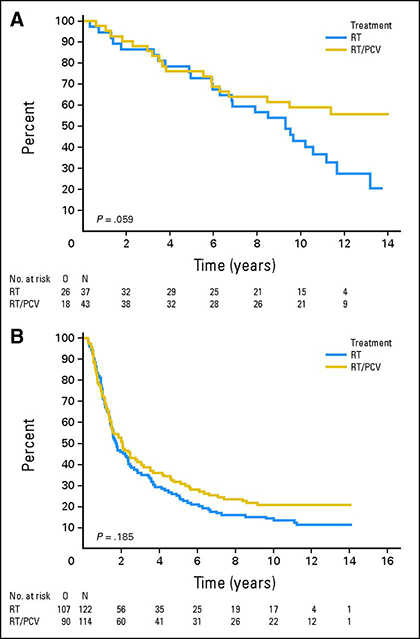
Sopravvivenza globale per i pazienti trattati con radioterapia (RT, curve blu) o radioterapia più PCV (RT/PCV, curve gialle) in pazienti con tumori 1p/19q co-deleti (A) o non co-deleti (B) 15.
Similmente, i pazienti con oligodendroglioma di grado II “ad alto rischio” (cioè pazienti di età inferiore ai 40 anni sottoposti a resezione subtotale o biopsia o pazienti di 40 anni o più) che hanno ricevuto radioterapia più PCV avevano una sopravvivenza globale più lunga rispetto ai pazienti trattati con la sola radioterapia nello studio randomizzato di fase III RTOG 9802 17.
Test della co-delezione 1p/19q nel glioma
Secondo la classificazione dei tumori del sistema nervoso centrale dell’Organizzazione mondiale della sanità (OMS) del 2016, la diagnosi definitiva di oligodendroglioma di grado II e III (anaplastico) richiede la dimostrazione di una mutazione della famiglia del gene IDH e della co-delezione 1p/19q 6. Ci sono diversi metodi che sono stati utilizzati per identificare i pazienti i cui tumori ospitano la delezione 1p/19q-co e c’è ancora poco consenso chiaro su come i test dovrebbero essere affrontati.
L’ibridazione fluorescente in situ (FISH) è un metodo affidabile e conveniente che è in grado di rilevare l’anomalia in quantità minime di cellule tumorali su sezioni di tessuto fissate in formalina e incluse in paraffina (FFPE). Le sonde di DNA con doppia marcatura fluorescente sono utilizzate per rilevare i loci 1p e 19q all’interno dei nuclei interfasici di singole cellule di glioma da sezioni di tessuto FFPE trascritte su vetrini non colorati. I cambiamenti nei segnali delle sonde 1p e 19q rispetto ai controlli sono usati per determinare la presenza di una co-delezione 1p/19q. Gli stati del cromosoma 1 e del cromosoma 19 sono valutati, su vetrini separati, analizzando la distribuzione delle sonde di prova e di controllo in 50-100 nuclei interfasici non sovrapposti 18. I risultati della FISH possono essere espressi come percentuale di cellule tumorali con un segnale di cancellazione o come rapporto tra le sonde di prova e di controllo per ogni cromosoma 18. Vengono utilizzati cut-off prestabiliti per determinare se una delezione cromosomica è presente o meno, e se entrambi 1p e 19q sono deleti, viene riportata la co-delezione 1p/19q.
La variabilità esiste tra le sonde FISH 1p e 19q attualmente disponibili e i loci cromosomici che prendono di mira. Alcuni laboratori utilizzano sonde FISH disponibili in commercio, mentre altri centri producono le proprie 18. Inoltre, c’è una variazione nelle definizioni e nei cut-off utilizzati per determinare la delezione cromosomica 18. I risultati borderline che si trovano vicino ad un cut-off predefinito per la delezione cromosomica possono richiedere un nuovo test o un chiarimento con una tecnica aggiuntiva. Data l’importanza clinica dello stato di delezione 1p/19q-co, è importante che i protocolli FISH siano standardizzati per garantire una valutazione riproducibile all’interno e tra i laboratori. Il comitato di ricerca della Confederazione europea delle società di neuropatologia (Euro-CNS) ha pubblicato raccomandazioni pratiche per assistere l’analisi basata sulla FISH dello stato 1p/19q 19.
FISH non è in grado di differenziare tra le delezioni dell’intero braccio cromosomico con breakpoints centromerici caratteristici degli oligodendrogliomi co-deleti 1p/19q, da delezioni focali più piccole. Questa distinzione è importante data l’associazione della co-delezione del braccio 1p/19q con una migliore sopravvivenza e risposta alla chemioterapia nel sottotipo di tumore oligodendrogliale. L’ibridazione genomica comparativa Array (aCGH) e l’array di polimorfismi a singolo nucleotide (SNP) sono in grado di identificare la perdita dell’intero braccio di 1p o 19q con maggiore affidabilità e possono essere utilizzati al posto della FISH quando è possibile. Tuttavia, rispetto alla FISH, queste tecniche tendono ad essere più laboriose e richiedono una proporzione maggiore di cellule neoplastiche 18.
aCGH è una tecnica per rilevare variazioni del numero di copie genomiche ad alta risoluzione. Il DNA – estratto da un campione di prova e da un campione di controllo – viene etichettato con diversi coloranti fluorescenti, mescolato insieme e ibridato con diverse migliaia di sonde. I sistemi di imaging digitale vengono utilizzati per quantificare le intensità di fluorescenza delle sonde di DNA etichettate che si sono ibridate ad ogni sonda. Il rapporto di fluorescenza dei segnali di ibridazione del test e del controllo viene determinato in diverse posizioni lungo il genoma, fornendo informazioni sul numero relativo di copie di sequenze nel genoma del test rispetto a un genoma normale. Questo metodo permette il rilevamento simultaneo di aneuploidie cromosomiche, delezioni, duplicazioni e/o amplificazioni di qualsiasi locus tracciato su un array.
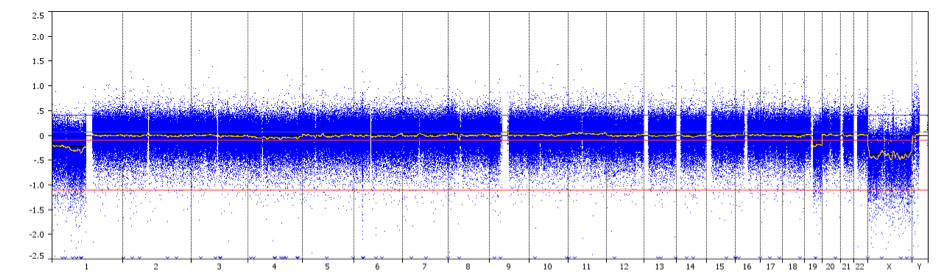
profilo CGH che mostra la co-delezione dell’intero braccio 1p/19q con punti di rottura centromerici (freccia) in un paziente con oligodendroglioma di grado II.
Credit: Prof. Marc Sanson.
Infine, l’analisi dei microsatelliti basata sulla reazione a catena della polimerasi – che permette di rilevare la LOH a loci selezionati, e il sequenziamento di prossima generazione – i metodi basati su NGS possono anche essere utilizzati per valutare lo stato di 1p/19q.
Selezione dei pazienti
Le linee guida europee raccomandano che la co-delezione1p/19q dovrebbe essere valutata per sostenere una diagnosi di oligodendroglioma e per prevedere la chemiosensibilità e la prognosi di questi pazienti 5,20. Sulla base dei risultati degli studi EORTC 26951 e RTOG 9402, i pazienti con tumori anaplastici oligodendrogliali 1p/19q-co-deleted non dovrebbero essere trattati con la sola radioterapia, ma ricevere invece una chemioterapia alchilante precoce con radioterapia 20. Un approccio simile dovrebbe essere considerato in un sottogruppo di pazienti con oligodendroglioma di grado II.
Quando il trattamento medico deve essere iniziato, l’entità del beneficio del trattamento dalla radioterapia combinata più PCV è sostanziale, ma gli effetti tossici sono maggiori nei pazienti che ricevono la combinazione. Sono in corso studi clinici per valutare il valore della sola chemioterapia iniziale o della radioterapia combinata più temozolomide rispetto alla radioterapia standard più PCV.
Riferimenti chiave
- Ostrom QT, Bauchet L, Davis FG, et al. The epidemiology of glioma in adults: a “state of the science” review. Neuro Oncol 2014; 16(7):896-913.
- Ibdaih A, Marie Y, Pierron G, et al. Due tipi di perdite del cromosoma 1p con significato opposto nei gliomi. Ann Neurol 2005; 58(3):483-7.
- Jenkins R, Blair H, Ballman K, et al. Un t(1;19)(q10;p10) media le delezioni combinate di 1p e 19q e predice una prognosi migliore dei pazienti con oligodendroglioma. Cancer Res 2006; 66: 9852-61.
- Reifenberger J, Reifenberger G, Liu L, et al. L’analisi genetica molecolare dei tumori oligodendrogliali mostra delezioni alleliche preferenziali su 19q e 1p. Am J Pathol 1994; 145:1175-90.
- Stupp R, Brada M, van den Bent M, et al. Glioma di alto grado: ESMO Clinical Practice Guidelines per la diagnosi, il trattamento e il follow-up. Ann Oncol 2014;25 (Suppl 3): iii93-101.
- Louis D, Perry A, Reifenberger G. et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathologica 2016; 131: 803-20.
- Cancer Genome Atlas Research Network, Brat D, Verhaak R, et al. Analisi genomica completa e integrativa dei gliomi diffusi di grado inferiore. N Engl J Med 2015; 372: 2481-98.
- Sanson M, Marie Y, Paris S, et al. Isocitrate dehydrogenase 1 codone 132 mutazione è un importante biomarcatore prognostico nei gliomi. J Clin Oncol 2009; 27: 4150-54.
- Bettegowda C, Agrawal N, Jiao Y, et al. Mutazioni in CIC e FUBP1 contribuiscono all’oligodendroglioma umano. Scienza 2011; 333(6048): 1453-5.
- Zhao J, Ma W, Zhao H. Perdita di eterozigosi 1p/19q e sopravvivenza nel glioma: una meta-analisi. Neuro-Oncology 2014; 16: 103-112.
- van den Bent M, Carpentier A, Brandes A, et al. Adjuvant procarbazine, lomustina e vincristina migliora la sopravvivenza libera da progressione ma non la sopravvivenza complessiva negli oligodendrogliomi anaplastici e oligoastrocitomi di nuova diagnosi: uno studio randomizzato di fase III dell’Organizzazione europea per la ricerca e il trattamento del cancro. J Clin Oncol 2006; 24: 2715-22
- Cairncross G, Berkey B, Shaw E, et al. Studio di fase III di chemioterapia più radioterapia rispetto alla sola radioterapia per l’oligodendroglioma anaplastico puro e misto: Intergroup Radiation Therapy Oncology Group Trial 9402. J Clin Oncol 2006; 24: 2707-14.
- Wiestler B, Capper D, Sill M, et al. Integrated DNA methylation and copy-number profiling identify three clinically and biologically relevant groups of anaplastic glioma. Acta Neuropathologica 2014; 128:561-71.
- Ceccarelli M, Barthel FP, Malta TM, et al. Molecular Profiling Reveals Biologically Discrete Subsets and Pathways of Progression in Diffuse Glioma. Cell 2016; 164(3): 550-63.
- van den Bent M, Brandes A, Taphoorn M, et al. Chemioterapia adiuvante con procarbazina, lomustina e vincristina in oligodendroglioma anaplastico di nuova diagnosi: follow-up a lungo termine dello studio EORTC brain tumor group 26951. J Clin Oncol 2013; 31:344-50.
- Cairncross G, Wang M, Shaw E, et al. Studio di fase III di chemioradioterapia per oligodendroglioma anaplastico: risultati a lungo termine di RTOG 9402. J Clin Oncol 2013; 31: 337-43.
- Buckner JC, Shaw EG, Pugh SL, et al. Radiation plus Procarbazine, CCNU, and Vincristine in Low-Grade Glioma. N Engl J Med 2016; 374: 1344-1355.
- Woehrer A, Sander P, Baberler C, et al. FISH-based detection of 1p 19q codeletion in oligodendroglial tumors: procedures and protocols for neuropathological practice – a publication under the auspices of the Research Committee of the European Confederation of Neuropathological Societies (Euro-CNS). Clinical Neuropathology 2011; 30: 47-55.
- Pinkham M, Telford N, Whitfield G, et al. FISHing Tips: What Every Clinician Should Know About 1p19q Analysis in Gliomas Using Fluorescence in situ Hybridisation. Clinical Oncology 2015; 27: 445-53.
- Weller M, van den Bent M, Hopkins K, et al. EANO guideline for the diagnosis and treatment of anaplastic gliomas and glioblastoma. Lancet Oncol 2014; 15: 395-403.