I tumori neonatali si verificano ogni 12.500-27.500 nati vivi e rappresentano il 2% dei tumori maligni infantili. Il nefroma mesoblastico (chiamato anche amartoma renale fetale) è il tumore renale più comune identificato nel periodo neonatale e il tumore renale benigno più frequente nell’infanzia. Rappresenta il 3-10% di tutti i tumori renali pediatrici. Questo tumore è stato descritto per la prima volta come entità separata da Bolande et al nel 1967. Prima di questo, è stato erroneamente confuso con il tumore di Wilms congenito.
La diagnosi di nefroma mesoblastico può essere fatta prima del parto con l’ecografia. Il poliidramnios è riportato nel 71% delle gravidanze associate al nefroma mesoblastico. La presentazione clinica più comune è una massa addominale asintomatica. Possono essere presenti sindromi paraneoplastiche come l’ipertensione o l’ipercalcemia. Si pensa che l’ipertensione sia secondaria all’aumento della produzione di renina da parte dei glomeruli intrappolati nel tumore. La diagnosi differenziale include il tumore di Wilms.
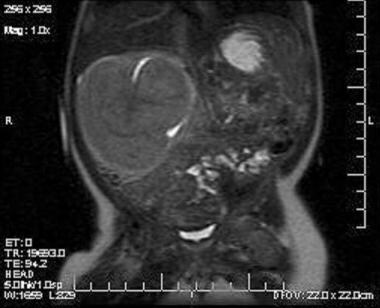
Le caratteristiche radiologiche del nefroma mesoblastico sono dimostrate nelle immagini seguenti.
 L’immagine T2 coronale dimostra una massa solida che sorge dal polo superiore del rene destro. Il tessuto renale normale è spostato inferiormente. Una parte della pelvi renale intrappolata dalla massa appare come una iperdensità nella massa. La massa è isodensa al parenchima renale su tutte le sequenze.
L’immagine T2 coronale dimostra una massa solida che sorge dal polo superiore del rene destro. Il tessuto renale normale è spostato inferiormente. Una parte della pelvi renale intrappolata dalla massa appare come una iperdensità nella massa. La massa è isodensa al parenchima renale su tutte le sequenze.  Immagine coronale T1 attraverso la massa derivante dal polo superiore del rene destro. La massa è isodensa al rene. Mostra un segnale omogeneo senza necrosi centrale o emorragia.
Immagine coronale T1 attraverso la massa derivante dal polo superiore del rene destro. La massa è isodensa al rene. Mostra un segnale omogeneo senza necrosi centrale o emorragia.  Immagine assiale in un bambino di 3 mesi con una massa addominale palpabile. L’immagine mostra una grande massa solida, omogenea, che non aumenta, proveniente dal polo superiore del rene destro. Il tessuto renale normale è visto migliorare inferiormente. Escrezione di contrasto nella pelvi intrappolata dalla massa è visto come iperdensità centrale nel centro della massa.
Immagine assiale in un bambino di 3 mesi con una massa addominale palpabile. L’immagine mostra una grande massa solida, omogenea, che non aumenta, proveniente dal polo superiore del rene destro. Il tessuto renale normale è visto migliorare inferiormente. Escrezione di contrasto nella pelvi intrappolata dalla massa è visto come iperdensità centrale nel centro della massa. Patofisiologia
La variante classica si presenta solitamente prima dei 3 mesi di età come una massa solida con piccoli focolai di necrosi o emorragia. Non invade i tessuti perinefrici o il peduncolo vascolare. È associato a un esito eccellente dopo la resezione chirurgica completa del tumore. All’esame macroscopico, il tumore solido non è incapsulato, con un aspetto trabecolato simile ai leiomiomi, da cui il nome di amartoma leiomiomatoso del rene. Istologicamente, è costituito da cellule fusate uniformi disposte in fasci con focolai sparsi di glomeruli e tubuli normali intrappolati.
Il tipo cellulare si presenta di solito dopo i 3 mesi di età e dimostra caratteristiche di imaging più aggressive, con aree più grandi di necrosi ed emorragia. Può invadere il grasso perinefrico e i tessuti connettivi. È associato a un tasso più elevato di recidiva locale e di malattia metastatica. All’esame macroscopico, il tipo cellulare è un tumore carnoso con molteplici focolai di necrosi, cambiamento cistico ed emorragia. Istologicamente, è costituito da cellule fusate disposte in fogli disordinati con una tendenza limitata a formare fasci, come si vede nella forma classica.
Un’alterazione genetica frequente è la traslocazione t(12;15) che risulta in una fusione del gene ETV6 su 12p13 e del gene NTRK3 su 15p15 che si verifica quasi esclusivamente nella variante cellulare, che è diagnostica. La reazione a catena della polimerasi di trascrizione inversa (RT-PCR) può dimostrare la fusione del gene ETV6-NTRK3, una caratteristica vista anche nel fibrosarcoma infantile congenito, da cui il nome di fibrosarcoma infantile del rene.
Esame preferito
La massa può essere diagnosticata per la prima volta quando viene eseguita la scansione dettagliata dell’anatomia fetale a 18-20 settimane di gestazione. La differenziazione tra una massa solida e una massa cistica può essere fatta facilmente con l’ecografia per differenziare una massa da un’idronefrosi. Se la massa è molto grande, in alcuni casi può essere difficile determinare l’organo di origine. La risonanza magnetica fetale (MRI) può essere utile per determinare l’organo d’origine grazie all’eccellente dettaglio dei tessuti molli sulla MRI e alla capacità di visualizzare su più piani. Il movimento fetale, tuttavia, può limitare le immagini MRI.
Postnatalmente, l’ecografia è di solito il primo studio di imaging eseguito quando la massa addominale viene palpata. L’ecografia è facilmente e ampiamente disponibile, è poco costosa e non comporta radiazioni ionizzanti. Tutti gli studi di imaging trasversale, come l’ecografia, la tomografia computerizzata (TC) e la risonanza magnetica, possono aiutare a definire l’organo di origine e la relazione con il rene omolaterale. Tuttavia, la risonanza magnetica è la modalità di imaging più accurata nel descrivere l’estensione locale e regionale del tumore. Questo è dovuto alla capacità della risonanza magnetica di visualizzare l’anatomia in diversi piani con grande dettaglio.
In uno studio su 30 bambini (15 maschi, 15 femmine) con nefroma mesoblastico congenito, Chaudry et al hanno trovato che le componenti cistiche erano facilmente identificate sull’ecografia (US), l’emorragia centrale era facilmente identificata sulla scansione CT, e la risonanza magnetica era altamente sensibile per le componenti cistiche e l’emorragia centrale. Gli autori hanno notato che i risultati suggestivi della variante classica includevano un anello ipoecoico periferico o una grande componente solida, mentre il cambiamento cistico/necrotico e l’emorragia erano più comuni nella variante cellulare.
Limitazioni delle tecniche
I risultati di imaging possono suggerire la diagnosi prima o dopo la nascita, e possono essere usati per identificare l’organo di origine. Possono suggerire una diagnosi probabile o più probabile in base alle caratteristiche dell’imaging. Tuttavia, i risultati dell’imaging non possono essere utilizzati per differenziare definitivamente un nefroma mesoblastico da un tumore di Wilms congenito. L’esame istologico è l’unico test definitivo.
L’ecografia è ampiamente disponibile e viene eseguita di routine a livello prenatale. Tuttavia, ha lo svantaggio di essere la modalità più dipendente dall’operatore. I margini del tumore possono non essere visualizzati accuratamente, specialmente con tumori grandi. Nei casi di grandi tumori, l’organo di origine può anche non essere definitivamente determinato.
La TAC non è utile come modalità di imaging prenatale a causa dell’esposizione alle radiazioni ionizzanti e l’uso di contrasto endovenoso. Postnatale, esistono gli stessi svantaggi. Inoltre, il ritardo accurato dopo l’iniezione di contrasto può essere difficile da determinare a causa del piccolo volume di contrasto utilizzato nei neonati. Il contrasto dei tessuti molli in questo gruppo di età è anche limitato, a causa della mancanza di grasso peritoneale. Nei pazienti più anziani, la TAC richiederebbe anche la sedazione.
La risonanza magnetica è sempre più utilizzata come strumento diagnostico prenatale. L’esame MRI prenatale può essere limitato dal movimento fetale e dal disagio materno. Inoltre, la risonanza magnetica può richiedere la sedazione, poiché i tempi tipici dell’esame sono più lunghi. Il contrasto endovenoso può essere necessario per caratterizzare completamente il tumore.