Los tumores neonatales ocurren cada 12.500 a 27.500 nacidos vivos y representan el 2% de las neoplasias infantiles. El nefroma mesoblástico (también llamado hamartoma renal fetal) es el tumor renal más común identificado en el periodo neonatal y el tumor renal benigno más frecuente en la infancia. Representa el 3-10% de todos los tumores renales pediátricos. Este tumor fue descrito por primera vez como una entidad independiente por Bolande et al en 1967. Antes de esto, se confundía erróneamente con el tumor de Wilms congénito.
El diagnóstico del nefroma mesoblástico puede hacerse prenatalmente en la ecografía. El 71% de los embarazos asociados a nefroma mesoblástico presentan polihidramnios. La presentación clínica más común es una masa abdominal asintomática. Pueden presentarse síndromes paraneoplásicos como hipertensión o hipercalcemia. Se cree que la hipertensión es secundaria al aumento de la producción de renina por los glomérulos atrapados en el tumor. El diagnóstico diferencial incluye el tumor de Wilms.
Las características radiológicas del nefroma mesoblástico se muestran en las siguientes imágenes.
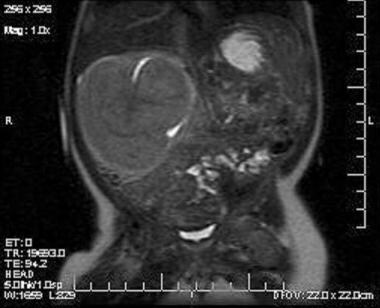 La imagen coronal T2 muestra una masa sólida que surge del polo superior del riñón derecho. El tejido renal normal está desplazado inferiormente. Una parte de la pelvis renal atrapada por la masa aparece como una hiperdensidad en la masa. La masa es isodensa al parénquima renal en todas las secuencias.
La imagen coronal T2 muestra una masa sólida que surge del polo superior del riñón derecho. El tejido renal normal está desplazado inferiormente. Una parte de la pelvis renal atrapada por la masa aparece como una hiperdensidad en la masa. La masa es isodensa al parénquima renal en todas las secuencias.  Imagen T1 coronal a través de la masa que surge del polo superior del riñón derecho. La masa es isodensa al riñón. Muestra señal homogénea sin necrosis central ni hemorragia.
Imagen T1 coronal a través de la masa que surge del polo superior del riñón derecho. La masa es isodensa al riñón. Muestra señal homogénea sin necrosis central ni hemorragia. Patofisiología
La variante clásica suele presentarse antes de los 3 meses de edad como una masa sólida con pequeños focos de necrosis o hemorragia. No invade los tejidos perinéfricos ni el pedículo vascular. Se asocia con un excelente resultado tras la resección quirúrgica completa del tumor. En el examen macroscópico, el tumor sólido no está encapsulado, con un aspecto trabeculado vertiginoso similar al de los leiomiomas, de ahí el nombre de hamartoma leiomiomatoso del riñón. Histológicamente, consiste en células fusiformes uniformes dispuestas en haces con focos dispersos de glomérulos y túbulos normales atrapados.
El tipo celular suele presentarse después de los 3 meses de edad y muestra características de imagen más agresivas, con mayores áreas de necrosis y hemorragia. Puede invadir la grasa perinéfrica y los tejidos conectivos. Se asocia a una mayor tasa de recurrencia local y de enfermedad metastásica. En el examen macroscópico, el tipo celular es un tumor carnoso con múltiples focos de necrosis, cambios quísticos y hemorragia. Histológicamente, consiste en células fusiformes dispuestas en láminas desordenadas con una tendencia limitada a formar haces, como se observa en la forma clásica.
Una alteración genética frecuente es la translocación t(12;15) que da lugar a una fusión del gen ETV6 en 12p13 y el gen NTRK3 en 15p15 que se produce casi exclusivamente en la variante celular, que es diagnóstica. La reacción en cadena de la polimerasa de transcripción inversa (RT-PCR) puede demostrar la fusión del gen ETV6-NTRK3, una característica que también se observa en el fibrosarcoma infantil congénito, de ahí el nombre de fibrosarcoma infantil de riñón.
Examen preferente
La masa puede diagnosticarse por primera vez cuando se realiza la exploración detallada de la anatomía fetal a las 18-20 semanas de gestación. La diferenciación entre una masa sólida y una quística puede realizarse fácilmente en la ecografía para diferenciar entre una masa y una hidronefrosis. Si la masa es muy grande, puede ser difícil determinar el órgano de origen en algunos casos. La resonancia magnética (RM) fetal puede ser útil para determinar el órgano de origen debido al excelente detalle de los tejidos blandos en la RM y a la capacidad de obtener imágenes en múltiples planos. Sin embargo, el movimiento fetal puede limitar las imágenes de la RM.
Postnatalmente, la ecografía suele ser el primer estudio de imagen que se realiza cuando se palpa la masa abdominal. La ecografía es fácil y ampliamente disponible, es barata y no implica radiación ionizante. Todos los estudios de imagen transversales, como la ecografía, la tomografía computarizada (TC) y la RM, pueden ayudar a definir el órgano de origen y la relación con el riñón ipsilateral. Sin embargo, la RM es la modalidad de imagen más precisa para describir la extensión local y regional del tumor. Esto se debe a la capacidad de la RM para mostrar la anatomía en diferentes planos con gran detalle.
En un estudio de 30 niños (15 varones, 15 mujeres) con nefroma mesoblástico congénito, Chaudry et al. encontraron que los componentes quísticos se identificaban fácilmente en la ecografía (US), la hemorragia central se identificaba fácilmente en la TC, y la RM era altamente sensible para los componentes quísticos y la hemorragia central. Los autores observaron que los hallazgos sugestivos de la variante clásica incluían un anillo hipoecoico periférico o un gran componente sólido, mientras que el cambio quístico/necrótico y la hemorragia eran más comunes en la variante celular.
Limitaciones de las técnicas
Los hallazgos de las imágenes pueden sugerir el diagnóstico prenatal o después del nacimiento, y pueden utilizarse para identificar el órgano de origen. Pueden sugerir un diagnóstico probable o más probable basado en las características de las imágenes. Sin embargo, los resultados de las imágenes no pueden utilizarse para diferenciar definitivamente un nefroma mesoblástico de un tumor de Wilms congénito. El examen histológico es la única prueba definitiva.
La ultrasonografía está ampliamente disponible y se realiza rutinariamente de forma prenatal. Sin embargo, tiene la desventaja de ser la modalidad que más depende del operador. Los márgenes del tumor pueden no visualizarse con precisión, especialmente en el caso de tumores grandes. En los casos de tumores grandes, el órgano de origen tampoco puede determinarse de forma definitiva.
La TC no es útil como modalidad de imagen prenatal debido a la exposición a la radiación ionizante y al uso de contraste intravenoso. A nivel postnatal, existen las mismas desventajas. Además, puede ser difícil determinar el retraso exacto tras la inyección de contraste debido al pequeño volumen de contraste utilizado en los neonatos. El contraste de tejidos blandos en este grupo de edad también es limitado, debido a la falta de grasa peritoneal. En pacientes de mayor edad, la TC también requeriría sedación.
La RMN se utiliza cada vez más como herramienta de diagnóstico prenatal. La exploración prenatal por RM puede verse limitada por el movimiento fetal y el malestar materno. Además, la RMN puede requerir sedación, ya que los tiempos de examen típicos son más largos. Puede ser necesario un contraste intravenoso para caracterizar completamente el tumor.