Les tumeurs néonatales surviennent toutes les 12 500 à 27 500 naissances vivantes et représentent 2 % des tumeurs malignes de l’enfant. Le néphrome mésoblastique (également appelé hamartome rénal fœtal) est la tumeur rénale la plus fréquemment identifiée en période néonatale et la tumeur rénale bénigne la plus fréquente dans l’enfance. Elle représente 3 à 10 % de toutes les tumeurs rénales pédiatriques. Cette tumeur a été décrite pour la première fois comme une entité distincte par Bolande et al en 1967. Avant cela, elle était confondue à tort avec la tumeur de Wilms congénitale.
Le diagnostic de néphrome mésoblastique peut être posé de manière anténatale à l’échographie. Un polyhydramnios est rapporté dans 71% des grossesses associées à un néphrome mésoblastique. La présentation clinique la plus courante est une masse abdominale asymptomatique. Des syndromes paranéoplasiques tels que l’hypertension ou l’hypercalcémie peuvent être présents. On pense que l’hypertension est secondaire à une production accrue de rénine par les glomérules piégés dans la tumeur. Le diagnostic différentiel inclut la tumeur de Wilms.
Les caractéristiques radiologiques du néphrome mésoblastique sont démontrées dans les images ci-dessous.
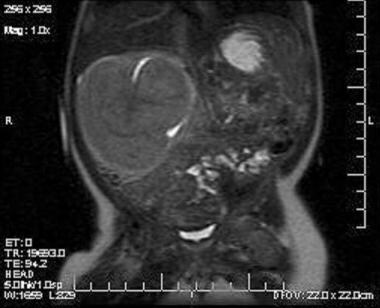 L’image T2 coronale démontre une masse solide survenant du pôle supérieur du rein droit. Le tissu rénal normal est déplacé vers le bas. Une partie du bassin rénal piégée par la masse apparaît comme une hyperdensité dans la masse. La masse est isodense au parenchyme rénal sur toutes les séquences.
L’image T2 coronale démontre une masse solide survenant du pôle supérieur du rein droit. Le tissu rénal normal est déplacé vers le bas. Une partie du bassin rénal piégée par la masse apparaît comme une hyperdensité dans la masse. La masse est isodense au parenchyme rénal sur toutes les séquences.  Image coronale T1 à travers la masse issue du pôle supérieur du rein droit. La masse est isodense par rapport au rein. Elle présente un signal homogène sans nécrose centrale ni hémorragie.
Image coronale T1 à travers la masse issue du pôle supérieur du rein droit. La masse est isodense par rapport au rein. Elle présente un signal homogène sans nécrose centrale ni hémorragie.  Image axiale chez un nourrisson de 3 mois avec une masse abdominale palpable. L’image montre une grande masse solide, homogène, non rehaussée, provenant du pôle supérieur du rein droit. Le tissu rénal normal est visible dans la partie inférieure. L’excrétion de contraste dans le pelvis piégé par la masse est vue comme une hyperdensité centrale au centre de la masse.
Image axiale chez un nourrisson de 3 mois avec une masse abdominale palpable. L’image montre une grande masse solide, homogène, non rehaussée, provenant du pôle supérieur du rein droit. Le tissu rénal normal est visible dans la partie inférieure. L’excrétion de contraste dans le pelvis piégé par la masse est vue comme une hyperdensité centrale au centre de la masse. Pathophysiologie
La variante classique se présente généralement avant l’âge de 3 mois comme une masse solide avec de petits foyers de nécrose ou d’hémorragie. Elle n’envahit pas les tissus périnéphriques ou le pédicule vasculaire. Il est associé à un excellent résultat après une résection chirurgicale complète de la tumeur. À l’examen macroscopique, la tumeur solide n’est pas capsulée et présente un aspect trabéculé et verticillé semblable à celui des léiomyomes, d’où le nom d’hamartome léiomyomateux du rein. Histologiquement, elle est constituée de cellules fusiformes disposées en faisceaux avec des foyers épars de glomérules et de tubules normaux piégés.
Le type cellulaire se présente généralement après l’âge de 3 mois et présente des caractéristiques d’imagerie plus agressives, avec de plus grandes zones de nécrose et d’hémorragie. Il peut envahir la graisse périnéphrique et les tissus conjonctifs. Il est associé à un taux plus élevé de récidive locale et de maladie métastatique. À l’examen macroscopique, le type cellulaire est une tumeur charnue avec de multiples foyers de nécrose, des changements kystiques et des hémorragies. Histologiquement, il est constitué de cellules fusiformes disposées en feuillets désordonnés avec une tendance limitée à former des faisceaux, comme on le voit dans la forme classique.
Une altération génétique fréquente est la translocation t(12;15) résultant en une fusion du gène ETV6 sur 12p13 et du gène NTRK3 sur 15p15 qui se produit presque exclusivement dans la variante cellulaire, qui est diagnostique. La réaction en chaîne de la polymérase par transcription inverse (RT-PCR) peut démontrer la fusion des gènes ETV6-NTRK3, une caractéristique également observée dans le fibrosarcome infantile congénital – d’où le nom de fibrosarcome infantile du rein.
Examen préférentiel
La masse peut être diagnostiquée pour la première fois lors de l’examen détaillé de l’anatomie fœtale réalisé à 18-20 semaines de gestation. La différenciation entre une masse solide et une masse kystique peut facilement être faite à l’échographie pour différencier une masse et une hydronéphrose. Si la masse est très grande, il peut être difficile de déterminer l’organe d’origine dans certains cas. L’imagerie par résonance magnétique (IRM) fœtale peut être utile pour déterminer l’organe d’origine en raison des excellents détails des tissus mous et de la possibilité d’obtenir des images dans plusieurs plans. Le mouvement fœtal, cependant, peut limiter les images IRM.
Postnatalement, l’échographie est généralement la première étude d’imagerie réalisée lorsque la masse abdominale est palpée. L’échographie est facilement et largement disponible, elle est peu coûteuse et n’implique aucun rayonnement ionisant. Toutes les études d’imagerie transversale, telles que l’échographie, la tomodensitométrie (TDM) et l’IRM, peuvent aider à définir l’organe d’origine et la relation avec le rein ipsilatéral. Cependant, l’IRM est la modalité d’imagerie la plus précise pour décrire l’étendue locale et régionale de la tumeur. Dans une étude portant sur 30 enfants (15 garçons, 15 filles) atteints d’un néphrome mésoblastique congénital, Chaudry et al ont constaté que les composants kystiques étaient facilement identifiés à l’échographie (US), que l’hémorragie centrale était facilement identifiée au scanner et que l’IRM était très sensible pour les composants kystiques et l’hémorragie centrale. Les auteurs ont noté que les résultats suggérant la variante classique comprenaient un anneau hypoéchogène périphérique ou un grand composant solide, tandis que les changements kystiques/nécrotiques et l’hémorragie étaient plus fréquents dans la variante cellulaire.
Limites des techniques
Les résultats d’imagerie peuvent suggérer le diagnostic prénatal ou après la naissance, et ils peuvent être utilisés pour identifier l’organe d’origine. Ils peuvent suggérer un diagnostic probable ou le plus probable sur la base des caractéristiques de l’imagerie. Cependant, les résultats d’imagerie ne peuvent pas être utilisés pour différencier définitivement un néphrome mésoblastique d’une tumeur de Wilms congénitale. L’examen histologique est le seul test définitif.
L’ultrasonographie est largement disponible et couramment pratiquée en anténatal. Cependant, elle présente l’inconvénient d’être la modalité la plus dépendante de l’opérateur. Les marges de la tumeur peuvent ne pas être visualisées avec précision, en particulier pour les tumeurs de grande taille. Dans les cas de tumeurs de grande taille, l’organe d’origine peut également ne pas être déterminé de manière définitive.
La tomodensitométrie n’est pas utile comme modalité d’imagerie anténatale en raison de l’exposition aux rayonnements ionisants et de l’utilisation d’un contraste intraveineux. En période postnatale, les mêmes inconvénients existent. De plus, le délai précis après l’injection du contraste peut être difficile à déterminer en raison du petit volume de contraste utilisé chez les nouveau-nés. Le contraste des tissus mous dans ce groupe d’âge est également limité, en raison de l’absence de graisse péritonéale. Chez les patients plus âgés, le scanner nécessiterait également une sédation.
L’IRM est de plus en plus utilisée comme outil de diagnostic prénatal. L’examen IRM prénatal peut être limité par le mouvement du fœtus et l’inconfort de la mère. De plus, l’IRM peut nécessiter une sédation, car la durée typique de l’examen est plus longue. Un contraste intraveineux peut être nécessaire pour caractériser complètement la tumeur.