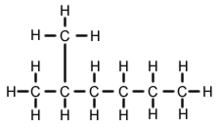
2-Methylhexaan (C7H16, ook bekend als isoheptaan, ethylisobutylmethaan) is een isomeer van heptaan. Het is structureel een hexaanmolecule met een methylgroep aan het tweede koolstofatoom. Het komt in de meeste in de handel verkrijgbare heptaanproducten voor als onzuiverheid, maar wordt gewoonlijk niet als onzuiverheid beschouwd in termen van reacties, aangezien het in vergelijking met n-heptaan (heptaan met rechte ketens) zeer vergelijkbare fysische en chemische eigenschappen heeft.
 |
|
 |
|
 |
|
| Namen | |
|---|---|
| IUPAC-naam
2-Methylhexaan
|
|
| Identifiers | |
|
|
|
3D-model (JSmol)
|
|
| 1696856 | |
| ChemSpider |
|
| ECHA InfoCard | 100..008.847 |
| EC Nummer |
|
|
PubChem CID
|
|
| RTECS nummer |
|
| UNII |
|
| UN-nummer | 3295 |
|
CompTox Dashboard (EPA)
|
|
|
|
|
|
| Eigenschappen | |
| C7H16 | |
| Molaire massa | 100.205 g-mol-1 |
| Opzicht | Kleurloze vloeistof |
| Odor | Odorloos |
| Dichtheid | 0.679 g cm-3 |
| Smeltpunt | -119,0 tot -117,8 °C; -182,3 tot -180,1 °F; 154,1 tot 155,3 K |
| kookpunt | 89,6 tot 90,6 °C; 193,2 tot 195,0 °F; 362.7 tot 363,7 K |
| Dampdruk | 15,7 kPa (bij 37.7 °C) |
|
Wet van Henry
constante (kH) |
19 nmol Pa-1 kg-1 |
| -86.24-10-6 cm3/mol | |
|
Brekingsindex (nD)
|
1.384 |
| Thermochemie | |
|
Warmtecapaciteit (C)
|
222,92 J K-1 mol-1 |
|
Std molaire
entropie (So298) |
323.34 J K-1 mol-1 |
|
Std enthalpie van
vorming (ΔfH⦵298) |
-231,1–228.5 kJ mol-1 |
|
Std enthalpie van
verbranding (ΔcH⦵298) |
-4,8127–4.8103 MJ mol-1 |
| gevaren | |
| GHS-pictogrammen |     |
| GHS Signaalwoord | Gevaar |
| H225, H304, H315, H336, H410 | |
| P210, P261, P273, P301+310, P331 | |
| NFPA 704 (branddiamant) | |
| Vlammend punt | -1 °C (30 °F; 272 K) |
| 280 °C (536 °F; 553 K) | |
| Explosiegrenzen | 1-7% |
| Gerelateerde verbindingen | |
|
Gerelateerde alkanen
|
|
|
Gerelateerde verbindingen
|
|
|
Tenzij anders vermeld, worden de gegevens gegeven voor materialen in hun standaardtoestand (bij 25 °C , 100 kPa).
|
|
| |
|
| Infoboxreferenties | |
Als alkaan is 2-methylhexaan onoplosbaar in water, maar wel oplosbaar in veel organische oplosmiddelen, zoals alcoholen en ether. 2-methylhexaan wordt echter meer als oplosmiddel zelf beschouwd. Daarom wordt het, ook al is het aanwezig in veel in de handel verkrijgbare heptaanproducten, niet als een destructieve onzuiverheid beschouwd, aangezien heptaan gewoonlijk als oplosmiddel wordt gebruikt. Niettemin is het door middel van beknopte destillatie- en raffinageprocessen mogelijk 2-methylhexaan van n-heptaan te scheiden.
In een groep van isomeren hebben die met meer vertakkingen de neiging gemakkelijker te ontbranden en vollediger te ontbranden. Daarom heeft 2-methylhexaan een lagere zelfontbrandingstemperatuur en een lager vlampunt in vergelijking met heptaan. Theoretisch brandt 2-methylhexaan ook met een minder roetachtige vlam, die een hogere frequentie straling afgeeft; aangezien heptaan en 2-methylhexaan echter slechts door één koolstofatoom verschillen, wat vertakking betreft, branden beide met een heldere gele vlam wanneer zij worden ontstoken.
Vergeleken met n-heptaan, heeft 2-methylhexaan ook lagere smelt- en kookpunten. Een lagere dichtheid van vloeistof wordt gevonden in 2-methylhexaan dan heptaan.
Op de NFPA 704 schaal, 2-methylhexaan is vermeld als een reactiviteitsniveau-0 chemische stof, samen met diverse andere alkanen. In feite zijn de meeste alkanen niet reactief, behalve in extreme omstandigheden, zoals bij verbranding of sterk zonlicht. Bij aanwezigheid van zuurstof en vlammen verbrandt 2-methylhexaan, net als heptaan, meestal volledig in water en kooldioxide. Bij UV-licht en vermengd met halogenen in oplosmiddelen, meestal broom in 1,1,1-trichloorethaan, treedt een substitutiereactie op.