Vuonna 1953 Harold Urey ja Stanley Miller tekivät hämmästyttävän kokeen, jossa he tuottivat ”elämän molekyylejä” kaasujen sekoituksesta, jota he ehdottivat olleen olemassa alkukantaisessa maapallossa. Kokeissa simuloitiin, mitä tapahtuisi, kun salamaniskut tarjoaisivat energiaa ilmakehän kemiallisiin reaktioihin, ja ehdotettiin hypoteesia siitä, miten elämä olisi voinut kehittyä planeetallamme. Aminohapot olivat elintärkeitä molekyylejä, jotka muodostuivat tässä kokeessa ja tukivat tätä hypoteesia elämän synnystä.
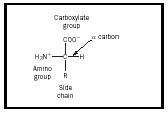
Aminohappo on molekyyli, joka sisältää kaksi funktionaalista ryhmää , amiinin ja karboksyylihapon , kuten kuvassa 1 on esitetty. Tässä kuvassa on lisäksi sivuketjuksi kutsuttu ryhmä, joka on merkitty R:llä. Luonnossa esiintyvissä aminohapoissa havaittava vaihtelu johtuu tämän sivuketjun eroista. Kaksikymmentä luonnossa esiintyvää molekyyliä on lueteltu taulukossa 1. Vesiliuoksessa tämä rakenne voi muuttua siten, että COOH:n protoni siirtyy NH 2:een ja muodostuu zwitterioni. Tämä rakenne riippuu liuoksen pH:sta. Useimmat fysiologiset järjestelmät kuuluvat tällaiselle pH-alueelle, joten aminohappojen zwitterionimuoto on ihmiskehossa vakain muoto.
Aminohappojen stereokemia on myös tärkeä käsite. Kuvassa 1 α:lla merkitty hiiliatomi on kiraalinen, joten aminohappo voi olla yksi kahdesta enantiomeeristä. Huomaa, että kuvassa esitetyssä rakenteessa amiiniryhmä on oikealla ja karboksyyliryhmä ylhäällä. Tätä konfiguraatiota kutsutaan L-muodoksi, ja kaikilla luonnossa esiintyvillä aminohapoilla on tämä muoto.
Aminohapot luokitellaan kolmeen ryhmään sivuketjun luonteen perusteella. Yhdeksän aminohapon sivuketjut ovat poolittomia . Lähes 50 prosentilla proteiineissa esiintyvistä aminohapoista on poolittomat sivuketjut. Toiseen aminohapporyhmään kuuluu kuusi erilaista molekyyliä, joilla on polaariset sivuketjut. Lopuksi viiden aminohapon ryhmässä on sivuketjuja, jotka eivät ole vain polaarisia vaan myös varattuja.
Aminohappojen keskeinen kemiallinen ominaisuus on, että ne linkittyvät toisiinsa muodostaen proteiineja. Koska COOH-funktionaalinen ryhmä on happo ja NH 2 -funktionaalinen ryhmä on emäs, aminohappojen molemmat päät voivat helposti reagoida keskenään. Proteiinisynteesi on monimutkaisempi kuin yksinkertainen happo-emäs-neutralisaatio, mutta mieti, mitä tapahtuu, kun kaksi amino-
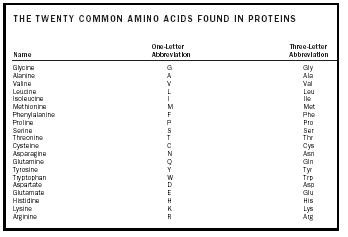
| KAKSIKYMMENTÄ YLEISTÄ PROTEIINISSA ESIINTYVÄÄ AMINOHAPPOA | |||||||||||
| Nimi | Yksikirjaiminen lyhenne | Kolmen-Kirjainlyhenne | |||||||||
| Glysiini | G | Gly | |||||||||
| Alaniini | A | A | Ala | ||||||||
| Valiini | V | Val | |||||||||
| Leusiini | L | Leu | |||||||||
| Isoleusiini | I | Ile | |||||||||
| Metioniini | M | Met | |||||||||
| Fenyylialaniini | F | F | F | F | F | F | F | F | F | P | Pro |
| Seriini | S | Ser | |||||||||
| Treoniini | T | Thr | |||||||||
| Kysteiini | C | Cys | |||||||||
| Asparagiini | N | Asn | |||||||||
| Glutamiini | Q | Gln | |||||||||
| Tyrosiini | Y | Tyr | |||||||||
| Trp | |||||||||||
| Aspartaatti | |||||||||||
| Aspartaatti | |||||||||||
| Aspartaatti | D | Asp | |||||||||
| Glutamaatti | E | Glu | |||||||||
| Histidiini | H | His | |||||||||
| Lysiini | K | Lys | |||||||||
| Arginiini | R | Arg | |||||||||
hapot reagoivat muodostaen peptidisidoksen. Uudella molekyylillä, joka on nyt kahden aminohappojäännöksen muodostama dimeeri, on edelleen toinen pää, joka on happo, ja toinen pää, joka on emäs, joten on ilmeistä, että prosessi peptidisidoksen muodostamiseksi toisen aminohapon kanssa voidaan toistaa. Jos monta aminohappoa liitetään yhteen, tuloksena on luonnollinen polymeeri – proteiini.