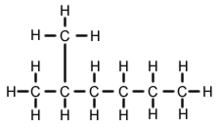
2-metyyliheksaani (C7H16, tunnetaan myös nimellä isoheptaani, etyyliisobutyylimetaani) on heptaanin isomeeri. Se on rakenteeltaan heksaanimolekyyli, jonka toiseen hiiliatomiin on liitetty metyyliryhmä. Sitä esiintyy useimmissa kaupallisesti saatavilla olevissa heptaanituotteissa epäpuhtautena, mutta sitä ei yleensä pidetä epäpuhtautena reaktioiden kannalta, koska sillä on hyvin samanlaiset fysikaaliset ja kemialliset ominaisuudet kuin n-heptaanilla (suoraketjuinen heptaani).
 |
||
 |
||
 |
||
| Nimet | ||
|---|---|---|
| IUPAC-nimi
2-Metyyliheksaani
|
||
| Tunnukset | ||
|
||
|
3D-malli (JSmol)
|
||
| 1696856 | ||
| ChemSpider |
|
|
| ECHA InfoCard | 100.008.847 |
|
| EC-numero |
|
|
|
PubChem CID
|
||
| RTECS numero |
|
|
| UNII |
|
|
| UN numero | 3295 | |
|
CompTox Dashboard (EPA)
|
||
|
||
|
||
| Ominaisuudet | ||
| C7H16 | ||
| Molaarinen massa | 100.205 g-mol-1 | |
| Eritys | Väritön neste | |
| Haju | Hajuttomuus | |
| Tiheys | 0.679 g cm-3 | |
| Sulamispiste | -119,0 – -117,8 °C; -182,3 – -180,1 °F; 154,1 – 155,3 K | |
| Kiehumispiste | 89,6 – 90,6 °C; 193,2 – 195,0 °F; 362.7 – 363.7 K | |
| Höyrynpaine | 15.7 kPa (37.7 °C) | |
|
Henryn laki
vakio (kH) |
19 nmol Pa-1 kg-1 | |
| -86.24-10-6 cm3/mol | ||
|
Taitekerroin (nD)
|
1.384 | |
| Lämpökemia | ||
|
Lämpökapasiteetti (C)
|
222.92 J K-1 mol-1 | |
|
Std molaarinen
entropia (So298) |
323.34 J K-1 mol-1 | |
|
Std
muodostumisentalpia (ΔfH⦵298) |
-231.1–228.5 kJ mol-1 | |
|
Std
palamisen entalpia (ΔcH⦵298) |
-4.8127–4.8103 MJ mol-1 | |
| Vaarat | ||
| GHS-piktogrammit |     |
|
| GHS-merkkisana | Vaara | |
| H225, H304, H315, H315, H336, H410 | ||
| P210, P261, P273, P301+310, P331 | ||
| NFPA 704 (palotimantti) | ||
| Leimahduspiste | -1 °C (30 °F; 272 K) | |
| 280 °C (536 °F; 553 K) | ||
| Räjähdysrajat | 1-7 % | |
| Seuraavat yhdisteet | ||
|
Seuraavat Alkaanit
|
||
|
Suhteessa olevat yhdisteet
|
||
|
Ei toisin mainita, tiedot on annettu materiaaleille niiden vakiotilassa (25 °C , 100 kPa).
|
||
| |
||
| Infobox viitteet | ||
Alkaanina 2-metyyliheksaani ei liukene veteen, mutta liukenee moniin orgaanisiin liuottimiin, kuten alkoholeihin ja eetteriin. Yleisemmin 2-metyyliheksaania pidetään kuitenkin itse liuottimena. Vaikka sitä esiintyy monissa kaupallisesti saatavilla olevissa heptaanituotteissa, sitä ei pidetä tuhoisana epäpuhtautena, koska heptaania käytetään yleensä liuottimena. Suppeilla tislaus- ja jalostusprosesseilla on kuitenkin mahdollista erottaa 2-metyyliheksaani n-heptaanista.
Isomeerien ryhmässä ne, joissa on enemmän haaroja, syttyvät helpommin ja palavat täydellisemmin. Siksi 2-metyyliheksaanilla on heptaaniin verrattuna alhaisempi itsesyttymislämpötila ja leimahduspiste. Teoreettisesti 2-metyyliheksaani palaa myös vähemmän nokisella liekillä ja säteilee korkeamman taajuuden säteilyä; kuitenkin koska heptaani ja 2-metyyliheksaani eroavat toisistaan vain yhden hiiliatomin verran haarautumisen suhteen, molemmat palavat kirkkaankeltaisella liekillä sytytettäessä.
N-heptaaniin verrattuna 2-metyyliheksaanilla on myös alhaisemmat sulamis- ja kiehumispisteet. 2-metyyliheksaanilla on pienempi nestetiheys kuin heptaanilla.
NFPA 704 -asteikolla 2-metyyliheksaani on listattu reaktiivisuustasolle 0 kuuluvaksi kemikaaliksi yhdessä useiden muiden alkaanien kanssa. Itse asiassa useimmat alkaanit eivät ole reaktiivisia paitsi äärimmäisissä olosuhteissa, kuten palamisessa tai voimakkaassa auringonvalossa. Hapen ja liekin läsnä ollessa 2-metyyliheksaani palaa heptaanin tavoin lähes kokonaan vedeksi ja hiilidioksidiksi. UV-valon vaikutuksesta ja liuottimissa olevien halogeenien, yleensä bromin 1,1,1-trikloorietaanissa, kanssa sekoittuneena tapahtuu substituutioreaktio.