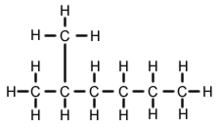
2-Metylhexan (C7H16, även känt som isoheptan, etylisobutylmetan) är en isomer av heptan. Det är strukturellt sett en hexanmolekyl med en metylgrupp knuten till sin andra kolatom. Den förekommer i de flesta kommersiellt tillgängliga heptanprodukter som en förorening, men betraktas vanligtvis inte som en förorening när det gäller reaktioner eftersom den har mycket likartade fysikaliska och kemiska egenskaper jämfört med n-heptan (rak kedjad heptan).
 |
|
 |
|
 |
|
| Namn | |
|---|---|
| IUPAC-namn
2-Metylhexan
|
|
| Identifieringar | |
|
|
|
3D-modell (JSmol)
|
|
| 1696856 | |
| ChemSpider |
|
| ECHA InfoCard | 100.008.847 |
| EC-nummer |
|
|
PubChem CID
|
|
| RTECS nummer |
|
| UNII |
|
| UN-nummer | 3295 |
|
CompTox Dashboard (EPA)
|
|
|
|
|
|
| Egenskaper | |
| C7H16 | |
| Molarmassa | 100.205 g-mol-1 |
| Utseende | Färglös vätska |
| Odör | Odörfri |
| Täthet | 0.679 g cm-3 |
| Smältpunkt | -119,0 till -117,8 °C; -182,3 till -180,1 °F; 154,1 till 155,3 K |
| Kokpunkt | 89,6 till 90,6 °C; 193,2 till 195,0 °F; 362.7 till 363,7 K |
| Damptryck | 15,7 kPa (vid 37.7 °C) |
|
Henrys lag
konstant (kH) |
19 nmol Pa-1 kg-1 |
| -86.24-10-6 cm3/mol | |
|
Brytningsindex (nD)
|
1.384 |
| Thermokemi | |
|
Värmekapacitet (C)
|
222,92 J K-1 mol-1 |
|
Std molar
entropi (So298) |
323.34 J K-1 mol-1 |
|
Std entalpi för
bildning (ΔfH⦵298) |
-231.1–228.5 kJ mol-1 |
|
Std entalpi för
förbränning (ΔcH⦵298) |
-4.8127–4.8103 MJ mol-1 |
| Faror | |
| GHS-piktogram |     |
| GHS Signalord | Faran |
| H225, H304, H315, H336, H410 | |
| P210, P261, P273, P301+310, P331 | |
| NFPA 704 (branddiamant) | |
| Flampunkt | -1 °C (30 °F; 272 K) |
| 280 °C (536 °F; 553 K) | |
| Explosionsgränser | 1-7% |
| Relaterade föreningar | |
|
Relaterade Alkaner
|
|
|
Relaterade föreningar
|
|
|
Med undantag för när annat anges, data anges för material i standardtillstånd (vid 25 °C, 100 kPa).
|
|
| |
|
| Infobox referenser | |
Som alkan är 2-metylhexan olösligt i vatten, men lösligt i många organiska lösningsmedel, såsom alkoholer och eter. 2-metylhexan betraktas dock oftare som ett lösningsmedel i sig självt. Även om det förekommer i många kommersiellt tillgängliga heptanprodukter betraktas det därför inte som en destruktiv förorening, eftersom heptan vanligen används som lösningsmedel. Genom kortfattade destillations- och raffineringsprocesser är det dock möjligt att separera 2-metylhexan från n-heptan.
I en grupp isomerer tenderar de med fler grenar att antändas lättare och förbrännas mer fullständigt. Därför har 2-metylhexan en lägre självantändningstemperatur och flampunkt jämfört med heptan. Teoretiskt sett brinner 2-metylhexan också med en mindre sotig låga och avger högre frekvensstrålning, men eftersom heptan och 2-metylhexan endast skiljer sig åt med en kolatom när det gäller förgreningar, brinner båda med en ljusgul låga när de antänds.
Varvid 2-metylhexan jämfört med n-heptan också har lägre smält- och kokpunkt. En lägre vätsketäthet finns i 2-metylhexan än i heptan.
På NFPA 704-skalan är 2-metylhexan listat som en kemikalie med reaktivitetsnivå 0, tillsammans med olika andra alkaner. I själva verket är de flesta alkaner oreaktiva utom under extrema förhållanden, t.ex. vid förbränning eller starkt solljus. Vid närvaro av syre och eld förbränns 2-metylhexan, liksom heptan, nästan helt och hållet till vatten och koldioxid. Vid UV-ljus och blandat med halogener i lösningsmedel, vanligen brom i 1,1,1,1-trikloretan, uppstår en substitutionsreaktion.