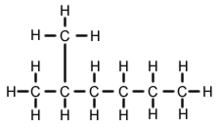
2-metilhexanul (C7H16, cunoscut și sub numele de izoheptan, etilizobutilmetan) este un izomer al heptanului. Din punct de vedere structural, este o moleculă de hexan cu o grupare metil atașată celui de-al doilea atom de carbon. Există în majoritatea produselor de heptan disponibile în comerț ca impuritate, dar, de obicei, nu este considerat ca impuritate în ceea ce privește reacțiile, deoarece are proprietăți fizice și chimice foarte asemănătoare în comparație cu n-heptanul (heptanul cu catenă dreaptă).
 |
||
 |
||
 |
||
| Nume | ||
|---|---|---|
| Numele IUPAC
2-Metilhexan
|
||
| Identificatori | ||
|
||
|
Model 3D (JSmol)
|
||
| 1696856 | ||
| ChemSpider |
|
|
| ECHA InfoCard | 100.008.847 |
|
| Numărul CE |
|
|
|
PubChem CID
|
||
| RTECS număr |
|
|
| UNII |
|
|
| Numărul ONU | 3295 | |
|
. CompTox Dashboard (EPA)
|
||
|
||
|
||
| Proprietăți | ||
| C7H16 | ||
| Masa molară | 100.205 g-mol-1 | |
| Aparență | Lichid incolor | |
| Odor | Inodor | Inodor |
| Densitate | 0.679 g cm-3 | |
| Punct de topire | -119,0 până la -117,8 °C; -182,3 până la -180,1 °F; 154,1 până la 155,3 K | |
| Punct de fierbere | 89,6 până la 90,6 °C; 193,2 până la 195,0 °F; 362.7 până la 363,7 K | |
| Presiune de vapori | 15,7 kPa (la 37.7 °C) | |
|
Legea lui Henry
constanta (kH) |
19 nmol Pa-1 kg-1 | |
| -86.24-10-6 cm3/mol | ||
|
Indice de refracție (nD)
|
1.384 | |
| Termochimie | ||
|
Capacitate termică (C)
|
222,92 J K-1 mol-1 | |
|
entropie molară std
(So298) |
323.34 J K-1 mol-1 | |
|
Entalpia std de
formare (ΔfH⦵298) |
-231,1–228.5 kJ mol-1 | |
|
Std entalpie de
combustie (ΔcH⦵298) |
-4,8127–4.8103 MJ mol-1 | |
| Pericole | ||
| Pictogramele GHS |     |
|
| GHS Cuvânt semnal | Pericol | |
| H225, H304, H315, H336, H410 | ||
| P210, P261, P273, P301+310, P331 | ||
| NFPA 704 (diamant de foc) | ||
| Punctul de aprindere | -1 °C (30 °F; 272 K) | |
| 280 °C (536 °F; 553 K) | ||
| Limitele de explozie | 1-7% | |
| Compuși înrudiți | ||
|
Compuși înrudiți. alcani
|
||
|
Compuși înrudiți
|
||
|
Cu excepția cazurilor în care se menționează altfel, datele sunt date pentru materialele în starea lor standard (la 25 °C , 100 kPa).
|
||
| |
||
| Referințe infobox | ||
Fiind un alcan, 2-metilhexanul este insolubil în apă, dar este solubil în mulți solvenți organici, cum ar fi alcooli și eter. Cu toate acestea, 2-metilhexanul este considerat mai frecvent ca fiind un solvent în sine. Prin urmare, chiar dacă este prezent în multe produse de heptan disponibile în comerț, acesta nu este considerat o impuritate distructivă, deoarece heptanul este utilizat de obicei ca solvent. Cu toate acestea, prin procese concise de distilare și rafinare, este posibilă separarea 2-metilhexanului de n-heptan.
În cadrul unui grup de izomeri, cei cu mai multe ramificații au tendința de a se aprinde mai ușor și de a arde mai complet. Prin urmare, 2-metilhexanul are o temperatură de autoaprindere și un punct de inflamabilitate mai mici în comparație cu heptanul. Teoretic, 2-metilhexanul arde, de asemenea, cu o flacără mai puțin funinginoasă, emițând radiații de frecvență mai mare; cu toate acestea, deoarece heptanul și 2-metilhexanul diferă doar printr-un singur atom de carbon, în ceea ce privește ramificarea, ambele ard cu o flacără galben strălucitor atunci când se aprind.
În comparație cu n-heptanul, 2-metilhexanul are, de asemenea, puncte de topire și de fierbere mai mici. În 2-metilhexan se găsește o densitate a lichidului mai mică decât în cazul heptanului.
Pe scara NFPA 704, 2-metilhexanul este listat ca substanță chimică cu nivel de reactivitate 0, împreună cu diverși alți alcani. De fapt, majoritatea alcanilor nu sunt reactivi decât în condiții extreme, cum ar fi combustia sau lumina puternică a soarelui. În prezența oxigenului și a flăcării, 2-metilhexanul, ca și heptanul, se transformă în cea mai mare parte complet în apă și dioxid de carbon. La lumina UV și în amestec cu halogenii din solvenți, de obicei brom în 1,1,1-tricloretan, are loc o reacție de substituție.
.