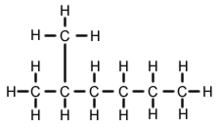
2-Metilhexano (C7H16, também conhecido como isoheptano, etilisobutil-metano) é um isómero do heptano. É estruturalmente uma molécula de hexano com um grupo metilo ligado ao seu segundo átomo de carbono. Existe na maioria das mercadorias de heptano comercialmente disponíveis como uma impureza, mas normalmente não é considerado como impureza em termos de reacções, uma vez que tem propriedades físicas e químicas muito semelhantes quando comparado com o n-heptano (heptano de cadeia recta).
 |
|
 |
|
 |
|
| Nomes | |
|---|---|
| Nome IUPAC
2-Metil-hexano
|
|
| Identificadores | |
|
|
|
3D modelo (JSmol)
|
|
| 1696856 | |
| ChemSpider |
|
| ECHA InfoCard | 100.008.847 |
| Número de CE |
|
|
PubChem CID
|
|
| RTECS número |
|
| UNII |
|
| número de ONU | 3295 |
|
CompTox Dashboard (EPA)
|
|
|
|
|
|
| Propriedades | |
| C7H16 | |
| Massa solar | 100.205 g-mol-1 |
| Aspecto | Líquido sem cor |
| Odor | Odorless |
| Densidade | 0.679 g cm-3 |
| Ponto de fusão | -119,0 a -117,8 °C; -182,3 a -180,1 °F; 154,1 a 155,3 K |
| Ponto de fusão | 89,6 a 90,6 °C; 193,2 a 195,0 °F; 362.7 a 363,7 K |
| Pressão de vapor | 15,7 kPa (a 37.7 °C) |
|
Lei de Henry
constante (kH) |
19 nmol Pa-1 kg-1 |
| -86.24-10-6 cm3/mol | |
|
Índice de refração (nD)
|
1.384 |
| Termochemistry | |
|
Capacidade calorífica (C)
|
222.92 J K-1 mol-1 |
|
Std molar
entropy (So298) |
323.34 J K-1 mol-1 |
|
Entalpia Std de
formação (ΔfH⦵298) |
-231.1–228.5 kJ mol-1 |
|
Entalpia Std de
combustão (ΔcH⦵298) |
-4.8127–4.8103 MJ mol-1 |
| Perigos | |
| Pictogramas GHS |     |
| GHS Palavra de sinalização | Perigo |
| H225, H304, H315, H336, H410 | |
| P210, P261, P273, P301+310, P331 | |
| NFPA 704 (diamante de fogo) | |
| Ponto de inflamação | -1 °C (30 °F; 272 K) |
| 280 °C (536 °F; 553 K) | |
| Limites explosivos | 1-7% |
| Compostos relacionados | |
|
Compostos relacionados alcanos
|
|
|
Compostos relacionados
|
|
|
Exceto onde de outra forma observado, são fornecidos dados para materiais no seu estado padrão (a 25 °C , 100 kPa).
|
|
| |
|
| ReferênciasInfobox | |
Sendo um alcano, o 2-metil-hexano é insolúvel em água, mas é solúvel em muitos solventes orgânicos, tais como álcoois e éteres. Entretanto, o 2-metil-hexano é mais comumente considerado como um solvente em si. Portanto, embora esteja presente em muitos produtos de heptano disponíveis comercialmente, não é considerado como uma impureza destrutiva, pois o heptano é normalmente utilizado como solvente. No entanto, por processos concisos de destilação e refinação, é possível separar o 2-metil-hexano do n-heptano.
Em um grupo de isómeros, aqueles com mais ramos tendem a inflamar-se mais facilmente e a entrar em combustão mais completa. Portanto, o 2-metil-hexano tem uma temperatura de auto-ignição e ponto de fulgor mais baixos quando comparado com o heptano. Teoricamente o 2-metil-hexano também queima com uma chama menos fuliginosa, emitindo radiação de maior freqüência; entretanto, como o heptano e o 2-metil-hexano diferem por apenas um átomo de carbono, em termos de ramificação, ambos queimam com uma chama amarela brilhante quando inflamados.
Comparado ao n-heptano, o 2-metil-hexano também tem pontos de fusão e de ebulição mais baixos. Uma densidade menor do líquido é encontrada no 2-metil-hexano do que no heptano.
Na escala NFPA 704, o 2-metil-hexano é listado como um nível de reatividade química 0, juntamente com vários outros alcanos. Na verdade, a maioria dos alcanos não são reactivos, excepto em condições extremas, tais como combustão ou luz solar forte. Na presença de oxigênio e chama, o 2-metil-hexano, como o heptano, entra em combustão, em sua maioria, completamente em água e dióxido de carbono. Com luz UV e misturado com halogéneos em solventes, geralmente bromo em 1,1,1-tricloroetano, ocorre uma reacção de substituição.