W 1953 roku Harold Urey i Stanley Miller przeprowadzili zdumiewający eksperyment, w którym wyprodukowali „cząsteczki życia” z mieszaniny gazów, które według nich istniały w pierwotnej ziemi. Eksperymenty symulowały to, co by się stało, gdyby uderzenia piorunów dostarczyły energii do reakcji chemicznych w atmosferze i zasugerowały hipotezę, jak życie mogło rozwinąć się na naszej planecie. Aminokwasy były istotne cząsteczki, które utworzyły się w tym eksperymencie i wsparły tę hipotezę pochodzenia życia.
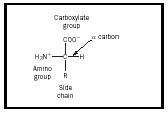
Aminokwas jest cząsteczką, która zawiera dwie grupy funkcyjne, aminy i kwasu karboksylowego, jak pokazano na rysunku 1. W tej ilustracji istnieje dodatkowa grupa zwana łańcuchem bocznym, oznaczona literą R. Różnice widoczne w naturalnie występujących aminokwasach wynikają z różnic w tym łańcuchu bocznym. Dwadzieścia naturalnie występujących cząsteczek jest wymienionych w tabeli 1. W roztworze wodnym struktura ta może ulec zmianie w ten sposób, że proton z COOH przenosi się na NH 2 i powstaje zwitterion. Struktura ta zależy od pH roztworu. Większość systemów fizjologicznych mieści się w takim zakresie pH, więc forma zwitterionowa aminokwasów jest najbardziej stabilną formą w organizmie człowieka.
Ważnym pojęciem jest również stereochemia aminokwasów. Atom węgla oznaczony α na rysunku 1 jest chiralny, więc aminokwas może być jednym z dwóch enancjomerów. Zauważ, że struktura pokazana na rysunku ma grupę aminową po prawej stronie, a grupę karboksylową na górze. Ta konfiguracja jest określana jako forma L i wszystkie naturalnie występujące aminokwasy mają tę formę.
Aminokwasy są sklasyfikowane w trzech grupach w oparciu o charakter łańcucha bocznego. Dziewięć z aminokwasów ma łańcuchy boczne, które są niepolarne . Prawie 50 procent aminokwasów, które są obecne w białkach mają niepolarne łańcuchy boczne. Druga kategoria aminokwasów zawiera sześć różnych cząsteczek, które mają polarne łańcuchy boczne. Wreszcie, grupa pięciu aminokwasów ma łańcuchy boczne, które są nie tylko polarne, ale naładowane.
Kluczową cechą chemiczną aminokwasów jest to, że łączą się one ze sobą tworząc białka. Ponieważ grupa funkcyjna COOH jest kwasem, a grupa funkcyjna NH 2 jest zasadą, oba końce aminokwasów mogą łatwo reagować ze sobą. Synteza białek jest bardziej skomplikowana niż prosta neutralizacja kwasowo-zasadowa, ale rozważ, co się dzieje, gdy dwa aminokwasy
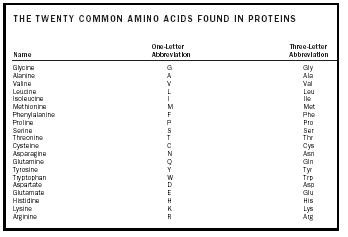
| THE TWENTY COMMON AMINO ACIDS FOUND IN PROTEINS | |||
| Nazwa | Skrót jednoliterowy | Skrót trzyliterowy | Three-Skrót literowy |
| Glicyna | G | Gly | |
| Alanina | A | Ala | |
| Walina | V | Val | |
| Leu | L | Leu | |
| Izoleucyna | I | I | Ile |
| Metionina | M | Met | |
| Fenyloalanina | F | Phe | |
| Prolina | P | Pro | |
| Seryna | S | Ser | |
| Treonina | T | Thr | |
| Cysteina | C | Cys | |
| Asparagina | N | Asn | |
| Glutamina | Q | . Gln | |
| Tyrozyna | Y | Tyr | |
| Tryptofan | W | Trp | |
| Asparaginian | D | Asp | |
| Glutaminian | E | Glu | |
| Histydyna | H | His | |
| Lizyna | K | Lys | |
| Arginina | R | Arg | |
kwasy reagują, tworząc wiązanie peptydowe. Nowa cząsteczka, teraz dimer z dwoma resztami aminokwasowymi, nadal ma jeden koniec, który jest kwasem, a drugi koniec, który jest zasadą, więc widać, że proces tworzenia wiązania peptydowego z innym aminokwasem można powtórzyć. Jeśli wiele aminokwasów jest połączonych razem, rezultatem jest naturalny polimer – białko.