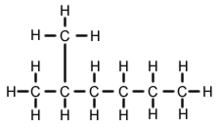
2-Metyloheksan (C7H16, znany również jako izoheptan, etylisobutylometan) jest izomerem heptanu. Strukturalnie jest to cząsteczka heksanu z grupą metylową dołączoną do drugiego atomu węgla. Występuje w większości dostępnych w handlu heptanów jako zanieczyszczenie, ale zazwyczaj nie jest uważany za zanieczyszczenie w odniesieniu do reakcji, ponieważ ma bardzo podobne właściwości fizyczne i chemiczne w porównaniu z n-heptanem (heptanem o prostych łańcuchach).
 |
|
 |
|
 |
|
| Nazwy | |
|---|---|
| Nazwa IUPAC
2-Metyloheksan
|
|
| Identyfikatory | |
|
|
|
Model 3D (JSmol)
|
|
| 1696856 | |
| ChemSpider |
|
| ECHA InfoCard | 100.008.847 |
| EC Number |
|
|
PubChem CID
|
|
| RTECS numer |
|
| UNII |
|
| numer ONZ | 3295 |
|
. CompTox Dashboard (EPA)
|
|
|
|
|
|
| Właściwości | |
| C7H16 | |
| Masa molowa | 100.205 g-mol-1 |
| Wygląd | Ciecz bezbarwna |
| Odór | Bezodorowy |
| Gęstość | 0.679 g cm-3 |
| Temperatura topnienia | -119,0 do -117,8 °C; -182,3 do -180,1 °F; 154,1 do 155,3 K |
| Temperatura wrzenia | 89,6 do 90,6 °C; 193,2 do 195,0 °F; 362.7 do 363.7 K |
| Ciśnienie pary | 15.7 kPa (przy 37.7 °C) |
|
Prawo Henry’ego
stała (kH) |
19 nmol Pa-1 kg-1 |
| -86.24-10-6 cm3/mol | |
|
Współczynnik załamania światła (nD)
|
1.384 |
| Termochemia | |
|
Pojemność cieplna (C)
|
222,92 J K-1 mol-1 |
|
Std molar
entropia (So298) |
323.34 J K-1 mol-1 |
|
Std entalpia
formacji (ΔfH⦵298) |
-231,1–228.5 kJ mol-1 |
|
Std entalpia
spalania (ΔcH⦵298) |
-4,8127–4.8103 MJ mol-1 |
| Zagrożenia | |
| Piktogramy GHS |     |
| GHS Słowo sygnałowe | Niebezpieczeństwo |
| H225, H304, H315, H336, H410 | |
| P210, P261, P273, P301+310, P331 | |
| NFPA 704 (diament ogniowy) | |
| Punkt zapłonu | -1 °C (30 °F; 272 K) |
| 280 °C (536 °F; 553 K) | |
| Granice wybuchowości | 1-7% |
| Związki pokrewne | |
|
Związki pokrewne alkany
|
|
|
Związki pokrewne
|
|
|
Z wyjątkiem przypadków, w których wskazano inaczej, dane są podane dla materiałów w ich stanie standardowym (w temperaturze 25 °C, 100 kPa).
|
|
| |
|
| Infobox references | |
Będąc alkanem, 2-metyloheksan jest nierozpuszczalny w wodzie, ale jest rozpuszczalny w wielu rozpuszczalnikach organicznych, takich jak alkohole i eter. Jednakże 2-metyloheksan jest bardziej powszechnie uważany za rozpuszczalnik sam w sobie. Dlatego też, nawet jeśli jest on obecny w wielu dostępnych w handlu produktach zawierających heptan, nie jest on uważany za zanieczyszczenie destrukcyjne, ponieważ heptan jest zwykle stosowany jako rozpuszczalnik. Niemniej jednak, poprzez zwięzłe procesy destylacji i rafinacji, możliwe jest oddzielenie 2-metyloheksanu od n-heptanu.
W grupie izomerów, te z większą liczbą rozgałęzień mają tendencję do łatwiejszego zapłonu i pełniejszego spalania. Dlatego 2-metyloheksan ma niższą temperaturę samozapłonu i temperaturę zapłonu w porównaniu z heptanem. Teoretycznie 2-metyloheksan spala się również z mniej słonym płomieniem, emitując promieniowanie o wyższej częstotliwości; jednakże, ponieważ heptan i 2-metyloheksan różnią się tylko jednym atomem węgla, jeśli chodzi o rozgałęzienia, oba spalają się z jasnożółtym płomieniem podczas zapłonu.
W porównaniu z n-heptanem, 2-metyloheksan ma również niższe temperatury topnienia i wrzenia. Mniejsza gęstość cieczy występuje w 2-metyloheksanie niż w heptanie.
W skali NFPA 704, 2-metyloheksan jest wymieniony jako substancja chemiczna o poziomie reaktywności 0, wraz z różnymi innymi alkanami. W rzeczywistości większość alkanów jest niereaktywna, z wyjątkiem ekstremalnych warunków, takich jak spalanie lub silne światło słoneczne. W obecności tlenu i płomienia, 2-metyloheksan, podobnie jak heptan, spala się w większości przypadków całkowicie do wody i dwutlenku węgla. W świetle UV i zmieszany z halogenami w rozpuszczalnikach, zwykle bromem w 1,1,1-trichloroetanie, zachodzi reakcja substytucji.
.