1953-ban Harold Urey és Stanley Miller elképesztő kísérletet hajtott végre, amelyben “életmolekulákat” állítottak elő olyan gázkeverékből, amely szerintük az ősföldön létezett. A kísérletek azt szimulálták, hogy mi történne, ha a villámcsapás energiát szolgáltatna a légkörben zajló kémiai reakciókhoz, és felvetettek egy hipotézist arra vonatkozóan, hogyan alakulhatott ki az élet a bolygónkon. Az aminosavak voltak azok a létfontosságú molekulák, amelyek ebben a kísérletben keletkeztek, és alátámasztották az élet eredetére vonatkozó hipotézist.
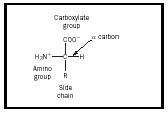
Az aminosav olyan molekula, amely két funkciós csoportot , egy amint és egy karbonsavat tartalmaz, ahogy az 1. ábrán látható. Ezen az ábrán van egy további csoport, az úgynevezett oldallánc, amelyet R-vel jelölünk. A természetben előforduló aminosavakban megfigyelhető eltérések ennek az oldalláncnak a különbözőségéből adódnak. A természetben előforduló húsz molekulát az 1. táblázat tartalmazza. Vizes oldatban ez a szerkezet megváltozhat úgy, hogy a COOH-ból egy proton átkerül az NH 2 -re, és egy zwitterion keletkezik. Ez a szerkezet az oldat pH-értékétől függ. A legtöbb élettani rendszer ilyen pH-tartományba esik, így az aminosavak zwitterionos formája a legstabilabb forma az emberi szervezetben.
Az aminosavak sztereokémiája szintén fontos fogalom. Az 1. ábrán α-val jelölt szénatom királis, így egy aminosav két enantiomer közül az egyik lehet. Figyeljük meg, hogy az ábrán látható szerkezetben az amincsoport jobbra, a karboxilcsoport pedig felül helyezkedik el. Ezt a konfigurációt L-formának nevezzük, és a természetben előforduló összes aminosavnak ez a formája.
Az aminosavakat az oldallánc jellege alapján három csoportba sorolják. Az aminosavak közül kilencnek az oldalláncai nem polárisak . A fehérjékben előforduló aminosavak közel 50 százalékának van nem poláris oldallánca. Az aminosavak második kategóriájába hat különböző molekula tartozik, amelyek poláros oldallánccal rendelkeznek. Végül egy öt aminosavból álló csoportnak nemcsak poláris, hanem töltött oldalláncai is vannak.
Az aminosavak legfontosabb kémiai jellemzője, hogy összekapcsolódva fehérjéket alkotnak. Mivel a COOH funkciós csoport sav, az NH 2 funkciós csoport pedig bázis, az aminosavak két vége könnyen reagálhat egymással. A fehérjeszintézis bonyolultabb, mint egy egyszerű sav-bázis semlegesítés, de gondoljunk csak arra, mi történik, ha két amino
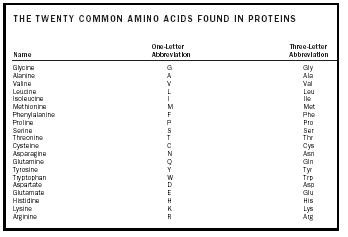
| A FEHÉRJÉKBEN LÁTOTT HÚSZ KÖZÖS AMINOSAV | |||
| Név | Egybetűs rövidítés | Hárombetűs rövidítés | Három…Betűs rövidítés |
| Glicin | G | Gly | |
| Alanin | A | Ala | Ala |
| Valin | V | Val | |
| Leucin | L | Leu | |
| Isoleucin | I | Ile | |
| Metionin | M | Met | |
| Phenylalanine | F | Phe | |
| Proline | P | Pro | |
| Serin | S | Ser | |
| Treonin | T | Thr | |
| Cisztein | C | Cys | |
| Asparagin | N | Asn | |
| Glutamin | Q | Gln | |
| Tyrozin | Y | Tyr | |
| Tryptofán | W | Trp | |
| Aspartát | D | Asp | |
| Glutamát | E | Glu | |
| hisztidin | H | His | |
| Lizin | K | Lys | |
| Arginin | R | Arg | |
savak peptidkötés kialakításával reagálnak. Az új molekula, amely immár két aminosavmaradványból álló dimer, egyik vége továbbra is sav, másik vége pedig bázis, így nyilvánvaló, hogy a peptidkötés kialakításának folyamata egy másik aminosavval megismételhető. Ha sok aminosavat fűzünk egymás mellé, az eredmény egy természetes polimer – egy fehérje – lesz.