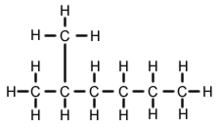
A 2-metil-hexán (C7H16, más néven izoheptán, etilizobutilmetán) a heptán egyik izomerje. Szerkezetileg egy hexánmolekula, amelynek második szénatomjához egy metilcsoport kapcsolódik. A legtöbb kereskedelmi forgalomban kapható heptánáruban szennyeződésként van jelen, de a reakciók szempontjából általában nem tekintik szennyeződésnek, mivel az n-heptánhoz (egyenes láncú heptán) képest nagyon hasonló fizikai és kémiai tulajdonságokkal rendelkezik.
 |
|
 |
|
 |
|
| Nevek | |
|---|---|
| IUPAC név
2-Metil-hexán
|
|
| Identifikátorok | |
|
|
|
3D modell (JSmol)
|
|
| 1696856 | |
| ChemSpider |
|
| ECHA InfoCard | 100.008.847 |
| EC szám |
|
|
PubChem CID
|
|
| RTECS szám |
|
| UNII |
|
| UN szám | 3295 |
|
CompTox Dashboard (EPA)
|
|
|
|
|
|
| Tulajdonságok | |
| C7H16 | |
| Moláris tömeg | 100.205 g-mol-1 |
| megjelenés | színtelen folyadék |
| szag | szagtalan |
| sűrűség | 0.679 g cm-3 |
| olvadáspont | -119,0 – -117,8 °C; -182,3 – -180,1 °F; 154,1 – 155,3 K |
| forráspont | 89,6 – 90,6 °C; 193,2 – 195,0 °F; 362.7-363,7 K |
| Gőznyomás | 15,7 kPa (37.7 °C) |
|
Henry-törvény
konstans (kH) |
19 nmol Pa-1 kg-1 |
| -86.24-10-6 cm3/mol | |
|
Törésmutató (nD)
|
1.384 |
| Thermokémia | |
|
Hőkapacitás (C)
|
222,92 J K-1 mol-1 |
|
Std moláris
entrópia (So298) |
323.34 J K-1 mol-1 |
|
Std
alakulási entalpia (ΔfH⦵298) |
-231,1–228.5 kJ mol-1 |
|
Std égési entalpia (ΔcH⦵298)
|
-4.8127–4.8103 MJ mol-1 |
| Veszélyek | |
| GHS piktogramok |     |
| GHS Jelszó | Veszély |
| H225, H304, H315, H336, H410 | |
| P210, P261, P273, P301+310, P331 | |
| NFPA 704 (tűzgyémánt) | |
| Flash point | -1 °C (30 °F; 272 K) |
| 280 °C (536 °F; 553 K) | |
| Robbanáshatár | 1-7% |
| Relátott vegyületek | |
|
Relátott alkánok
|
|
|
Hasonló vegyületek
|
|
|
Ahol másként nincs feltüntetve, az adatok standard állapotú anyagokra vonatkoznak (25 °C-on, 100 kPa nyomáson).
|
|
| |
|
| Infobox hivatkozások | |
A 2-metilhexán alkán lévén vízben nem oldódik, de számos szerves oldószerben, például alkoholban és éterben oldódik. A 2-metilhexánt azonban inkább magának az oldószernek tekintik. Ezért, annak ellenére, hogy számos kereskedelmi forgalomban kapható heptántermékben jelen van, nem tekinthető pusztító szennyeződésnek, mivel a heptánt általában oldószerként használják. Mindazonáltal tömör desztillációs és finomítási eljárásokkal a 2-metil-hexán elválasztható az n-heptántól.
Az izomercsoporton belül a több elágazással rendelkező izomerek hajlamosabbak könnyebben meggyulladni és teljesebben égni. Ezért a 2-metilhexánnak a heptánhoz képest alacsonyabb az öngyulladási hőmérséklete és a lobbanáspontja. Elméletileg a 2-metilhexán is kevésbé kormos lánggal ég, magasabb frekvenciájú sugárzást bocsát ki; mivel azonban a heptán és a 2-metilhexán csak egy szénatomban különbözik, az elágazások tekintetében, mindkettő élénksárga lánggal ég, amikor meggyújtják.
A n-heptánhoz képest a 2-metilhexán olvadási és forráspontja is alacsonyabb. A 2-metilhexánnak kisebb a folyadék sűrűsége, mint a heptánnak.
Az NFPA 704 skálán a 2-metilhexán a 0. reaktivitási szintű vegyi anyagként szerepel, különböző más alkánokkal együtt. Valójában a legtöbb alkán nem reaktív, kivéve szélsőséges körülmények között, például égés vagy erős napfény hatására. Oxigén és láng jelenlétében a 2-metil-hexán a heptánhoz hasonlóan többnyire teljesen vízzé és szén-dioxiddá ég. UV-fény hatására és oldószerekben lévő halogénekkel, általában brómmal keverve az 1,1,1-triklóretánban, szubsztitúciós reakció lép fel.