I 1953 udførte Harold Urey og Stanley Miller et fantastisk eksperiment, hvor de fremstillede “livets molekyler” ud fra en blanding af gasser, som de foreslog fandtes i en urjord. Eksperimenterne simulerede, hvad der ville ske, når lynnedslag leverede energi til kemiske reaktioner i atmosfæren, og de foreslog en hypotese om, hvordan livet kunne have udviklet sig på vores planet. Aminosyrer var de vitale molekyler, der blev dannet i dette eksperiment, og de understøttede denne hypotese om livets oprindelse.
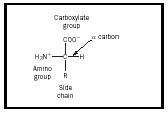
En aminosyre er et molekyle, der indeholder to funktionelle grupper , en amin- og en carboxylsyre , som vist i figur 1. I denne illustration er der yderligere en gruppe, der kaldes sidekæden, og som betegnes med et R. Den variation, der ses i naturligt forekommende aminosyrer, skyldes forskelle i denne sidekæde. De tyve naturligt forekommende molekyler er opført i tabel 1. I en vandig opløsning kan denne struktur ændres, således at en proton fra COOH overføres til NH 2, og der dannes en zwitterion. Denne struktur afhænger af opløsningens pH-værdi. De fleste fysiologiske systemer ligger inden for et sådant pH-område, så zwitterionformen af aminosyrer er den mest stabile form i det menneskelige legeme.
Aminosyrernes stereokemi er også et vigtigt begreb. Kulstofatomet markeret α i figur 1 er chiralt, så en aminosyre kan være en af to enantiomerer. Bemærk, at den struktur, der er vist i illustrationen, har amingruppen til højre og carboxylgruppen øverst. Denne konfiguration betegnes som L-formen, og alle naturligt forekommende aminosyrer har denne form.
Aminosyrer kategoriseres i tre grupper baseret på sidekædens art. Ni af aminosyrerne har sidekæder, der er upolære . Næsten 50 procent af de aminosyrer, der er til stede i proteiner, har upolære sidekæder. Den anden kategori af aminosyrer indeholder seks forskellige molekyler, der har polære sidekæder. Endelig har en gruppe på fem aminosyrer sidekæder, der ikke blot er polære, men også ladede.
Aminosyrernes vigtigste kemiske egenskab er, at de bindes sammen og danner proteiner. Fordi den funktionelle COOH-gruppe er en syre, og den funktionelle NH 2 -gruppe er en base, kan de to ender af aminosyrer let reagere med hinanden. Proteinsyntese er mere kompliceret end en simpel syre-base-neutralisering, men tænk på, hvad der sker, når to amino
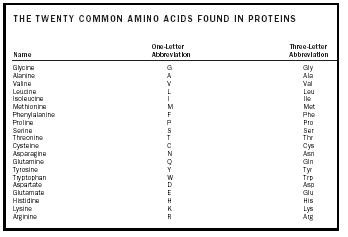
| De tyve almindelige aminosyrer, der findes i proteiner | ||||
| Navn | Forkortelse på én bogstav | Forkortelse på én bogstav | Forkortelse på tre bogstaver | Forkortelse på tre bogstaver |
| Glycin | G | Gly | ||
| Alanin | A | Ala | ||
| Valin | V | Val | ||
| Leu | L | Leu | ||
| Isoleucin | I | Ile | ||
| Methionin | M | Met | ||
| Phenylalanin | F | F | Phe | |
| Prolin | P | Pro | ||
| Serin | S | Ser | ||
| Tretonin | T | Thr | ||
| Cystein | C | Cys | ||
| Asparagin | N | Asn | ||
| Glutamin | Q | Gln | ||
| Tyrosin | Y | Tyr | ||
| Tryptofan | W | W | Trp | |
| Aspartat | D | Asp | ||
| Glutamat | E | Glu | ||
| Histidin | H | H | His | |
| Lysin | K | Lys | ||
| Arginin | R | Arg | ||
syrer reagerer for at danne en peptidbinding. Det nye molekyle, der nu er en dimer med to aminosyrerester, har stadig en ende, der er en syre, og en anden ende, der er en base, så det er tydeligt, at processen med at danne en peptidbinding med en anden aminosyre kan gentages. Hvis mange aminosyrer sættes på række, er resultatet en naturlig polymer – et protein.