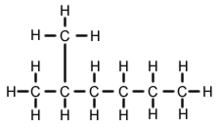
2-Methylhexan (C7H16, også kendt som isoheptan, ethylisobutylmethan) er en isomer af heptan. Det er strukturelt set et hexanmolekyle med en methylgruppe knyttet til dets andet kulstofatom. Det findes i de fleste kommercielt tilgængelige heptanvarer som en urenhed, men betragtes normalt ikke som en urenhed i forbindelse med reaktioner, da det har meget ensartede fysiske og kemiske egenskaber i forhold til n-heptan (straight-chained heptan).
 |
||
 |
||
 |
||
| Navne | ||
|---|---|---|
| IUPAC-navn
2-Methylhexan
|
||
| Identifikatorer | ||
|
||
|
3D-model (JSmol)
|
||
| 1696856 | ||
| ChemSpider |
|
|
| ECHA InfoCard | 100.008.847 |
|
| EC-nummer |
|
|
|
PubChem CID
|
||
| RTECS nummer |
|
|
| UNII |
|
|
| UN-nummer | 3295 | |
|
CompTox Dashboard (EPA)
|
||
|
||
|
||
| Egenskaber | ||
| C7H16 | ||
| Molarmasse | 100.205 g-mol-1 | |
| Udseende | Farveløs væske | |
| Odor | Odorfri | |
| Densitet | 0.679 g cm-3 | |
| Smeltepunkt | -119,0 til -117,8 °C; -182,3 til -180,1 °F; 154,1 til 155,3 K | |
| Skogningspunkt | 89,6 til 90,6 °C; 193,2 til 195,0 °F; 362.7 til 363,7 K | |
| Damptryk | 15,7 kPa (ved 37.7 °C) | |
|
Henrys lov
konstant (kH) |
19 nmol Pa-1 kg-1 | |
| -86.24-10-6 cm3/mol | ||
|
Brydningsindeks (nD)
|
1.384 | |
| Thermokemi | ||
|
Varmekapacitet (C)
|
222,92 J K-1 mol-1 | |
|
Std molar
entropi (So298) |
323.34 J K-1 mol-1 | |
|
Std enthalpi for
dannelse (ΔfH⦵298) |
-231.1–228.5 kJ mol-1 | |
|
Std enthalpi for
forbrænding (ΔcH⦵298) |
-4.8127–4.8103 MJ mol-1 | |
| Farer | ||
| GHS-piktogrammer |     |
|
| GHS Signalord | Farlig | |
| H225, H304, H315, H336, H410 | ||
| P210, P261, P273, P301+310, P331 | ||
| NFPA 704 (branddiamant) | ||
| Flashpunkt | -1 °C (30 °F; 272 K) | |
| 280 °C (536 °F; 553 K) | ||
| Eksplosionsgrænser | 1-7% | |
| Relaterede forbindelser | ||
|
Relaterede alkaner
|
||
|
Berørende forbindelser
|
||
|
Medmindre andet er angivet, data er angivet for materialer i deres standardtilstand (ved 25 °C , 100 kPa).
|
||
| |
||
| Infobox referencer | ||
Som en alkan er 2-methylhexan uopløseligt i vand, men er opløseligt i mange organiske opløsningsmidler, såsom alkoholer og ether. 2-methylhexan betragtes dog mere almindeligt som et opløsningsmiddel i sig selv. Selv om det er til stede i mange kommercielt tilgængelige heptanprodukter, betragtes det derfor ikke som en destruktiv urenhed, da heptan normalt anvendes som et opløsningsmiddel. Ikke desto mindre er det ved korte destillations- og raffineringsprocesser muligt at adskille 2-methylhexan fra n-heptan.
I en gruppe af isomerer har isomerer med flere forgreninger tendens til at antænde lettere og forbrænde mere fuldstændigt. Derfor har 2-methylhexan en lavere selvantændelsestemperatur og et lavere flammepunkt sammenlignet med heptan. Teoretisk set brænder 2-methylhexan også med en mindre sodet flamme og udsender højere frekvensstråling; men da heptan og 2-methylhexan kun adskiller sig med ét kulstofatom med hensyn til forgreninger, brænder de begge med en lysende gul flamme, når de antændes.
Sammenlignet med n-heptan har 2-methylhexan også et lavere smelte- og kogepunkt. Der findes en lavere væsketæthed i 2-methylhexan end i heptan.
På NFPA 704-skalaen er 2-methylhexan opført som et kemikalie på reaktivitetsniveau-0 sammen med forskellige andre alkaner. Faktisk er de fleste alkaner ikke reaktive, undtagen under ekstreme forhold, f.eks. ved forbrænding eller stærkt sollys. Ved tilstedeværelse af ilt og flammer forbrændes 2-methylhexan, ligesom heptan, næsten fuldstændigt til vand og kuldioxid. Ved UV-lys og blandet med halogener i opløsningsmidler, sædvanligvis brom i 1,1,1,1-trichlorethan, sker der en substitutionsreaktion.