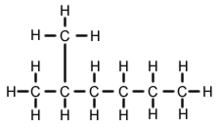
El 2-metilhexano (C7H16, también conocido como isoheptano, etilisobutilmetano) es un isómero del heptano. Es estructuralmente una molécula de hexano con un grupo metilo unido a su segundo átomo de carbono. Existe en la mayoría de los productos de heptano disponibles en el mercado como impureza, pero normalmente no se considera como impureza en términos de reacciones, ya que tiene propiedades físicas y químicas muy similares en comparación con el n-heptano (heptano de cadena recta).
 |
|
 |
|
 |
|
| Nombres | |
|---|---|
| Nombre IUPAC
2-Metilhexano
|
|
| Identificadores | |
|
|
|
Modelo 3D (JSmol)
|
|
| 1696856 | |
| ChemSpider |
|
| ECHA InfoCard | 100.008.847 |
| Número CE |
|
|
PubChem CID
|
|
| RTECS number |
|
| UNII |
|
| Número UN | 3295 |
|
CompTox Dashboard (EPA)
|
|
|
|
|
|
| Propiedades | |
| C7H16 | |
| Masa polar | 100.205 g-mol-1 |
| Aspecto | Líquido incoloro |
| Olor | Sin olor |
| Densidad | 0.679 g cm-3 |
| Punto de fusión | -119,0 a -117,8 °C; -182,3 a -180,1 °F; 154,1 a 155,3 K |
| Punto de ebullición | 89,6 a 90,6 °C; 193,2 a 195,0 °F; 362.7 a 363,7 K |
| Presión de vapor | 15,7 kPa (a 37.7 °C) |
|
Ley de Henry
constante (kH) |
19 nmol Pa-1 kg-1 |
| -86.24-10-6 cm3/mol | |
|
Índice de refracción (nD)
|
1.384 |
| Termoquímica | |
|
Capacidad calorífica (C)
|
222,92 J K-1 mol-1 |
|
Entropía molar estándar (So298)
|
323.34 J K-1 mol-1 |
|
Entalpía estándar de
formación (ΔfH⦵298) |
-231,1–228.5 kJ mol-1 |
|
Entalpía estándar de
combustión (ΔcH⦵298) |
-4,8127–4.8103 MJ mol-1 |
| Peligros | |
| Pictogramas GHS |     |
| GHS Palabra de señalización | Peligro |
| H225, H304, H315, H336, H410 | |
| P210, P261, P273, P301+310, P331 | |
| NFPA 704 (diamante de fuego) | |
| Punto de inflamación | -1 °C (30 °F; 272 K) |
| 280 °C (536 °F; 553 K) | |
| Límites de explosividad | 1-7% |
| Compuestos relacionados | |
|
Alcanos relacionados alcanos
|
|
|
Compuestos relacionados
|
|
|
Salvo indicación en contrario, los datos se dan para materiales en su estado estándar (a 25 °C , 100 kPa).
|
|
| |
|
| Referencias Infobox | |
Al ser un alcano, el 2-metilhexano es insoluble en agua, pero es soluble en muchos disolventes orgánicos, como alcoholes y éter. Sin embargo, el 2-metilhexano se considera más comúnmente como un disolvente en sí mismo. Por lo tanto, aunque esté presente en muchos productos de heptano disponibles en el mercado, no se considera una impureza destructiva, ya que el heptano se suele utilizar como disolvente. No obstante, mediante procesos concisos de destilación y refinado, es posible separar el 2-metilhexano del n-heptano.
Dentro de un grupo de isómeros, los que tienen más ramificaciones tienden a inflamarse más fácilmente y a combustionar más completamente. Por lo tanto, el 2-metilhexano tiene una temperatura de autoignición y un punto de inflamación más bajos en comparación con el heptano. Teóricamente, el 2-metilhexano también arde con una llama menos tiznada, emitiendo una radiación de mayor frecuencia; sin embargo, como el heptano y el 2-metilhexano se diferencian sólo por un átomo de carbono, en términos de ramificación, ambos arden con una llama amarilla brillante cuando se encienden.
En comparación con el n-heptano, el 2-metilhexano también tiene puntos de fusión y ebullición más bajos. El 2-metilhexano tiene una densidad de líquido más baja que el heptano.
En la escala NFPA 704, el 2-metilhexano está catalogado como un producto químico de nivel de reactividad 0, junto con varios otros alcanos. De hecho, la mayoría de los alcanos no son reactivos salvo en condiciones extremas, como la combustión o la luz solar intensa. En presencia de oxígeno y de una llama, el 2-metilhexano, al igual que el heptano, arde casi por completo en agua y dióxido de carbono. Con luz ultravioleta y mezclado con halógenos en disolventes, normalmente bromo en el 1,1,1-tricloroetano, se produce una reacción de sustitución.