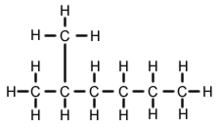
2-Methylhexan (C7H16, auch bekannt als Isoheptan, Ethylisobutylmethan) ist ein Isomer von Heptan. Strukturell handelt es sich um ein Hexanmolekül mit einer Methylgruppe am zweiten Kohlenstoffatom. Es kommt in den meisten handelsüblichen Heptanprodukten als Verunreinigung vor, wird aber in der Regel nicht als Verunreinigung in Bezug auf Reaktionen betrachtet, da es im Vergleich zu n-Heptan (geradkettiges Heptan) sehr ähnliche physikalische und chemische Eigenschaften aufweist.
 |
|
 |
|
 |
|
| Namen | |
|---|---|
| IUPAC-Name
2-Methylhexan
|
|
| Bezeichner | |
|
|
|
3D-Modell (JSmol)
|
|
| 1696856 | |
| ChemSpider |
|
| ECHA InfoCard | 100.008.847 |
| EC-Nummer |
|
|
PubChem CID
|
|
| RTECS Nummer |
|
| UNII |
|
| UN-Nummer | 3295 |
|
CompTox Dashboard (EPA)
|
|
|
|
|
|
| Eigenschaften | |
| C7H16 | |
| Molmasse | 100.205 g-mol-1 |
| Aussehen | Farblose Flüssigkeit |
| Geruch | Geruchlos |
| Dichte | 0.679 g cm-3 |
| Schmelzpunkt | -119,0 bis -117,8 °C; -182,3 bis -180,1 °F; 154,1 bis 155,3 K |
| Siedepunkt | 89,6 bis 90,6 °C; 193,2 bis 195,0 °F; 362.7 bis 363,7 K |
| Dampfdruck | 15,7 kPa (bei 37.7 °C) |
|
Henry’s law
constant (kH) |
19 nmol Pa-1 kg-1 |
| -86.24-10-6 cm3/mol | |
|
Brechungsindex (nD)
|
1.384 |
| Thermochemie | |
|
Wärmekapazität (C)
|
222.92 J K-1 mol-1 |
|
Std. molare
Entropie (So298) |
323.34 J K-1 mol-1 |
|
Std. Bildungsenthalpie (ΔfH⦵298)
|
-231,1–228.5 kJ mol-1 |
|
Std. Verbrennungsenthalpie (ΔcH⦵298)
|
-4,8127–4.8103 MJ mol-1 |
| Gefahren | |
| GHS-Piktogramme |     |
| GHS Signalwort | Gefahr |
| H225, H304, H315, H336, H410 | |
| P210, P261, P273, P301+310, P331 | |
| NFPA 704 (Feuerdiamant) | |
| Flammpunkt | -1 °C (30 °F; 272 K) |
| 280 °C (536 °F; 553 K) | |
| Explosionsgrenzen | 1-7% |
| Verwandte Verbindungen | |
|
Verwandte Alkane
|
|
|
Verwandte Verbindungen
|
|
|
Soweit nicht anders angegeben, sind die Daten für Materialien in ihrem Standardzustand (bei 25 °C, 100 kPa) angegeben.
|
|
| |
|
| Infobox Referenzen | |
Als Alkan ist 2-Methylhexan unlöslich in Wasser, aber löslich in vielen organischen Lösungsmitteln wie Alkoholen und Ether. 2-Methylhexan wird jedoch eher als Lösungsmittel selbst betrachtet. Obwohl es in vielen handelsüblichen Heptanprodukten enthalten ist, wird es daher nicht als schädliche Verunreinigung angesehen, da Heptan normalerweise als Lösungsmittel verwendet wird. Dennoch ist es möglich, durch präzise Destillations- und Raffinationsverfahren 2-Methylhexan von n-Heptan zu trennen.
Innerhalb einer Gruppe von Isomeren neigen diejenigen mit mehr Verzweigungen dazu, sich leichter zu entzünden und vollständiger zu verbrennen. Daher hat 2-Methylhexan im Vergleich zu Heptan eine niedrigere Selbstentzündungstemperatur und einen niedrigeren Flammpunkt. Theoretisch verbrennt 2-Methylhexan auch mit einer weniger rußenden Flamme und sendet eine höherfrequente Strahlung aus; da sich Heptan und 2-Methylhexan jedoch in Bezug auf die Verzweigung nur durch ein Kohlenstoffatom unterscheiden, brennen beide beim Entzünden mit einer hellgelben Flamme.
Im Vergleich zu n-Heptan hat 2-Methylhexan auch niedrigere Schmelz- und Siedepunkte. Die Flüssigkeitsdichte von 2-Methylhexan ist geringer als die von Heptan.
In der NFPA 704-Skala ist 2-Methylhexan zusammen mit verschiedenen anderen Alkanen als Chemikalie der Reaktivitätsstufe 0 aufgeführt. Tatsächlich sind die meisten Alkane nicht reaktiv, außer unter extremen Bedingungen, wie Verbrennung oder starker Sonneneinstrahlung. In Gegenwart von Sauerstoff und einer Flamme verbrennt 2-Methylhexan, wie auch Heptan, fast vollständig zu Wasser und Kohlendioxid. Bei UV-Licht und im Gemisch mit Halogenen in Lösungsmitteln, meist Brom in 1,1,1-Trichlorethan, kommt es zu einer Substitutionsreaktion.