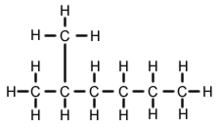
2-methylhexan (C7H16, známý také jako izoheptan, ethylisobutylmethan) je izomer heptanu. Strukturně se jedná o molekulu hexanu s methylovou skupinou připojenou k druhému atomu uhlíku. Vyskytuje se ve většině komerčně dostupného zboží s heptanem jako nečistota, ale obvykle není považován za nečistotu z hlediska reakcí, protože má velmi podobné fyzikální a chemické vlastnosti ve srovnání s n-heptanem (heptan s přímým řetězcem).
 |
|
 |
|
 |
|
| Název | |
|---|---|
| Název IUPAC
2-Methylhexan
|
|
| Identifikátory | |
|
|
|
3D model (JSmol)
|
|
| 1696856 | |
| ChemSpider |
|
| ECHA InfoCard | 100.008.847 |
| Číslo ES |
|
|
PubChem CID
|
|
| RTECS číslo |
|
| UNII |
|
| UN číslo | 3295 |
|
CompTox Dashboard (EPA)
|
|
|
|
|
|
| Vlastnosti | |
| C7H16 | |
| Molární hmotnost | 100.205 g-mol-1 |
| Vzhled | Bezbarvá kapalina |
| Odér | Bez zápachu |
| Hustota | 0.679 g cm-3 |
| Teplota tání | -119,0 až -117,8 °C; -182,3 až -180,1 °F; 154,1 až 155,3 K |
| Teplota varu | 89,6 až 90,6 °C; 193,2 až 195,0 °F; 362.7 až 363,7 K |
| Tlak par | 15,7 kPa (při 37.7 °C) |
|
Henryho zákon
konstanta (kH) |
19 nmol Pa-1 kg-1 |
| -86.24-10-6 cm3/mol | |
|
Index lomu (nD)
|
1.384 |
| Termochemie | |
|
Tepelná kapacita (C)
|
222,92 J K-1 mol-1 |
|
Std molární
entropie (So298) |
323.34 J K-1 mol-1 |
|
Std entalpie
tvorby (ΔfH⦵298) |
-231,1–228.5 kJ mol-1 |
|
Std entalpie
hoření (ΔcH⦵298) |
-4,8127–4.8103 MJ mol-1 |
| Nebezpečnost | |
| Piktogramy GHS |     |
| Signální slovo GHS | Nebezpečí |
| H225, H304, H315, H336, H410 | |
| P210, P261, P273, P301+310, P331 | |
| NFPA 704 (požární diamant) | |
| Teplota vzplanutí | -1 °C (30 °F; 272 K) |
| 280 °C (536 °F; 553 K) | |
| Mezní hodnoty výbušnosti | 1-7% |
| Související sloučeniny | |
|
Související alkany
|
|
|
Příbuzné sloučeniny
|
|
|
Pokud není uvedeno jinak, jsou údaje uvedeny pro materiály ve standardním stavu (při 25 °C , 100 kPa).
|
|
| |
|
| Infobox reference | |
Jako alkan je 2-methylhexan nerozpustný ve vodě, ale je rozpustný v mnoha organických rozpouštědlech, jako jsou alkoholy a éter. Samotný 2-methylhexan je však častěji považován za rozpouštědlo. Proto, i když je přítomen v mnoha komerčně dostupných heptanových produktech, není považován za destruktivní nečistotu, protože heptan se obvykle používá jako rozpouštědlo. Nicméně stručnými postupy destilace a rafinace je možné oddělit 2-methylhexan od n-heptanu.
Ve skupině izomerů mají ty s více větvemi tendenci se snadněji vznítit a úplněji shořet. Proto má 2-methylhexan ve srovnání s heptanem nižší teplotu samovznícení a bod vzplanutí. Teoreticky 2-methylhexan také hoří méně sazí a vyzařuje záření o vyšší frekvenci; protože se však heptan a 2-methylhexan z hlediska větvení liší pouze jedním atomem uhlíku, hoří oba při zapálení jasně žlutým plamenem.
Ve srovnání s n-heptanem má 2-methylhexan také nižší teplotu tání a varu. U 2-methylhexanu je nižší hustota kapaliny než u heptanu.
Na stupnici NFPA 704 je 2-methylhexan uveden jako chemická látka s reaktivitou 0. stupně spolu s různými dalšími alkany. Ve skutečnosti je většina alkanů nereaktivní s výjimkou extrémních podmínek, jako je hoření nebo silné sluneční záření. Za přítomnosti kyslíku a plamene 2-methylhexan, stejně jako heptan, většinou zcela shoří na vodu a oxid uhličitý. Při působení UV záření a ve směsi s halogeny v rozpouštědlech, obvykle s bromem v 1,1,1-trichlorethanu, dochází k substituční reakci
.