US Pharm. 2016;41(6):35-39.
ABSTRACT: La hepatitis autoinmune (AIH) es una enfermedad crónica de causa desconocida con inflamación persistente del hígado y el potencial de necrosis y progresión a cirrosis asociada. La HIA puede afectar a cualquier etnia, y parece ocurrir en las mujeres con más frecuencia que en los hombres. No existe un desencadenante específico que se asocie a la enfermedad. El tratamiento estándar de la HIA es un corticosteroide (prednisona) solo o en combinación con azatioprina. También existen terapias alternativas para los pacientes que pueden tener una respuesta subóptima a las opciones de tratamiento estándar. Debe iniciarse un agente inmunosupresor lo antes posible tras el diagnóstico para evitar una mayor progresión de la enfermedad. Los pacientes que no responden al tratamiento estándar o a las terapias alternativas pueden desarrollar una enfermedad hepática terminal que requiera un trasplante de hígado.
La hepatitis autoinmune (AIH) fue descrita por primera vez en 1950 por el médico sueco Jan Waldenström y se define como la inflamación del hígado de causa desconocida que no se resuelve.1,2 Los desencadenantes ambientales, el fallo del sistema inmunitario y la genética pueden inducir un ataque inmunitario mediado por células T contra los antígenos hepáticos, lo que conduce al desarrollo de la HIA.2 Aunque la HIA se ha observado en todas las edades y grupos étnicos, parece afectar con más frecuencia a las mujeres que a los hombres. La HIA debe considerarse en el diagnóstico diferencial de un paciente que presenta globulinas séricas anormales, uno o más autoanticuerpos característicos y elevaciones de las aminotransferasas, siempre que no puedan excluirse otras causas de hepatitis.2
Antecedentes
Hay dos tipos conocidos de HIA: el tipo 1 (HIA-1), positivo para anticuerpos antinucleares (ANA) y/o anticuerpos anti-músculo liso (ASMA), y el tipo 2 (HIA-2), que es positivo para anticuerpos microsómicos anti-hígado/riñón tipo 1 (anti-LKM-1) o para anticuerpos anti-citosol tipo 1 (anti-LC-1).1 Los CDC no informan de datos epidemiológicos sobre la prevalencia de la HIA en los Estados Unidos. Sin embargo, para prevenir y controlar la infección por el virus de la hepatitis C (VHC) y las enfermedades crónicas relacionadas con el VHC, los CDC recomiendan realizar una única prueba del VHC a las personas nacidas entre 1945 y 1965.3 La HIA puede coexistir con otras enfermedades hepáticas y puede ser desencadenada por determinadas infecciones víricas o agentes farmacológicos.4
El tratamiento estándar actual de la HIA es el uso de prednisona sola o en combinación con azatioprina para mejorar los síntomas y las manifestaciones de la inflamación hepática y reducir la progresión de la fibrosis hepática.5 Últimamente, se ha debatido mucho sobre el uso de terapias alternativas en la población de pacientes con HIA, no sólo por los efectos adversos sistémicos del uso de la prednisona, sino también por el fracaso del tratamiento, la respuesta incompleta y las toxicidades farmacológicas experimentadas por los pacientes. Estos tratamientos alternativos incluyen el micofenolato mofetilo (MMF), el tacrolimus, la ciclosporina, la budesonida y el alopurinol.5 Se han estudiado el rituximab, el infliximab y la ciclofosfamida, pero existen pocos datos que apoyen su uso en la HIA.5 Se analizará la bibliografía reciente sobre la importancia clínica de estos agentes alternativos.
Presentación clínica
La HIA se describió originalmente en mujeres jóvenes y, aunque las mujeres siguen constituyendo la mayoría de los casos, ahora se sabe que la enfermedad puede aparecer a cualquier edad, en ambos sexos y en todos los grupos étnicos.1-5 Sin embargo, se ha informado de un patrón de edad bimodal general en el momento de la presentación, un pico durante la infancia y la adolescencia y otro en la mediana edad, entre la cuarta y la sexta décadas de la vida. Sin embargo, estudios más recientes han demostrado que un número cada vez mayor de pacientes con HIA se diagnostican también a edades más avanzadas.6 La presentación clínica de la HIA varía desde la ausencia de síntomas hasta la hepatitis aguda grave e incluso el fallo hepático fulminante. Aproximadamente entre el 34% y el 45% de los pacientes son asintomáticos, y alrededor del 70% se vuelven sintomáticos y, por tanto, deben ser controlados.2 Además, entre el 25% y el 34% de los pacientes presentan anomalías asintomáticas en las pruebas hepáticas. Además, el 40% de los pacientes pueden presentar un inicio agudo, en el que los niveles de inmunoglobulina G (IgG) son normales y no se detectan ANA; sin embargo, la presentación de insuficiencia hepática fulminante grave es rara y parece ser más común en la HIA-2.7
La presentación clínica común de la HIA se caracteriza por uno o más de los siguientes síntomas inespecíficos de gravedad variable: fatiga, malestar general, dolor leve en el cuadrante superior derecho, letargo, malestar general, anorexia, pérdida de peso, náuseas, prurito, ictericia y artralgia que afecta a las articulaciones pequeñas; también es frecuente la amenorrea, mientras que la erupción cutánea maculopapular y la fiebre inexplicable son características poco frecuentes.6 Estos síntomas son inespecíficos y, en última instancia, contribuyen a retrasar el diagnóstico. Las manifestaciones clínicas también pueden variar en función de la etnia.
Ocasionalmente, la HIA puede presentarse en algunas condiciones especiales, como durante el embarazo o en el período posparto temprano, después de la administración de ciertos fármacos, tras una infección viral, después de un trasplante de hígado y, a veces, en presencia de otras enfermedades autoinmunes o inmunomediadas en pacientes o en sus familiares de primer grado.6
Diagnóstico y manejo
Diagnóstico: Se utiliza un sistema de puntuación, desarrollado por el Grupo Internacional de Hepatitis Autoinmune, para diagnosticar a los pacientes con HIA. El paciente recibe un diagnóstico «definitivo» o «probable» basado en ciertos criterios clínicos, de laboratorio e histológicos. Dado que se trata de un trastorno autoinmune, la presencia y el nivel de expresión de autoanticuerpos mediante inmunofluorescencia indirecta, la concentración de IgG en suero, las características histológicas compatibles o típicas y la ausencia de marcadores virales se utilizan para diagnosticar a los pacientes.2 También se evalúan los autoanticuerpos convencionales de la HIA, como ANA, ASMA, anti-LKM-1 y anti-LC-1.2 Para diagnosticar la HIA también se utilizan marcadores de laboratorio clave para evaluar la función hepática, como la alanina (ALT) o la aspartato (AST) aminotransferasa sérica, la fosfatasa alcalina (AP), la albúmina, la globulina total o gamma, la IgG y la bilirrubina (conjugada y no conjugada).2 El diagnóstico definitivo o probable se determina en función de la magnitud de estos criterios clínicos, de laboratorio e histológicos, así como de factores específicos del paciente, como los antecedentes de exposición al alcohol, los antecedentes de medicación y las infecciones que podrían causar lesiones hepáticas.2
Manejo: Se considera que los pacientes que presentan niveles séricos de AST o ALT >10 veces el límite superior normal (LNU); al menos cinco veces el LNU junto con un nivel de gammaglobulina sérica al menos dos veces el LNU y/o características histológicas de necrosis en puente o necrosis multilobular; y síntomas incapacitantes tienen una enfermedad significativa y son aptos para iniciar un tratamiento inmunosupresor.2,8 En los pacientes con enfermedad leve (es decir, En los pacientes con enfermedad leve (es decir, aquellos que no cumplen los criterios de tratamiento), debe revisarse el riesgo frente al beneficio del tratamiento y remitir al paciente a un médico.2,8 Los individuos asintomáticos con actividad mínima o nula de la enfermedad o con cirrosis inactiva deben seguir siendo vigilados estrechamente durante 3 a 6 meses para detectar signos de progresión de la enfermedad, ya que hay pocos datos que apoyen el uso del tratamiento en estos pacientes en este momento.2,8
Terapia estándar
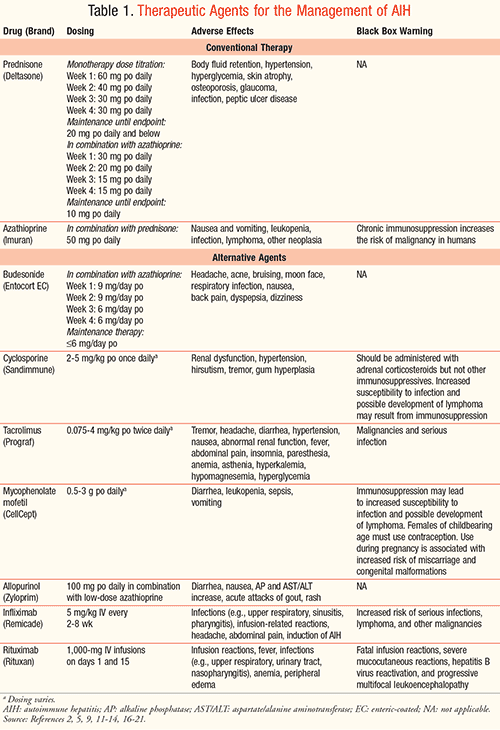
La terapia estándar para la HIA ha sido la prednisona administrada sola o en combinación con azatioprina. Los detalles relativos a las terapias se proporcionan en la TABLA 1.2 En los pacientes se ha utilizado una terapia de inducción de dosis de prednisona de 30 a 60 mg/día o hasta 1 mg/kg/día como monoterapia y una dosis de 30 mg/día combinada con azatioprina 50 mg (1-2 mg/kg/día). La azatioprina no puede inducir la remisión cuando se utiliza sola, pero permite el mantenimiento de la remisión en asociación con una dosis reducida de esteroides.1 La azatioprina se introduce en estos pacientes más tarde, para poder evaluar primero la respuesta del tratamiento a la monoterapia con esteroides. Debe tenerse especial precaución con los pacientes con condiciones comórbidas que pueden aparecer como resultado del uso de prednisona sistémica (es decir, compresión vertebral, psicosis, diabetes frágil, hipertensión no controlada). Un corticosteroide alternativo, la budesonida, con menos efectos adversos específicos de los esteroides, puede utilizarse en combinación con la azatioprina.5 Antes de iniciar la azatioprina, debe realizarse un hemograma previo al tratamiento para asegurarse de que el paciente no presenta una citopenia grave previa al tratamiento (inferior a 2,5 × 109/L) o recuentos de plaquetas inferiores a 50 × 109/L.2 Los pacientes también deben ser examinados para asegurarse de que no existe una deficiencia completa conocida de la actividad de la tiopurina metiltransferasa que contraindique el uso de azatioprina.2 Tras la remisión, la prednisona debe reducirse gradualmente durante un período de 6 semanas, midiendo los valores de laboratorio cada 3 semanas durante la terapia y durante 3 meses después de retirarla.2
Agentes alternativos
Existen varios agentes alternativos disponibles en el tratamiento de la HIA (TABLA 1), entre los que se encuentran la budesonida, la ciclosporina, el tacrolimus, el MMF, el tratamiento complementario alopurinol, el infliximab, el rituximab y el ácido ursodesoxicólico.9-18 La budesonida, un esteroide sintético, puede utilizarse como alternativa a la prednisona. En comparación con la prednisona, tiene un perfil de efectos adversos relativamente seguro, siendo los más frecuentes la cefalea y la infección respiratoria.9 Se han observado cambios cosméticos como cara de luna, acné e hirsutismo.8 La budesonida se metaboliza principalmente a través del metabolismo de primer paso hepático, por lo que los pacientes no experimentan tantos efectos adversos sistémicos como los observados con el uso de la prednisona. Sin embargo, este metabolismo limita su uso en pacientes cirróticos debido al riesgo de hipertensión portal, que conduce a un mal metabolismo y al riesgo de toxicidad sistémica.
En un amplio estudio prospectivo multicéntrico de fase II, 207 pacientes fueron asignados al azar a budesonida 3 mg po tid o a prednisona 40 mg/día (con un curso de reducción gradual) más azatioprina 1 a 2 mg/kg/día.10 La tasa de respuesta completa fue significativamente mayor en el grupo de la budesonida en comparación con el grupo de la prednisona (84% frente al 18%; P <0,0001), la remisión bioquímica también fue superior en el caso de la budesonida (60% frente al 39%; P = 0,0012), y los efectos adversos a los 12 meses fueron significativamente menores en el grupo de la budesonida.10 Estos resultados muestran que la budesonida es una alternativa relativamente segura y eficaz al tratamiento estándar.
La ciclosporina, un inhibidor de la calcineurina y agente inmunosupresor, actúa sobre la señalización dependiente del calcio e inhibe la función de las células T a través del gen de la interleucina 2 (IL2). Dos estudios de casos en los que se utilizó ciclosporina mostraron tasas de respuesta del 79% y el 80%.10 Las dosis oscilaron entre 2 y 5 mg/kg, pero el pequeño tamaño de la muestra justifica la realización de más ensayos clínicos para determinar el lugar de la ciclosporina en la terapia como otra opción para aquellos que no logran la remisión con la terapia estándar. Los efectos adversos notificados incluyen hiperpotasemia, hipertensión, insuficiencia renal, hiperlipidemia, hiperplasia gingival, hirsutismo, infección y malignidad.11 Existen muchas interacciones farmacológicas importantes con la ciclosporina, ya que se metaboliza ampliamente por el CYP3A4 y es un sustrato de la glicoproteína P (Pgp). Para evitar cualquier toxicidad potencial, es importante revisar el historial de medicación del paciente antes de iniciar el tratamiento.
Tacrolimus, un agente inmunosupresor macrólido, actúa inhibiendo la activación de las células T. Aunque actualmente no existen ensayos controlados para su uso en pacientes con HIA, los resultados de los estudios piloto son alentadores y se justifica la realización de más estudios en ensayos clínicos para recomendar el tacrolimus como agente seguro y eficaz.10 Los efectos adversos observados con el tacrolimus son infección, temblores, hipertensión, función renal anormal, edema periférico, alopecia, estreñimiento, diarrea y náuseas y vómitos.12 El tacrolimus se metaboliza por la vía del CYP3A4, y sería necesario ajustar la dosis en pacientes que toman medicamentos concomitantes que son fuertes inhibidores e inductores del CYP3A4.
El FMM es conocido por su uso como agente inmunosupresor en el trasplante de órganos. Es un profármaco que se convierte en el hígado en el metabolito activo ácido micofenólico. El escaso número de ensayos clínicos que incluyen MMF en pacientes con HIA limita su uso en una población de pacientes más amplia.10,13 Se llevó a cabo un estudio retrospectivo y observacional en el Reino Unido en 20 pacientes diagnosticados de HIA desde enero de 2000 hasta mayo de 2010.13 Los pacientes que no respondían al tratamiento con esteroides o azatioprina se iniciaron con MMF 500 mg dos veces al día durante 2 semanas, y si la dosis era tolerada, se aumentaba a 1 g dos veces al día. Tras un periodo de seguimiento de 47 meses, 14 de los 20 pacientes seguían tomando MMF con remisión bioquímica, incluidos 4 de los 5 pacientes con cirrosis. Es necesario educar a los pacientes sobre los riesgos potenciales de tomar MMF, incluyendo el riesgo de infección, el desarrollo de linfoma y la pérdida de embarazos y defectos congénitos. Las mujeres en edad reproductiva que tomen MMF deben utilizar dos métodos anticonceptivos durante 4 semanas antes de iniciar la terapia, durante todo el curso de la misma y durante 6 semanas después de suspenderla.14
El alopurinol, conocido sobre todo por su uso en el tratamiento de la gota, es otro agente que ha demostrado su eficacia en una población específica de pacientes con HIA en ensayos clínicos. Aproximadamente el 10% de los pacientes con HIA no responden o son intolerantes al tratamiento con tiopurinas, lo que puede conducir a la formación del metabolito hepatotóxico de la tiopurina (6-metil-mercaptopurina) en lugar del metabolito activo 6-nucleótidos de tioguanina (6-TGNs).15 El uso concomitante de alopurinol y dosis bajas de azatioprina puede prevenir la formación del metabolito tóxico. En un ensayo clínico realizado en el Centro Médico de la Universidad VU de Ámsterdam entre febrero de 2011 y octubre de 2012 se inició esta combinación en ocho pacientes con HIA.15 Los pacientes fueron cambiados a la terapia combinada de alopurinol 100 mg y dosis bajas de tiopurina (azatioprina 75-150 mg) porque mostraban una falta de respuesta o una pérdida de respuesta con las dosis convencionales de tiopurina después de que los valores de laboratorio mostraran un aumento de los niveles de ALT.15 El beneficio clínico mostró una reducción sostenida y una normalización de los niveles de ALT en siete de los ocho pacientes, y no se observaron efectos adversos importantes relacionados con el fármaco. Sin embargo, los pacientes que empiezan a tomar alopurinol deben ser informados de los posibles efectos secundarios del fármaco y ser controlados de forma rutinaria mientras reciben el tratamiento. Los efectos más comunes son diarrea, náuseas, aumento de las pruebas de enzimas hepáticas (AP y AST/ALT), ataques agudos de gota y erupciones cutáneas.16
Tres agentes adicionales han demostrado ser prometedores en el manejo de pacientes con HIA difícil de tratar. Se ha estudiado el infliximab, un anticuerpo monoclonal contra el factor de necrosis antitumoral alfa. Hay que tener cuidado con su uso porque se asocia a la inducción de HIA grave de novo en algunos pacientes tratados por otras enfermedades.1 El rituximab, un anticuerpo monoclonal anti-células B contra la proteína CD20, también se ha utilizado en pacientes con HIA. Tanto el infliximab como el rituximab ponen a los pacientes en riesgo de sufrir complicaciones graves, por lo que los pacientes deben ser vigilados cuidadosamente mientras reciben el tratamiento (TABLA 1). También se ha estudiado el ácido ursodesoxicólico, pero aún no se ha demostrado su eficacia en la HIA.1 Estos tres agentes deben estudiarse más en la población con HIA para determinar su lugar en el tratamiento.
El tratamiento inmunosupresor se continúa en los pacientes con HIA hasta que se alcanza un punto final del tratamiento, como la remisión, el fracaso del tratamiento, la respuesta incompleta o la toxicidad del fármaco. Los pacientes son objeto de un seguimiento cuidadoso y rutinario para asegurarse de que el tratamiento está funcionando y para intervenir cuando se detectan signos de fracaso terapéutico a fin de evitar un mayor deterioro de la función hepática. Un caso de HIA está en verdadera remisión cuando los síntomas desaparecen; las pruebas de laboratorio muestran niveles normales de aminotransferasas séricas, bilirrubina y gammaglobulina; y los estudios histológicos muestran un tejido hepático normal o una cirrosis inactiva.2 El fracaso del tratamiento se define como el empeoramiento de la enfermedad a pesar del cumplimiento de la medicación, y los pacientes pueden desarrollar ictericia, ascitis o encefalopatía hepática. Una respuesta incompleta al tratamiento mostraría alguna o ninguna mejoría en las características clínicas, de laboratorio e histológicas a pesar de la adherencia a la medicación, a veces años después de haber completado la terapia. En caso de toxicidad del fármaco, el paciente puede experimentar efectos adversos intolerables, y la dosis deberá reducirse lentamente.2 Al suspender el tratamiento, el paciente debe seguir con un agente alternativo que sea tolerado.2
Conclusión
A partir de la información presentada, está claro que el uso de terapias alternativas en la población de pacientes con HIA puede considerarse en pacientes que no toleran o no tienen éxito con el régimen estándar de prednisona. Los médicos tienen ahora la posibilidad de individualizar el tratamiento para adaptarlo a las necesidades terapéuticas de poblaciones específicas de pacientes con HIA. En la actualidad existen pocos datos clínicos para recomendar el uso de ciclosporina, tacrolimus, MMF, alopurinol, infliximab y rituximab para una población de pacientes más amplia. Con el aumento del uso de estos agentes alternativos para tratar la HIA, existen más oportunidades para evitar el fracaso del tratamiento, la respuesta incompleta y la toxicidad de los fármacos en el futuro.
1. Liberal R, Grant CR, Mieli-Vergani G, Diego Vergani D. Hepatitis autoinmune: una revisión exhaustiva. J Autoimmun. 2013;41:126-139.
2. Manns MP, Czaja AJ, Gorham JD, et al. Diagnóstico y manejo de la hepatitis autoinmune. Hepatology. 2010;51(6):1-31.
3. Smith BD, Morgan Rl, Beckett GA, et al; Centers for Disease Control and Prevention. Recomendaciones para la identificación de la infección crónica por el virus de la hepatitis C entre las personas nacidas durante 1945-1965. MMWR Recomm Rep. 2012;61(RR-4):1-32.
4. Wolf DC. Hepatitis autoinmune: fundamentos de la práctica, antecedentes, fisiopatología. Medscape. 28 de diciembre de 2015. http://emedicine.medscape.com/article/172356-overview#a3. Consultado el 18 de enero de 2016.
5. Manns MP, Taubert R. Tratamiento de la hepatitis autoinmune. Clin Liver Dis. 2014;3(1):15-17.
6. Zachou K, Muratori P, Koukoulis GK, et al. Review article: autoimmune hepatitis-current management and challenges. Ailment Pharmacol Ther. 2013;38(8):887-913.
7. Makol A, Watt KD, Chowdhary VR. Hepatitis autoinmune: una revisión del diagnóstico y tratamiento actual. Hepat Res Treat. 2011;2011:390916.
8. Fialho A, Fialho A, Carey WD. Hepatitis autoinmune. Cleveland Clinic Center for Continuing Education; julio de 2015. www.clevelandclinicmeded.com/medicalpubs/diseasemanagement/hepatology/chronic-autoimmune-hepatitis/#top. Consultado el 25 de enero de 2016.
9. Prospecto de Entocort EC (budesonida). Södertälje, Suecia: AstraZeneca; 2009. www.accessdata.fda.gov/drugsatfda_docs/label/2009/021324s008lbl.pdf. Consultado el 26 de enero de 2016.
10. Floreani A, Liberal R, Vergani D, Mieli-Vergani G. Hepatitis autoinmune: contrastes y comparaciones en niños y adultos: una revisión exhaustiva. J Autoimmun. 2013;46:7-16.
11. Prospecto de Sandimmune (ciclosporina). East Hanover, NJ: Novartis Pharmaceuticals Corp; marzo de 2015. www.pharma.us.novartis.com/product/pi/pdf/sandimmune.pdf. Consultado el 26 de enero de 2016.
12. Prospecto de Prograf (tacrolimus). North-brook, IL: Astellas Pharma US, Inc; mayo de 2015. www.astellas.us/docs/prograf.pdf. Consultado el 26 de enero de 2016.
13. Jothimani D, Cramp ME, Cross TJ. Papel de micofenolato mofetilo para el tratamiento de la hepatitis autoinmune-un estudio observacional. J Clin Exp Hepatol. 2014;4(3):221-225.
14. Prospecto de CellCept (micofenolato mofetilo). South San Francisco, CA: Genentech USA, Inc; julio de 2015. www.gene.com/download/pdf/cellcept_prescribing.pdf. Consultado el 26 de enero de 2016.
15. de Boer YS, Van Gerven NM, de Boer NK, et al. El alopurinol optimiza de forma segura y eficaz los metabolitos de tiopurina en pacientes con hepatitis autoinmune. Aliment Pharmacol Ther. 2013;37(6):640-646.
16. Información del producto Zyloprim (alopurinol). San Diego, CA: Prometheus Laboratories Inc; noviembre de 2009. http://dailymed.nlm.nih.gov/dailymed/fda/fdaDrugXsl.cfm?setid=342832b5-1a32-4bea-bc49-ab0fd152154e&type=display. Consultado el 26 de enero de 2016.
17. Micromedex 2.0. Greenwood Village, CO: Truven Health Analytics, Inc. www.micromedexsolutions.com. Consultado el 25 de enero de 2016.
18. Prospecto de Imuran (azatioprina). San Diego, CA: Prometheus Laboratories Inc; mayo de 2011. www.accessdata.fda.gov/drugsatfda_docs/label/2011/016324s034s035lbl.pdf. Consultado el 26 de enero de 2016.
19. Prospecto de Remicade (infliximab). Horsham, PA: Janssen Biotech, Inc; octubre de 2015. www.remicade.com/shared/product/remicade/prescribing-information.pdf. Consultado el 9 de mayo de 2016.
20. Prospecto de Rituxan (rituximab). San Francisco, CA: Genentech, Inc; abril de 2016. www.gene.com/download/pdf/rituxan_prescribing.pdf. Consultado el 9 de mayo de 2016.
21. Moura M, Liberal R, Cardoso H. Manejo de la hepatitis autoinmune: enfoque en los tratamientos farmacológicos más allá de los corticosteroides. World J Hepatol. 2014;6(6):410-418.